Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
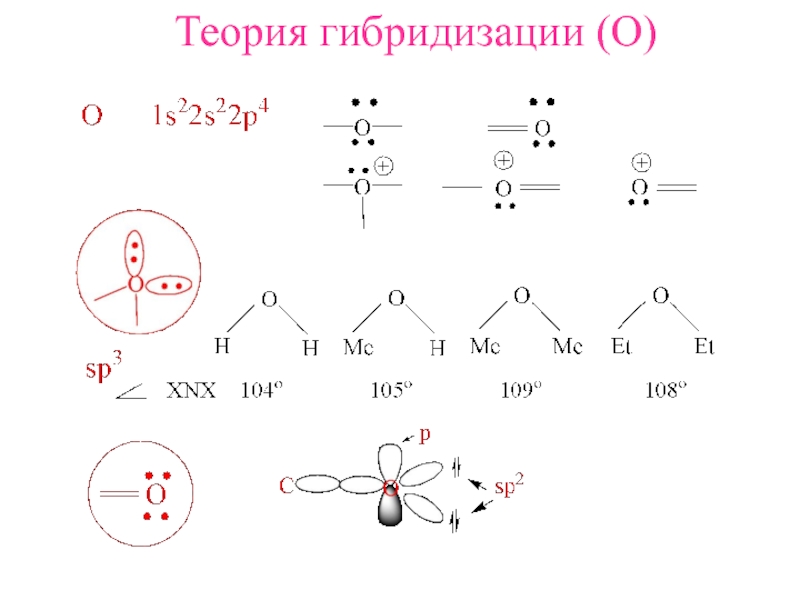
Теория гибридизации (O )
Содержание
- 1. Теория гибридизации (O )
- 2. Слайд 2
- 3. Распределение электронной плотности (x-ray, 25k, ELI, электр.
- 4. Слайд 4
- 5. sp3
- 6. Слайд 6
- 7. Слайд 7
- 8. sp2
- 9. Слайд 9
- 10. Слайд 10
- 11. Изоэлектронность = изоструктурностьAB
- 12. HF/6-31G* DHобр 22.4 (стабильнее) 28.1 ккал/мольIGLO (С2,3 )
- 13. PBE/3z (11s6p2d)/[6s3p2d] )РСА (2h, 3h)2.1 Å50oГ.И. Бородкин
- 14. J. Kochi et al. J. Org. Chem. 1998, 8630X Ray
- 15. NO+ + p-(t-BuMeO)calix[4]arene (X Ray) J. Kochi et al. Ang. Chem. Int. 2000, 2123K ~108необычностабилен !
- 16. RI-MP2/L1 (Урацил)
- 17. J. Kochi et al. J. Chem. Soc., P. T. 2, 2000, 1919SP-гибр.РСА
- 18. Галогенониевые ионыR-Hal+-R I+
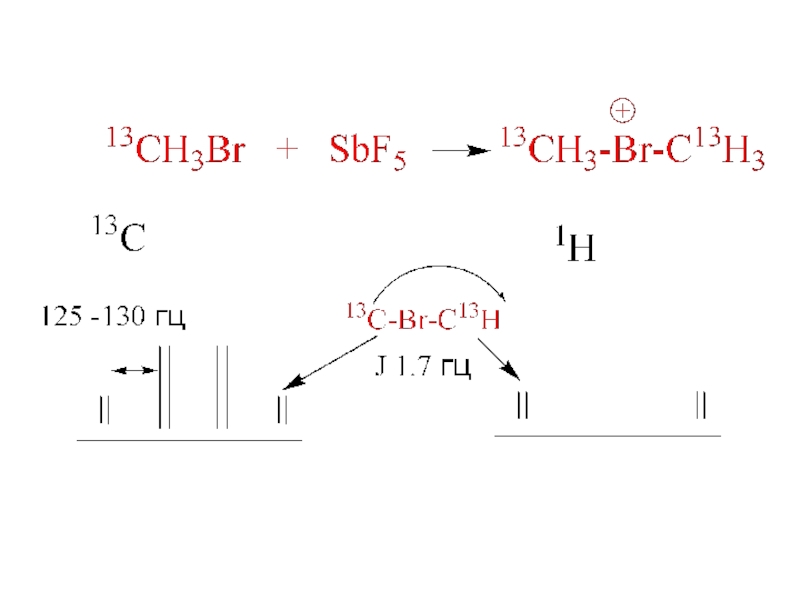
- 19. Алкилгалогенониевые ионыG. Olah, ЯМРСH2-CH2HalF+ SbF5SO2-60oСH2-CH2Hal+Hal = I, Br
- 20. 2 AlkHal + SbF5SbF5SO2, -60o[AlkHal+Alk] SbF5Hal-Hal =
- 21. Слайд 21
- 22. 3-ий и более периоды ?2-ой период
- 23. Термическая устойчивостьAr2I+ > Ar2Br+ > Ar2Cl+ >>Alk2I+ > Alk2Br+ > Alk2Cl+ >
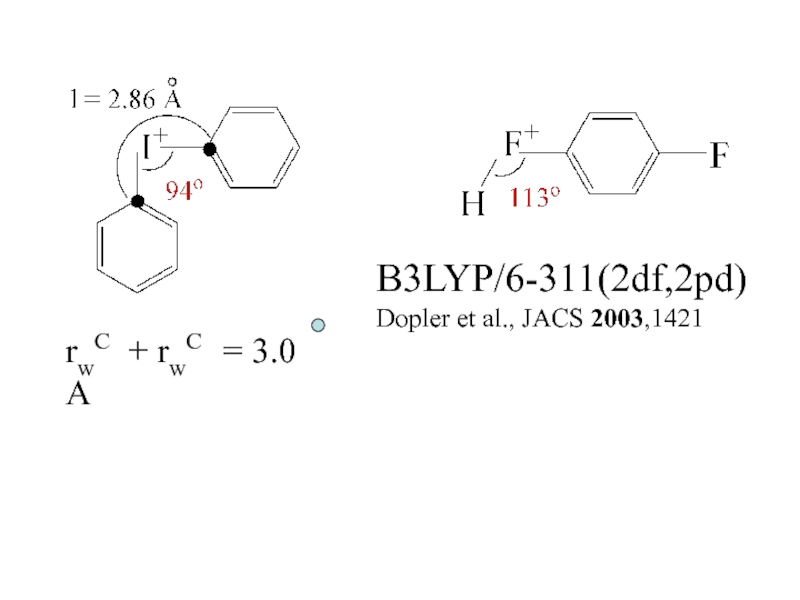
- 24. B3LYP/6-311(2df,2pd)Dopler et al., JACS 2003,1421rwC + rwC = 3.0 A
- 25. Нет склонности к инверсии (P, As, Sb)DG
- 26. Оптические антиподыAlk1-P-Alk2
- 27. Псевдооктаэдр.oт-но I, промеж.AX3E, AX3E2
- 28. Скачать презентанцию
Слайды и текст этой презентации
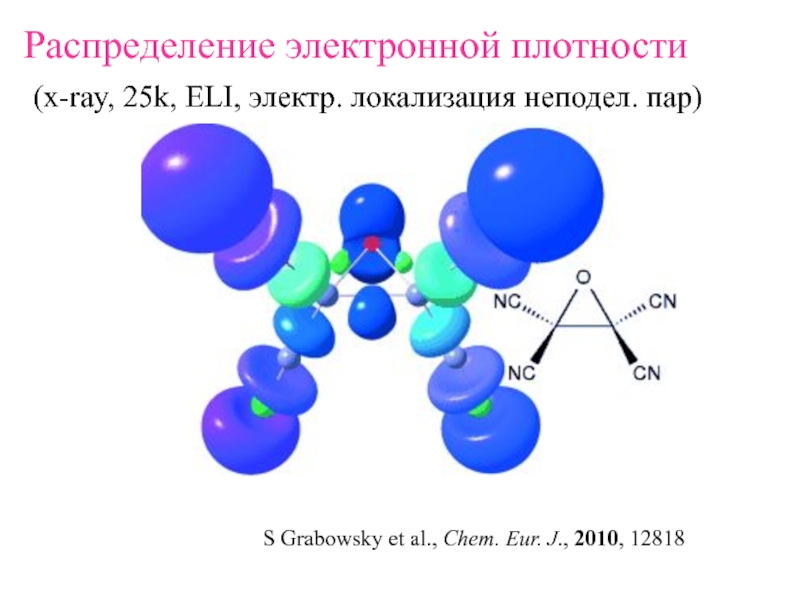
Слайд 3Распределение электронной плотности
(x-ray, 25k, ELI, электр. локализация неподел. пар)
S
Grabowsky et al., Chem. Eur. J., 2010, 12818
Слайд 12HF/6-31G* DHобр 22.4 (стабильнее) 28.1 ккал/моль
IGLO (С2,3 ) d 67.2 м.д. 183.4,
189.8
м.д.
С2,3 (эксп.) 190.2 м.д.
G.I. Borodkin et al. Mend. Commun. 1999, 83
Слайд 13PBE/3z (11s6p2d)/[6s3p2d] )
РСА (2h, 3h)
2.1 Å
50o
Г.И. Бородкин и др.
Докл.
АН СССР, 1986, 1364
Г.И. Бородкин и др. Ж. орг.
хим. 2006. 418Слайд 15NO+ + p-(t-BuMeO)calix[4]arene (X Ray)
J. Kochi et al. Ang.
Chem. Int. 2000, 2123
K ~108
необычно
стабилен !
Слайд 18Галогенониевые ионы
R-Hal+-R I+ Br+
Cl+
Ip, eV 10.5 11.8 13.0
17.4 I Br Cl F
Ar-Hal+-Ar (акад. Несмеянов)
PhN2BF4- + PhBr [PhBr+Ph] BF4-
PhN2BF4- + PhCl [PhCl+Ph] BF4-
Т.пл. 120-121о
Т.пл. 109-110о
Слайд 202 AlkHal + SbF5
SbF5
SO2, -60o
[AlkHal+Alk] SbF5Hal-
Hal = I, Br, Cl
AlkHal+Alk
или AlkHal SbF5- ?
Слайд 223-ий и более периоды ?
2-ой период NH3
OH2
107o 104o3-ий период PH3 SH2
94o 92o
4-ый период AsH3 SeH2
91o 90o
Слайд 25Нет склонности к инверсии (P, As, Sb)
DG =
ккал/моль (ab initio)
NH3 6 H3O
1-2PH3 36 H3S+ 32
AsH3 46 H3Se+ 30
Слайд 26Оптические антиподы
Alk1-P-Alk2
Ar
Alk1-As-Alk2
Ar
Alk1-Sb-Alk2
Ar
[a] +255o
не рацемизуется
при 110о
R1-S+-R2
R3
R1-S+-R2
O-









![Теория гибридизации (O ) PBE/3z (11s6p2d)/[6s3p2d] )РСА (2h, 3h)2.1 Å50oГ.И. Бородкин и др. Докл. АН PBE/3z (11s6p2d)/[6s3p2d] )РСА (2h, 3h)2.1 Å50oГ.И. Бородкин и др. Докл. АН СССР, 1986, 1364 Г.И. Бородкин и](/img/thumbs/7d534164e346cbf2ccdec9c974d91647-800x.jpg)

![Теория гибридизации (O ) NO+ + p-(t-BuMeO)calix[4]arene (X Ray) J. Kochi et al. Ang. Chem. Int. 2000, 2123K ~108необычностабилен ! NO+ + p-(t-BuMeO)calix[4]arene (X Ray) J. Kochi et al. Ang. Chem. Int. 2000, 2123K ~108необычностабилен !](/img/thumbs/6ccf4ca50d0632f5555f104d05e1b200-800x.jpg)




![Теория гибридизации (O ) 2 AlkHal + SbF5SbF5SO2, -60o[AlkHal+Alk] SbF5Hal-Hal = I, Br, ClAlkHal+Alk или AlkHal SbF5- ? 2 AlkHal + SbF5SbF5SO2, -60o[AlkHal+Alk] SbF5Hal-Hal = I, Br, ClAlkHal+Alk или AlkHal](/img/thumbs/1968936be84b26cf871ea9676c4b7e07-800x.jpg)