Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теория растворов. Механизм растворения газов, жидкостей и твердых тел. Способы
Содержание
- 1. Теория растворов. Механизм растворения газов, жидкостей и твердых тел. Способы
- 2. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТТеории растворов:Физическая теория Суть: процесс
- 3. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТТеории растворов:3. Физико-химическая теорияСуть: Процесс
- 4. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТРастворы – это гомогенные системы
- 5. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКлассификации растворов по различным признакамПо
- 6. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКлассификации растворовПо количеству растворенного вещества:Ненасыщенный
- 7. Растворимость компонентовСУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 8. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ4. Разбавленный – это раствор
- 9. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 10. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 11. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВзаимная растворимость жидкостей
- 12. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТРастворимость газов
- 13. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТИстинная масса атомов очень мала,
- 14. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМоль – это количество вещества
- 15. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМасса одного моля вещества, содержащего
- 16. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКонцентрация – это масса или
- 17. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМассовая доля (ω) – отношение
- 18. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМольная доля (χ, хи) –
- 19. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМолярная концентрация или молярность –
- 20. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМолярная концентрация эквивалента или эквивалентная
- 21. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМоляльная концентрация или моляльность –
- 22. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТРастворимость (коэффициент растворимости) (в) –
- 23. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКоллигативные свойства растворов - это
- 24. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЗависимость осмотического давления от объема
- 25. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТИзменение осмотического давления раствора имеет
- 26. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Понижение давления пара растворителя над раствором
- 27. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПонижение температуры замерзания и повышение
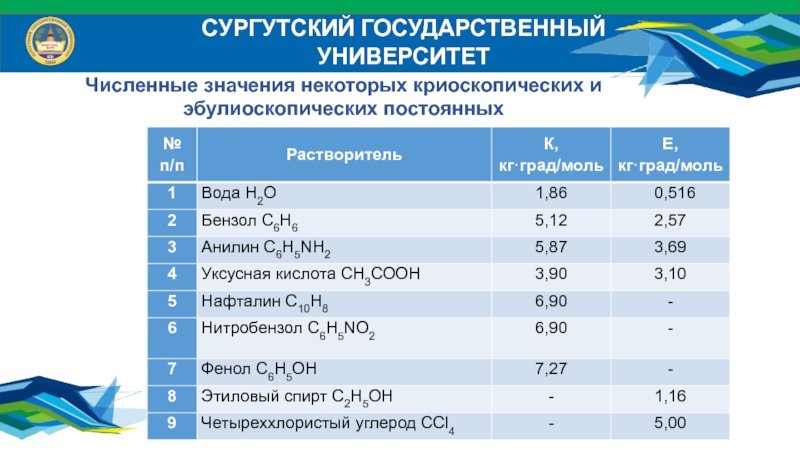
- 28. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЧисленные значения некоторых криоскопических и эбулиоскопических постоянных
- 29. Теория электролитической ионизации АррениусаПри растворении солей, кислот
- 30. Степень ионизации – это отношение числа ионизированных
- 31. Другая количественная характеристика электролитической ионизации является константа
- 32. Для слабых электролитов:Из выражения следует, что если
- 33. Представление об образовании ионных пар были введены
- 34. Например: рассчитать параметр Бьёррума для однозарядного иона
- 35. Очевидно, что для растворов электролитов
- 36. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТОсмотическое давление раствора электролитаОтносительное понижение давления насыщенного пара над раствором:
- 37. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПонижение температуры замерзания и повышение
- 38. Спасибо за внимание!Вопросы?СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 39. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Теория растворов. Механизм растворения газов, жидкостей и твердых тел. Способы
выражения концентраций растворов.
Слайд 2СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Теории растворов:
Физическая теория
Суть: процесс растворения рассматривается как
процесс равномерного
распределения частиц растворяемого вещества по всему объему растворителя,
при этом считается, что отсутствует взаимодействие между частицами растворенного вещества и растворителя.
Подтверждением этой теории является тот факт, что целый ряд свойств:
повышение температуры кипения, понижение температуры замерзания,
осмотическое давление, давление пара – зависят только от концентрации
растворенного вещества, но не зависит от его природы.
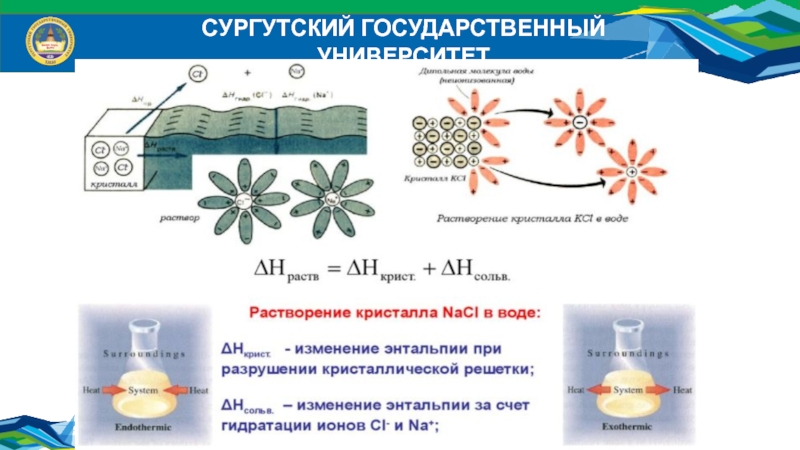
2. Химическая теория:
Суть: процесс растворение осуществляется за счет взаимодействия молекул или
ионов растворяемого вещества с молекулами растворителя за счет водородной
связи или электростатического взаимодействия полярных молекул веществ.
Слайд 3СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Теории растворов:
3. Физико-химическая теория
Суть: Процесс растворения можно рассматривать
как сложный физико-хими-
ческий процесс, в котором ярко проявляется взаимодействие между
частицами (молекулами или ионами) различной химической природы.
Слайд 4СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Растворы – это гомогенные системы переменного состава, находящиеся
в состоянии химического равновесия.
Растворы сходны как с механическими смесями частиц,
так и с индивидуальными химическими соединениями. От первых они отличаются тем, что любой объем
раствора обладает таким же химическим составом, что и его масса.
От химических соединений растворы отличаются тем, что их состав может изменяться в зависимости от количеств взятых компонентов. Другое отличие – это
природа связи.
Слайд 5СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Классификации растворов по различным признакам
По агрегатному состоянию:
1. Растворы
газов в газах (газовые смеси);
Жидкие растворы:
- растворов газов в жидкости;
-
растворы жидкостей в жидкости- растворы твердых тел в жидкостях;
Твердые растворы.
По степени дисперсности растворенного вещества:
Грубодисперсные системы;
Коллоидные растворы;
Истинные растворы.
Слайд 6СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Классификации растворов
По количеству растворенного вещества:
Ненасыщенный – это раствор,
в котором еще можно растворить добавочное
количество данного вещества;
Насыщенный –
это раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор находится в
равновесии с растворяемым веществом;
Пересыщенный – это раствор, содержащий значительно большее количество
растворенного вещества, чем его требуется для насыщения при
данной температуре.
Пересыщенные растворы – неустойчивые системы, существующие только при
отсутствии в системе твердых частиц растворенного вещества.
Слайд 8СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
4. Разбавленный – это раствор с низким содержанием
растворенного вещества.
Отметим, что не всегда разбавленный раствор является ненасыщенным;
5.
Концентрированный - раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему
малое количество растворённого вещества. Деление растворов на
концентрированные и разбавленные не связано с делением на насыщенные
и ненасыщенные.
Так насыщенный 0,0000134М раствор хлорида серебра является очень
разбавленным, а 4М раствор бромида калия, будучи очень концентрированным,
не является насыщенным. Т.е. Граница между разбавленным и концентрирован-
ным растворами весьма условна.
Слайд 11СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
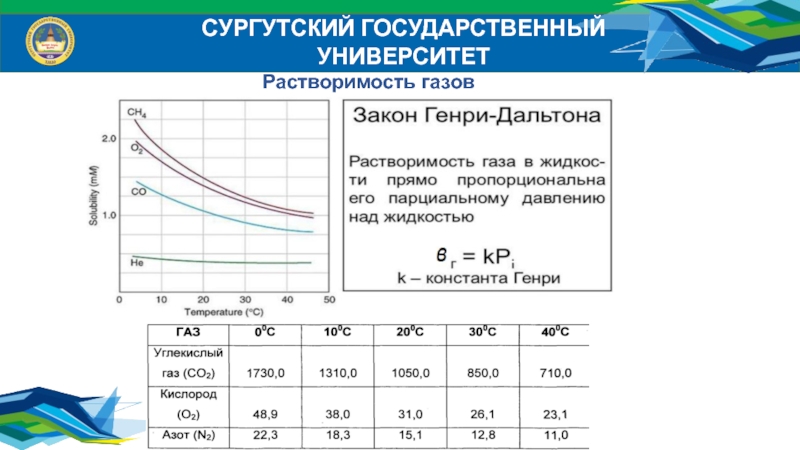
Взаимная растворимость жидкостей
В зависимости
от природы жидкости могут смешиваться друг с другом
в
различных соотношениях:Смешиваются друг с другом в любых соотношениях с образованием
однородного раствора (вода и глицерин, вода и этиловый спирт и т.п.);
2. Обладают ограниченной растворимостью друг в друге (вода и анилин, вода
и эфир и т.п.) ;
3. Практически нерастворимы друг в друге (вода и бензол, вода и ртуть и т.п.)
Слайд 13СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Истинная масса атомов очень мала, например, масса изотопа
атома
углерода 12 (С12) составляет 2∙10-23 г, поэтому была введена
атомная единица массы (а.е.м.), равная 1/12 массы атома углерода, что равно
1,667∙10-24 г.
Значение Мr будет равно сумме относительных атомных масс:
;
Слайд 14СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Моль – это количество вещества (n), содержащее столько
структурных
единиц (атомов, молекул, ионов, электронов и др.), сколько содержится
в 0,012 кг изотопа углерода .
.
Установлено, что 12 г углерода содержит 6,02·1023 атомов,
28 г азота – 6,02·1023 молекул.
Число частиц, равное 6,02·1023 называется числом Авогадро
и имеет размерность моль-1.
Например: количество вещества навески воды, содержащей 1,505·1024 молекул
составляет:
моль.
Слайд 15СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Масса одного моля вещества, содержащего 6,02·1023 частиц,
называется
молярной массой размерностью г/моль.
Она равна
отношению массы данной навески вещества m кего количеству:
, г/моль.
Так молярная масса вещества численно равна его относительной
молекулярной массе .
Для определения молярной массы вещества определяют
его относительную молекулярную массу и приписывают
ей размерность г/мольь.
Слайд 16СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Концентрация – это масса или количество растворенного вещества
в единице
массы или объема раствора или растворителя.
Слайд 17СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Массовая доля (ω) – отношение массы растворенного вещества
(г),
содержащегося в растворе, к общей массе раствора (г) или
это масса растворенного вещества в 100 г раствора, что позволяет производить
вычисления при недостатке условий. Массовая доля может быть
выражена в массовых долях единицы или в процентах:
, масс. доли;
, % масс.
– масса растворенного вещества, г;
– масса раствора, г;
– масса растворителя, г.
Масса раствора складывается из массы растворенного вещества и
растворителя:
где
– объем раствора, мл;
ρ – плотность раствора, г/мл.
Слайд 18СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Мольная доля (χ, хи) – это количество растворенного
вещества (nв) или растворителя (ns) к сумме количеств всех веществ
в растворе.В растворе, состоящем из растворителя и единственного растворенного
вещества мольную долю рассчитывают по формуле:
Мольная доля растворителя в растворе:
Причем, сумма мольных долей растворенного вещества и растворителя в растворе равна единице:
где количества растворенного вещества и растворителя соответственно,
моль
Слайд 19СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Молярная концентрация или молярность – это количество молей
растворенного вещества в единице объема раствора в литрах или количество
молей растворенного вещества в 1 л раствора.моль/л; М
где Vp – объем раствора, л
Слайд 20СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Молярная концентрация эквивалента или эквивалентная концентрация, или
нормальность –
это отношение количества эквивалентов растворенного вещества
к единице объема раствора.
моль-экв/л; н.фактор эквивалентности, величина, характеризующая процесс.
z – это основность кислоты; кислотность основания и др.
моль-экв./л; н.
Слайд 21СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Моляльная концентрация или моляльность – это количество
растворенного
вещества в единице массы растворителя.
моль/кгмасса растворителя, кг
Слайд 22СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Растворимость (коэффициент растворимости) (в) – это масса растворенного
вещества в 100 г растворителя при данной температуре, что соответствует
насыщенному раствору.Слайд 23СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
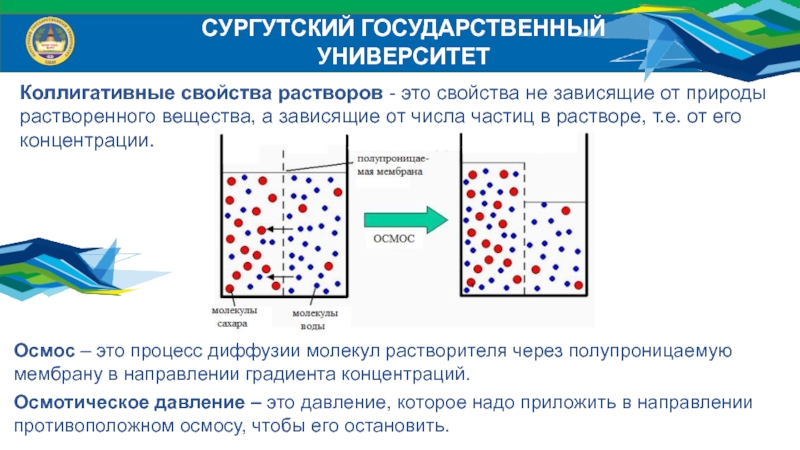
Коллигативные свойства растворов - это свойства не зависящие
от природы
растворенного вещества, а зависящие от числа частиц в
растворе, т.е. от егоконцентрации.
Осмос – это процесс диффузии молекул растворителя через полупроницаемую
мембрану в направлении градиента концентраций.
Осмотическое давление – это давление, которое надо приложить в направлении
противоположном осмосу, чтобы его остановить.
Слайд 24СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Зависимость осмотического давления от объема раствора, количества
растворенного
вещества и температуры выражается законом Вант-Гоффа
и уравнением, аналогичным уравнению Менделеева-Клапейрона.
Закон
Вант-Гоффа: Осмотическое давление (Росм) прямо пропорционально молярной концентрации раствора (СВ) и абсолютной температуре (Т). Математически эта зависимость выражается уравнением Вант-Гоффа:Росм=СВRT,
где R – универсальная газовая постоянная, Дж/(моль·К);
Т – абсолютная температура;
V – объем, м3
Поскольку СВ=n/Vр, то формально уравнение Вант-Гоффа аналогично уравнению состояния идеального газа.
Слайд 25СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
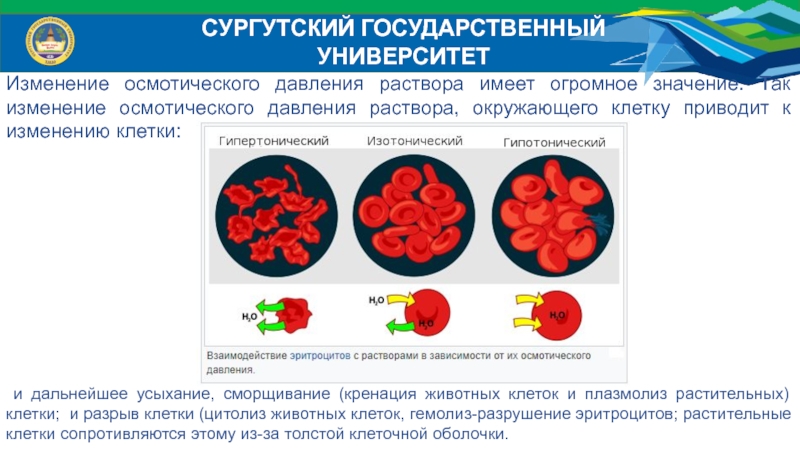
Изменение осмотического давления раствора имеет огромное значение. Так
изменение осмотического давления раствора, окружающего клетку приводит к изменению клетки:
и дальнейшее усыхание, сморщивание (кренация животных клеток и плазмолиз растительных) клетки; и разрыв клетки (цитолиз животных клеток, гемолиз-разрушение эритроцитов; растительные клетки сопротивляются этому из-за толстой клеточной оболочки.Слайд 27СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Понижение температуры замерзания и
повышение температуры кипения растворов
Δtкип=tкип
р-ра – tкип р-ля; Δtзам=tзам
р-ра – tзам р-ля.Раулем было установлено, что обе величины - Δtкип и Δtзам – прямо пропорциональны моляльности растворов:
Δtкип=Е·Сm
Δtзам=К·Сm,
где Е и К – соответственно эбулиоскопическая и криоскопическая константы, зависящие от природы растворителя (прил. 2 задачника),
Сm – моляльность раствора, моль/кг
Слайд 28СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Численные значения некоторых криоскопических и
эбулиоскопических постоянных
Слайд 29Теория электролитической ионизации Аррениуса
При растворении солей, кислот и оснований вводе
происходит диссоциация этих веществ с образованием заряженных частиц – катионов
и анионов;Электрическая проводимость водных растворов солей, кислот и оснований пропорциональна общей концентрации ионов в растворе.
Электролитическая ионизация вызывается взаимодействием полярных молекул растворителя с частицами растворенного вещества, что приводит к образованию гидратированных ионов растворенного газообразного и кристаллического вещества с ионной связью. Переход ионов в раствор сопровождается гидратацией ионов. Процесс гидратации самопроизволен и экзотермичен. Гидратация протонов идет с образованием иона гидроксония :
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 30Степень ионизации – это отношение числа ионизированных частиц к общему
числу растворенных частиц, которая выражается в процентах и долях:
Если
, то вещество является сильным электролитом;Если , то вещество является слабым электролитом.
Степень ионизации зависит от:
температуры: поскольку процесс ионизации – это эндотермический процесс, то с увеличением температуры степень ионизации увеличивается;
природы растворителя: чем полярнее растворитель, тем выше степень ионизации растворенного вещества;
концентрация раствора: при разбавлении степень ионизации возрастает.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 31Другая количественная характеристика электролитической ионизации является константа ионизации:
которая зависит от
природы электролита и температуры.
Чем выше константа ионизации, тем сильнее
электролит.Между константой ионизации и степенью электролитической ионизации существует количественная связь: пусть
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 32Для слабых электролитов:
Из выражения следует, что если разбавить раствор в
100 раз, то степень ионизации возрастет в 10 раз.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТСлайд 33Представление об образовании ионных пар были введены Бьёррумом и Семенченко.
Суть
концепции: для каждого растворителя свой параметр Бьёррума (q), который представляет
собой расстояние, на которое подходят ионы друг к другу в процессе образования ионных пар.Этот параметр определяется из соотношения:
заряды катиона и аниона;
заряд электрона;
диэлектрическая проницаемость растворителя;
постоянная Больцмана;
абсолютная температура.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 34Например: рассчитать параметр Бьёррума для однозарядного иона в воде при
25 ºС (298 К)
Если расстояние между
ионами меньше этой величины (q ‹ 0,357 нм), то растворенную частицу можно считать недиссоциированной; если q › 0,357 нм, то ионы рассматриваются как изолированные.Поэтому коллигативные свойства растворов, определенные экспериментально, меньше рассчитанных в педположении полной ионизации. Для описания реальных растворов Льюис (1907г.) ввел формальное представление об эффективной концентрации – активности, которая связана с истиной концентрацией формулой:
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 35
Очевидно, что для растворов электролитов ;
для
растворов неэлектролитов .
Изотонический коэффициент можно связать со степенью ионизации:
Z – число ионов, на которые распадается данный электролит.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 36СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Осмотическое давление раствора электролита
Относительное понижение давления насыщенного пара
над раствором:
Слайд 37СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Понижение температуры замерзания и
повышение температуры кипения растворов
электролитов
Δtкип=tкип р-ра – tкип р-ля;
Δtзам=tзам р-ра – tзам р-ля.Раулем было установлено, что обе величины - Δtкип и Δtзам – прямо пропорциональны моляльности растворов:
Δtкип=i·Е·Сm,
Δtзам=i·К·Сm,
где Е и К – соответственно эбулиоскопическая и криоскопическая константы, зависящие от природы растворителя (прил. 2 задачника),
Сm – моляльность раствора, моль/кг