Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамический анализ уравнений Гаммета
Содержание
- 1. Термодинамический анализ уравнений Гаммета
- 2. Термодинамический анализ уравнения Гаммета. Общий характер принципа
- 3. Принцип ЛСЭ
- 4. Принцип ЛСЭ (линейности свободных энергий) - одинаковые
- 5. ΔG≠ = ΔH≠ - TΔS≠ΔGp = ΔHp
- 6. lg(kR/kH) = 1/ 2.3RT (ΔG≠H - ΔG≠R)
- 7. lgA=а+bЕa (1)где и энтальпия и энтропияактивации, b
- 8. Зависимость ρ от температурыΔΔG =
- 9. Τ2 d2ρ + 2Τ δρ
- 10. ΔΔGR = ΔΔHR – TΔΔSR = -2.3RTρσ
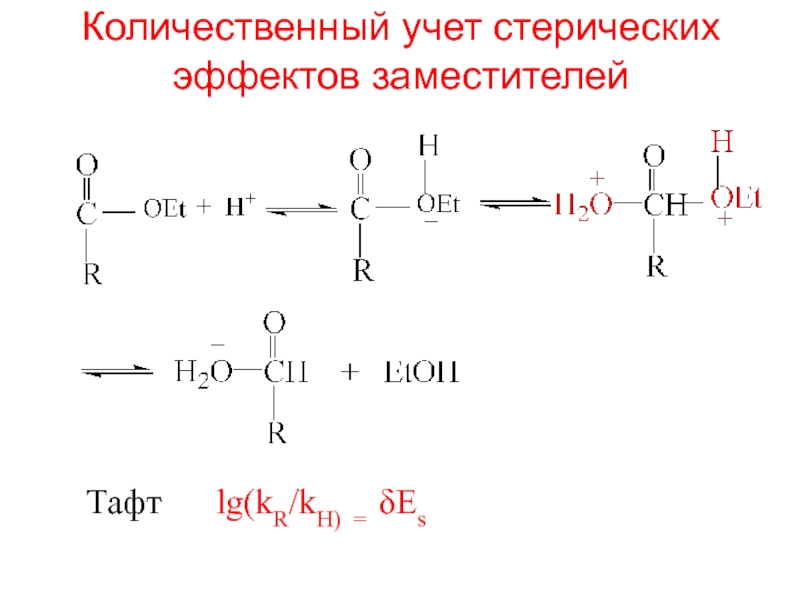
- 11. Количественный учет стерических эффектов заместителейТафт lg(kR/kH) = δEs
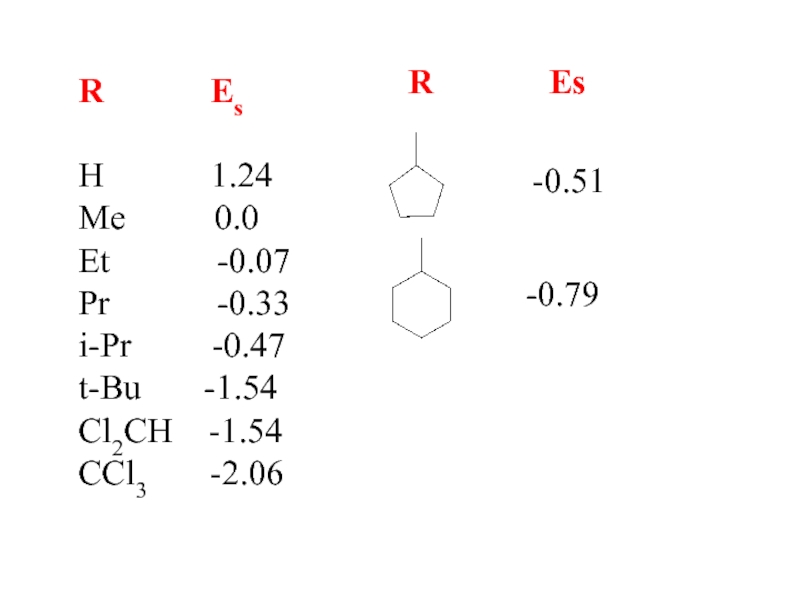
- 12. R EsH
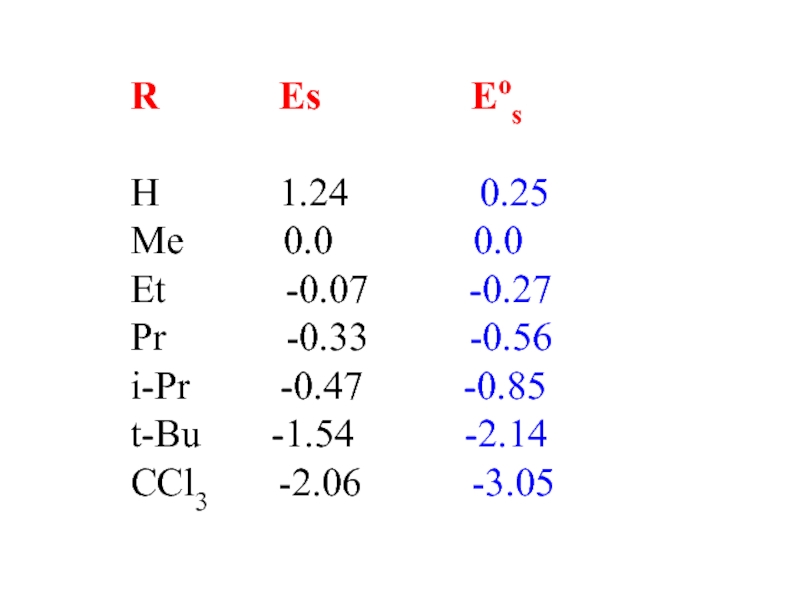
- 13. Уравнение Пальма (учет гиперконьюгации)Eos = Es
- 14. R Es
- 15. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Теоретические основы органической
химии
Термодинамический анализ
уравнения Гаммета
Лекция 13
(электронно-лекционный курс)
Проф. Бородкин Г.И.
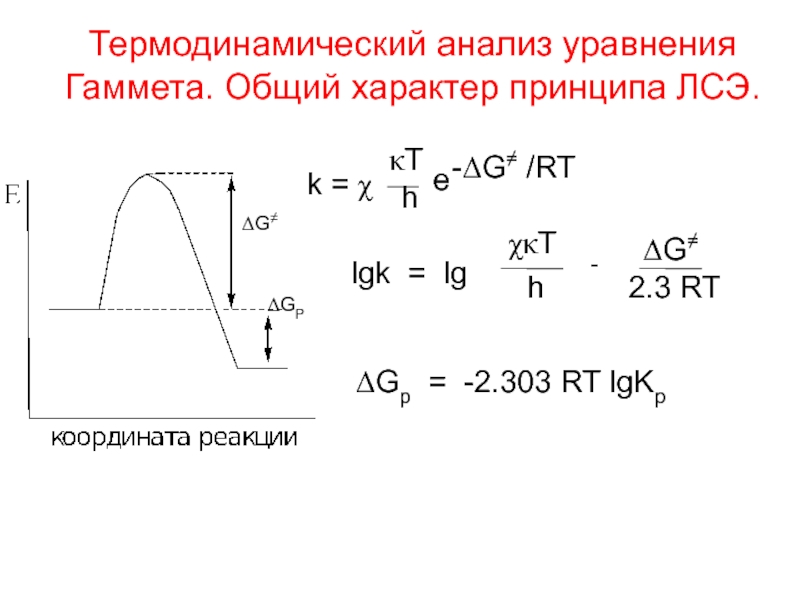
Слайд 2Термодинамический анализ уравнения
Гаммета. Общий характер принципа ЛСЭ.
ΔG≠
ΔGP
k = χ
κT
h
e
-ΔG≠ /RT
lgk
= lg
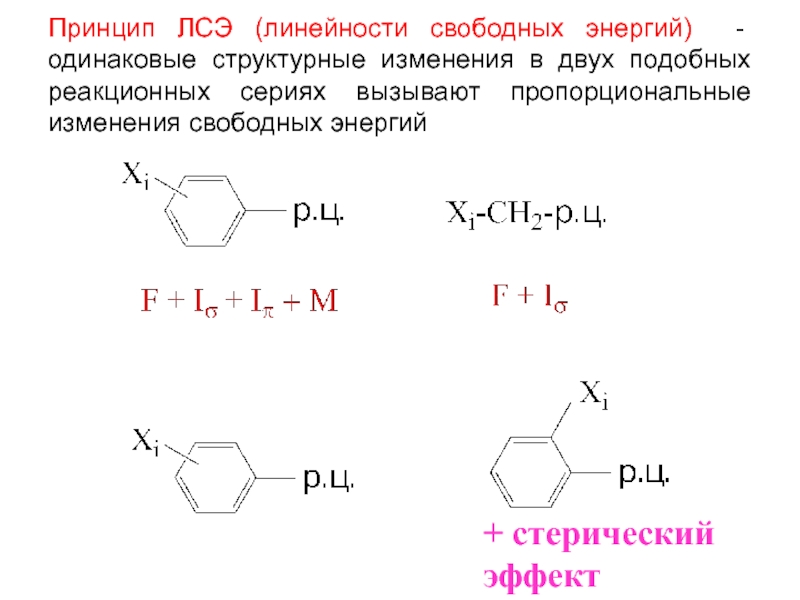
Слайд 4Принцип ЛСЭ (линейности свободных энергий) - одинаковые структурные изменения в
двух подобных реакционных сериях вызывают пропорциональные изменения свободных энергий
+ стерический
эффект
Слайд 5ΔG≠ = ΔH≠ - TΔS≠
ΔGp = ΔHp – TΔSp
Для i-реакции:
1)
ΔSi = const
ΔSi≠ = const
Изоэнтропийная серия
ΔHi = const
ΔHi≠
= constИзоэнтальпийная серия
3) ΔΔHi≠ = βΔ ΔSi≠
Изокинетическая серия
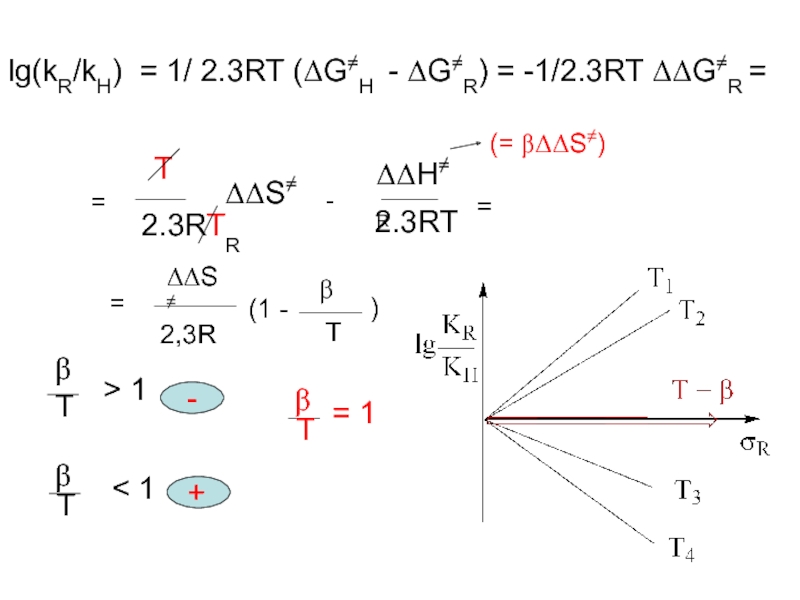
Слайд 6lg(kR/kH) = 1/ 2.3RT (ΔG≠H - ΔG≠R) = -1/2.3RT ΔΔG≠R
=
=
T
2.3RT
ΔΔS≠R
-
ΔΔH≠R
2.3RT
=
=
ΔΔS≠
2,3R
(1 -
β
T
)
(= βΔΔS≠)
β
T
> 1
β
T
< 1
-
+
β
T
= 1
Слайд 7lgA=а+bЕa (1)
где
и
энтальпия и энтропия
активации, b всегда >0
Компенсационный эффект
КОМПЕНСАЦИОННЫЙ
ЭФФЕКТ
кинетический: значения энергий активации Е
и предэкспоненциальных множителей А
в
ур-нии Аррениуса для ряда однотипных реакций изменяются симбатно (или изменения ΔH= и ΔS=).
(2)
Слайд 8Зависимость ρ от температуры
ΔΔG = ΔΔH – TΔΔS
= -2.3RTlg(kR/kH) = -2.3RTρσR (1)
d(ΔΔG)
dΤ
= −ΔΔS = -2.3R σR(ρ +
Tδρ
δΤ
) (2)
ΔΔΗ = ΤΔΔS − 2.3RΤρσR = T[2.3RσR(ρ + Tdρ ] -
2.3RTρσR = 2.3RσRT2 dρ
dT
dT
(3)
d(ΔΔΗ)
dT
= 2.3RσR(2T dρ + T2 d2ρ) = 0
dT
dT2
Слайд 9Τ2 d2ρ + 2Τ δρ = 0
(4)
dT2
dT
ρ = c1 +
Τ
c2
(5)
Частные случаи:
c1 = 0 ρ =
c
Τ
Изоэнтропийная серия
ΔΔG = ΔΔΗ − TΔΔS = −2.3RTlg(kR/kH) = -2.3 RTρσ =
−2.3RTc/T
т.е. ΔΔG = -2.3cRσ или ΔΔS = 0
1)
Слайд 10ΔΔGR = ΔΔHR – TΔΔSR = -2.3RTρσ = -2.3c1RTσ
2)
C2 =
0 ρ = C1
изоэнтальпийнаясерия
ΔΔH = 0, иначе ΔΔH = T(ΔΔS-2.3c1Rσ)
const
но ΔΔH = f(T)
3) C1 = 0, C2 = 0
C1 + C2/T = 0
Tизокинетич. = -C2/C1
Слайд 13Уравнение Пальма
(учет гиперконьюгации)
Eos = Es - 0.33(3-nH) +
0.13nC
nH – число атомов водорода, вступающих
в
гиперконьюгациюnС – число атомов углерода, вступающих
в гиперконьюгацию
коэфф. 033 и 0.13 на основе метода Хюккеля
Слайд 14R Es
Eos
H
1.24 0.25Me 0.0 0.0
Et -0.07 -0.27
Pr -0.33 -0.56
i-Pr -0.47 -0.85
t-Bu -1.54 -2.14
CCl3 -2.06 -3.05