Слайд 1Термодинамика и статистическая физика
Слайд 2 Лекция № 2
Первое начало термодинамики
1. Внутренняя энергия.
Макроскопическая
работа. Количество теплоты.
2. Первое начало термодинамики.
3. Условия
преобразования теплоты в работу.
4. Основные элементы тепловой машины. Цикл Карно. Максимальный КПД тепловых машин.
5. Теплоёмкость. Молярная теплоёмкость
идеального одноатомного газа при постоянном объёме и постоянном давлении.
6. Адиабатический процесс. Уравнение адиабаты.
Слайд 3 Внутренняя энергия
Наряду с механической энергией любое тело (или система) обладает внутренней
энергией. Внутренняя энергия – энергия покоя (без движения сосуда).
Она складывается из:
- теплового хаотического движения молекул,
- потенциальной энергии их взаимодей-
ствия (для реального газа),
- кинетической и потенциальной энергии электронов в атомах, нуклонов в ядрах и так далее.
Слайд 4 В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой
энергии недостаточно, чтобы изменить строение атома, а тем более ядра).
Следовательно, фактически под внутренней энергией в термодинамике подразумевают энергию теплового хаотического движения молекул.
В термодинамике важно знать не абсолютное значение внутренней энергии,
а её изменение.
Слайд 5
Внутренняя энергия U одного моля идеального одноатомного газа
равна:
или
Таким образом, внутренняя энергия зави-сит только от температуры.
Внутренняя энергия U является функ-цией состояния системы и
не зависит от предыстории:
Слайд 6 В каждом состоянии система обладает определенным и
только таким значением внутренней энергии, поэтому можно записать:
Так как U
– функция состояния, то
Этот справедливо для любой функции состояния.
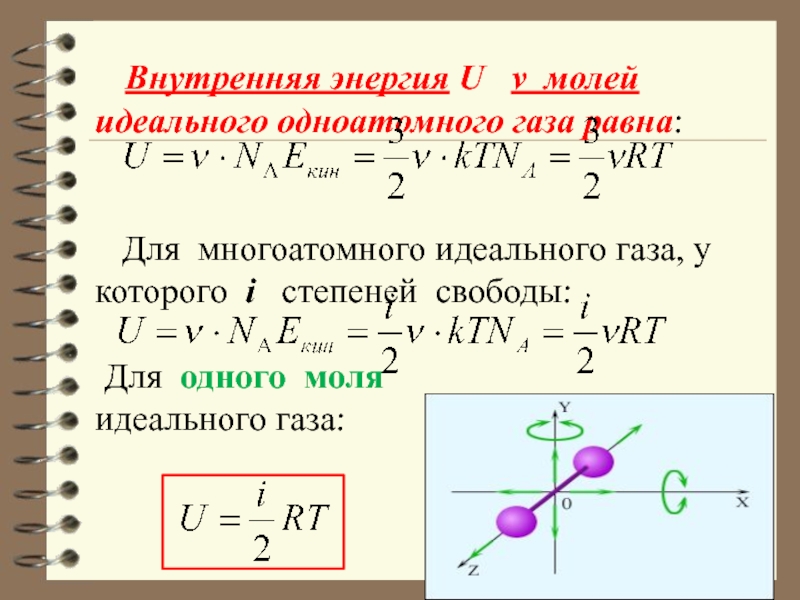
Слайд 7 Внутренняя энергия U ν молей идеального одноатомного
газа равна:
Для многоатомного идеального газа, у которого i степеней свободы:
Для одного моля
идеального газа:
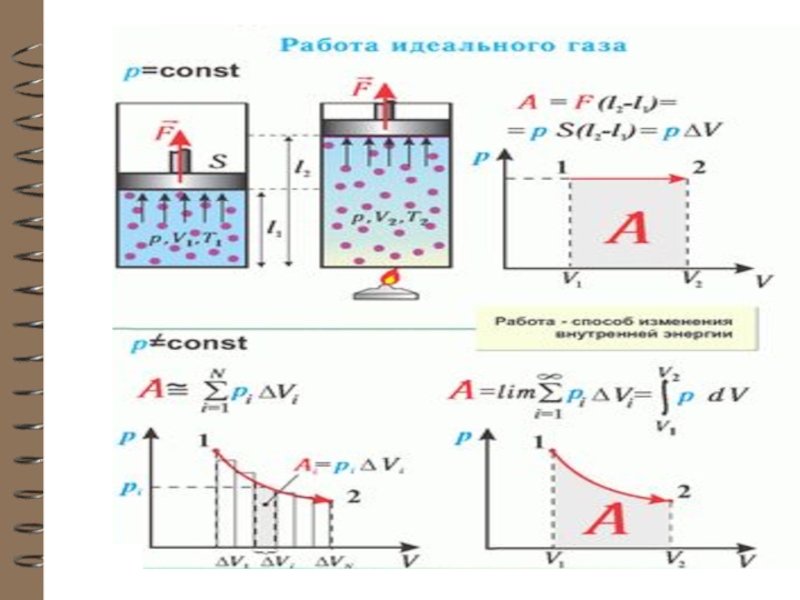
Слайд 10 Работа и теплота
Термодинамическая система может обладать как внутренней, так и механичес-кой
энергией и разные системы могут обмениваться этими видами энергии.
Обмен механической энергией характеризуется совершённой работой А, а обмен внутренней энергией – количеством переданного тепла Q.
Механическая энергия может перехо-дить в тепловую энергию и обратно.
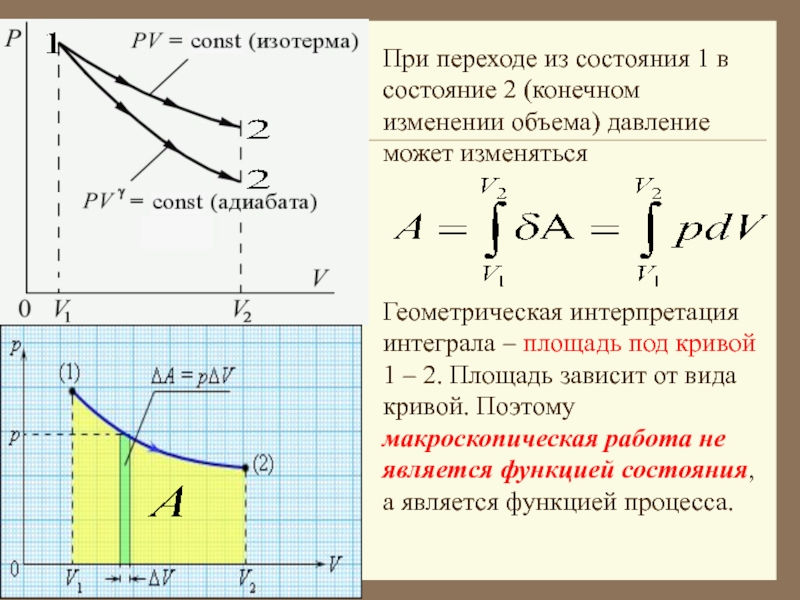
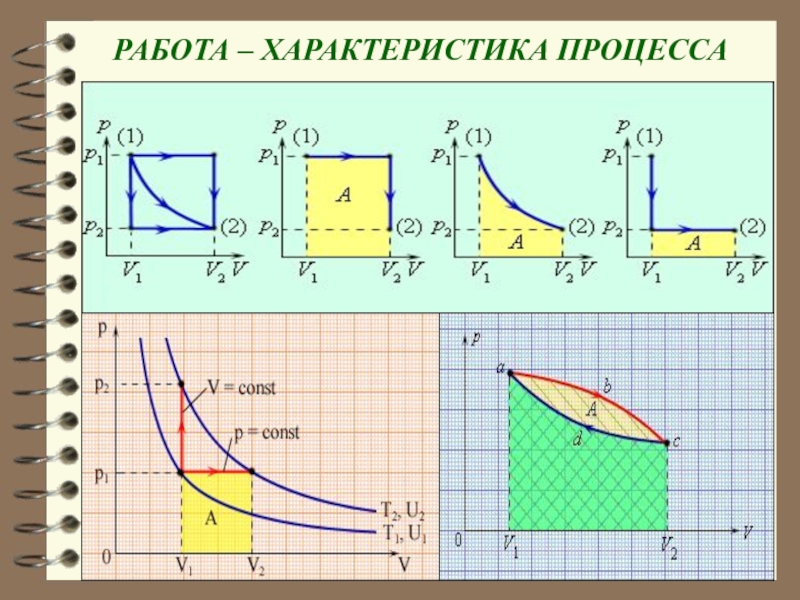
Слайд 13При переходе из состояния 1 в состояние 2 (конечном изменении
объема) давление может изменяться
Геометрическая интерпретация интеграла – площадь под
кривой 1 – 2. Площадь зависит от вида кривой. Поэтому макроскопическая работа не является функцией состояния, а является функцией процесса.
Слайд 15 РАБОТА – ХАРАКТЕРИСТИКА ПРОЦЕССА
Слайд 16 Количество теплоты Q , представляет собой энергию, которая
передаётся от одного тела к другому при их контакте (непосредственно
или через 3-е тело) или
путём излучения. Количество тепла (теп-лота) – мера изменения внутренней энергии системы в процессе теплопередачи: тепло-проводность, тепловое
излучение, конвекция
(перенос теплоты, обус-
ловленный различием
температур в разных ме-
стах жидкости или газа).
Слайд 18 Первое начало термодинамики
(закон сохранения энергии при тепловых
процессах)
Количество теплоты, сообщаемой телу, идёт на увеличение внутренней энергии и
на совершение телом работы:
– это и есть первое начало термодинамики или закон сохранения энергии в термодинамике.
– изменение внутренней энергии тела равно разности сообщаемой телу теплоты и произведённой телом работы.
Слайд 19 Закон сохранения энергии для малого изменения состояния системы будет иметь
вид:
U – функция состояния системы;
dU – её полный дифференциал, а
δQ и δА таковыми не являются и их
приращения не являются полными
дифференциалами.
Слайд 20 Теплота Q и работа А зависят от того, каким образом
совершен переход из состояния 1 в состояние 2 (изохорически, адиабатически),
а внутренняя энергия U не зависит.
При этом нельзя сказать, что система, обладает определенным для данного состояния значением теплоты и работы.
Количество теплоты Q выражается в тех же единицах, что работа и энергия, т.е. в джоулях [Q] = Дж.
Слайд 21 Теплотой называется энергия, передаваемая от
тела с более высокой
температурой телу с мень-
шей температурой при контакте (или путём из-
лучения).
Такая передача энергии не сопровож-
дается совершением работы, а приводит только
к увеличению внутренней энергии. Но если тепло
передаётся телу, которое при этом может расши-
ряться, то оно может совершать работу (I нач.ТД):
Наибольшая работа совершается при изотер-мическом процессе, когда внутренняя энергия не изменяется ( ), тогда:
Слайд 22 Если идеальный газ, получив теплоту, изотермически расширится от объёма
V1 до объёма V2 , то при этом будет совершена
работа равная:
то согласно первому началу термодинамики
т.е.
нельзя построить периодически действующий двигатель, который совершал бы бóльшую работу, чем количество сообщенной ему извне энергии. Иными словами, вечный двигатель первого рода невозможен.
Это одна из формулировок первого начала термодинамики.
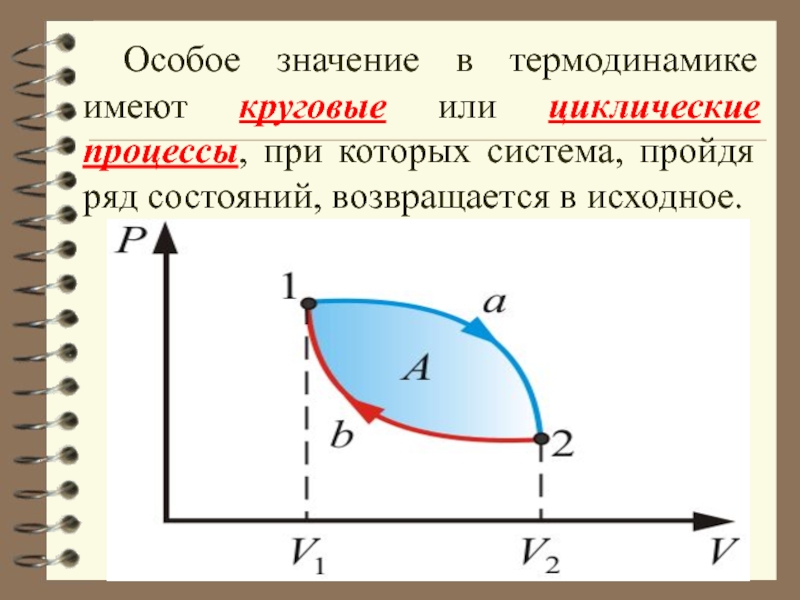
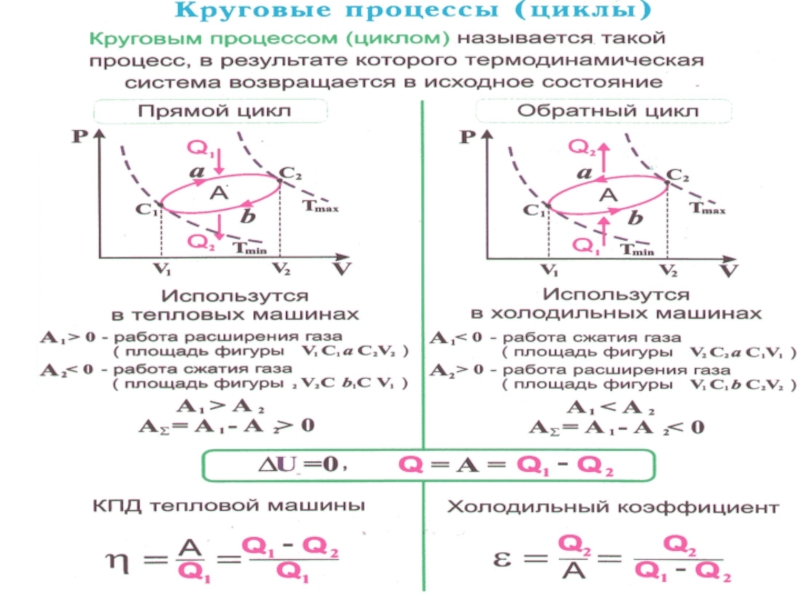
Слайд 24 Особое значение в термодинамике имеют круговые или циклические процессы, при
которых система, пройдя ряд состояний, возвращается в исходное.
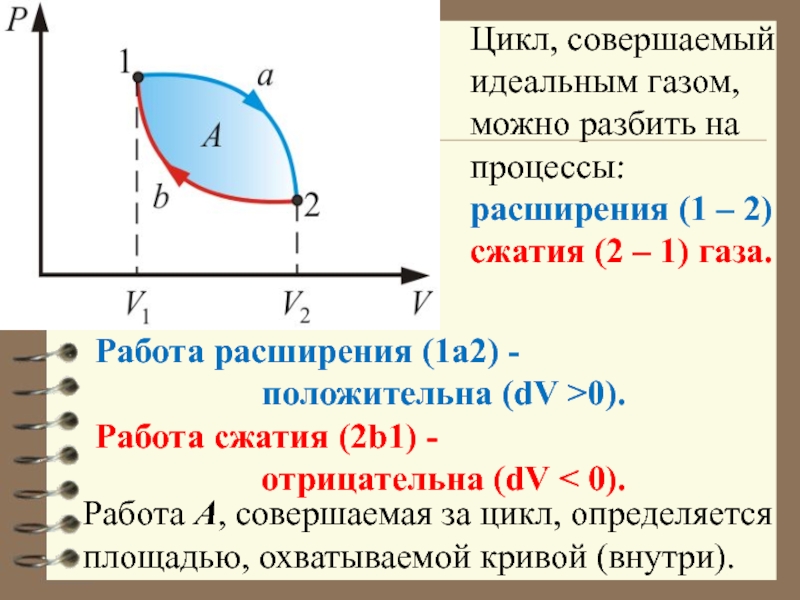
Слайд 25Цикл, совершаемый идеальным газом, можно разбить на процессы:
расширения (1
– 2)
сжатия (2 – 1) газа.
Работа расширения (1a2)
-
положительна (dV >0).
Работа сжатия (2b1) -
отрицательна (dV < 0).
Работа А, совершаемая за цикл, определяется площадью, охватываемой кривой (внутри).
Слайд 26 Если за цикл совершается положительная работа
(цикл протекает по часовой стрелке), то он называется прямым.
Если за цикл совершается отрицательная работа
(цикл протекает против часовой стрелки), то он называется обратным.
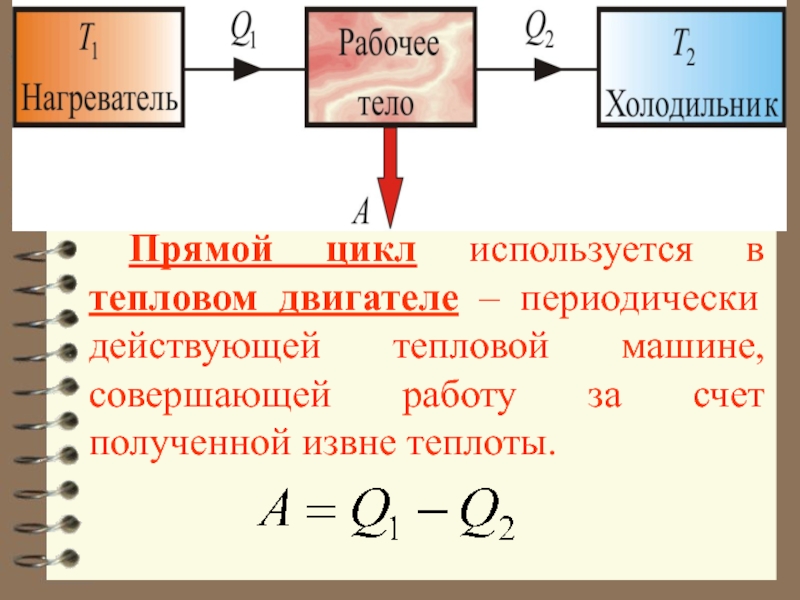
Слайд 28 Прямой цикл используется в тепловых двигателях –
периодически действующих установках, совершающих работу за счет получения извне теплоты.
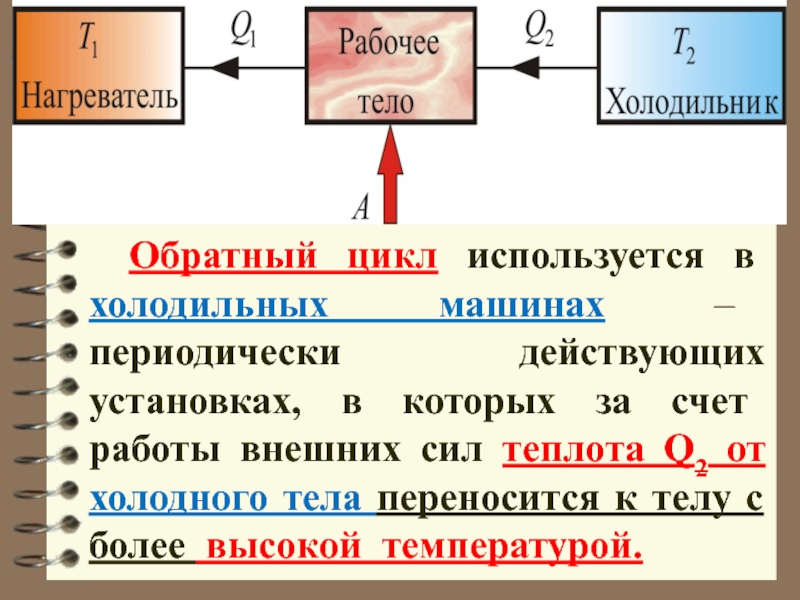
Обратный цикл используется в холодильных машинах периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю ( ). Поэтому первое начало термодинамики для кругового процесса:
т.е. работа, совершаемая за цикл, равна количеству полученной извне теплоты.
Слайд 29 Т.о. работа, совершаемая за цикл, равна количеству полученной извне
теплоты.
Однако в результате кругового процесса система
может теплоту как получать, так и отдавать, поэтому
Q1 – количество теплоты, полученное системой;
Q2 – количество теплоты, отданное системой.
Слайд 30 Термический коэффициент полезного действия ( КПД ) для кругового
процесса:
Все термодинамические процессы, в том числе и круговые, делят на две группы: обратимые и необратимые.
Слайд 31 Термический процесс называется обратимым, если он может
происходить как в прямом, так и в обратном направлении. Причем,
если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений.
Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Любой равновесный процесс является обратимым.
Обратимость равновесного процесса, происхо-
дящего в системе, следует из того, что ее любое
промежуточное состояние есть состояние термоди-
намического равновесия; для него "безразлично",
идет процесс в прямом или обратном направлении.
Слайд 32 Реальные процессы сопровождаются диссипацией
энергии (из-за трения, теплопроводности и т.д.)
и
являются необратимыми.
Обратимые процессы - это идеализация реальных
процессов.
Их рассмотрение важно
по двум причинам:
многие процессы в природе и технике практически обратимы;
обратимые процессы являются наиболее экономичными;
Они имеют максимальный термический коэффи-
циент полезного действия, что позволяет указать
пути повышения КПД реальных тепловых
двигателей.
Слайд 33 При адиабатическом расширении газа условие теплоизолированности системы исключает непосредственный теплообмен
между системой и средой. Поэтому, производя адиабатическое расширение газа, а
затем сжатие, можно вернуть газ в исходное состояние так, что в окружающей среде никаких изменений не произойдет. Это и будет обратимый процесс.
Слайд 34 Тепловые машины
Тепловой
машиной называется периодический действующий двига-тель, совершающий работу за счет получаемого
извне тепла. При этом теплота, взятая у источника, может быть превращена в работу в цикличес- ком процессе при условии, что кроме этого должно изменяться состояние какого-то другого тела или тел.
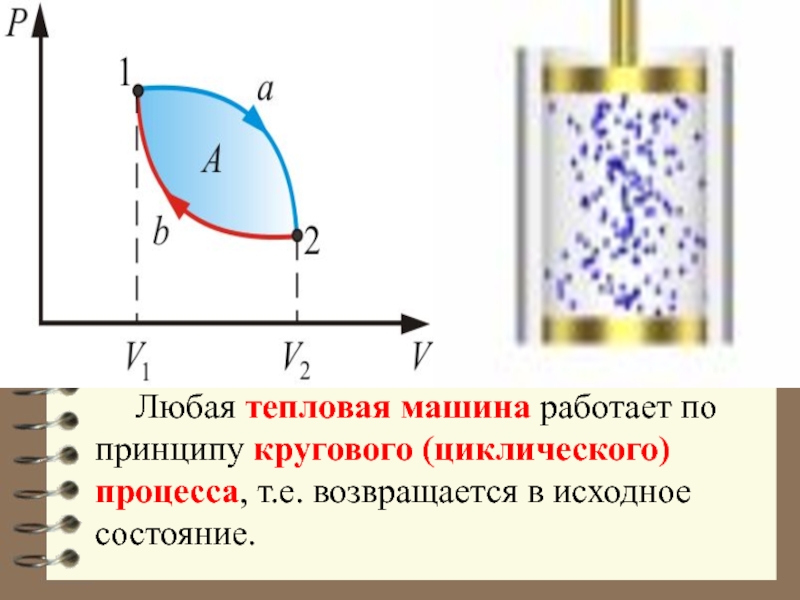
Слайд 35 Любая тепловая машина работает по принципу кругового (циклического) процесса, т.е.
возвращается в исходное состояние.
Слайд 36 Но чтобы при этом была совершена полезная работа,
возврат должен быть произведен с наименьшими затратами.
Полезная работа
равна разности работ расширения и сжатия, т.е. равна площади, ограниченной замкнутой кривой.
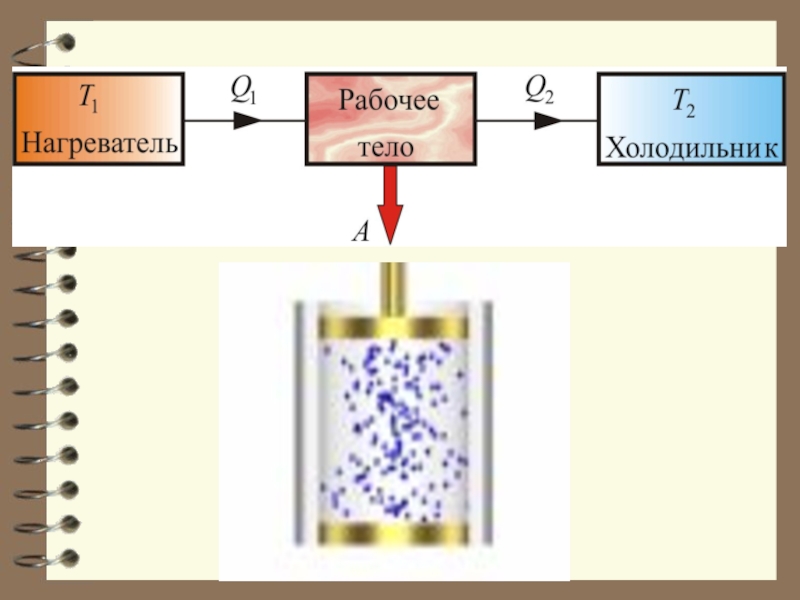
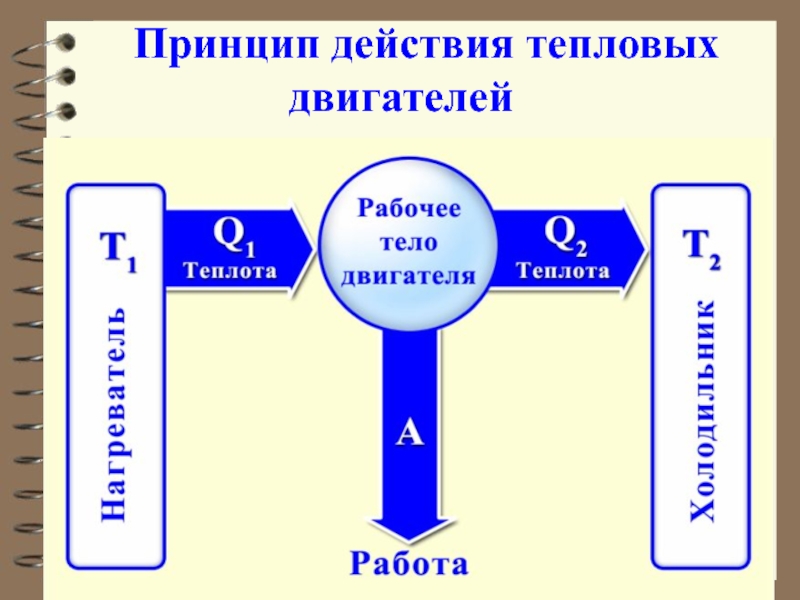
Обязательными частями тепловой машины являются: нагреватель (источник энергии), холодильник и рабочее тело (газ, пар).
Слайд 38 Принцип действия тепловых
двигателей
Слайд 39 Зачем холодильник? Так как в тепловой машине
реализуется круговой процесс, то вернуться в исходное состояние можно с
меньшими затратами, если отдать часть тепла.
Если охладить пар, то его легче сжать, следовательно, работа сжатия будет меньше работы расширения. Поэтому в тепловых машинах используется холодильник.
Слайд 40 Прямой цикл используется в тепловом двигателе – периодически действующей тепловой
машине, совершающей работу за счет полученной извне теплоты.
Слайд 41 От термостата с более высокой температурой Т1, называемого нагревателем, за
цикл отнимается количество теплоты Q1, а термостату с более низкой
температурой Т2, называемому холодильником, за цикл передается количество теплоты Q2 и совершается работа A:
Слайд 47 Обратный цикл используется в холодильных машинах – периодически действующих установках,
в которых за счет работы внешних сил теплота Q2 от
холодного тела переносится к телу с более высокой температурой.
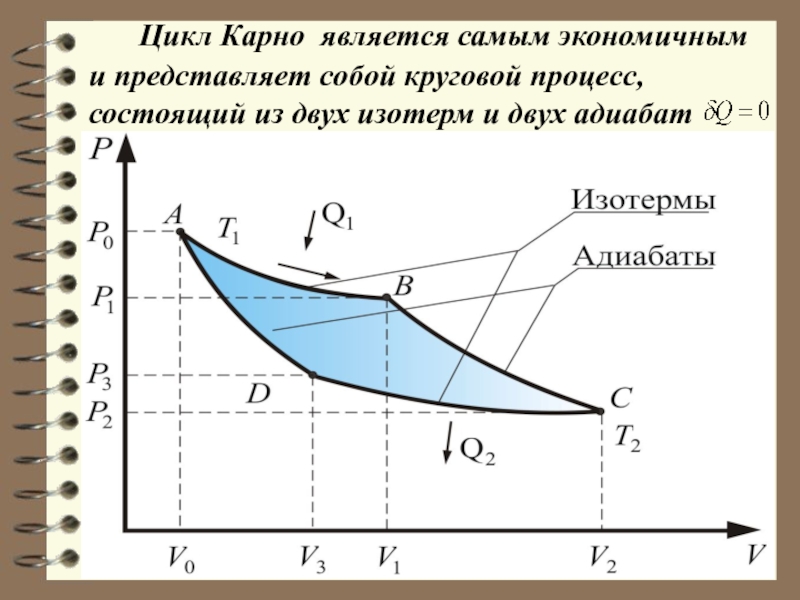
Слайд 50 Цикл Карно (обратимый).
Карно теоретически про-анализировал обратимый
наиболее экономичный цикл, состоящий из двух изотерм и двух адиабат.
Его называют циклом Карно.
Прямой цикл Карно в качестве рабочего тела использует идеальный газ, заключенный в сосуд с подвижным поршнем.
Карно Никола Леонард Сади
(1796 – 1832) – французский физик
и инженер, один из создателей
термодинамики. Впервые показал,
что работу можно получить в
случае, когда тепло переходит от нагретого тела к более холодному. Ввел понятие кругового и обратимого процессов, идеального цикла тепловых машин, заложил тем самым основы их теории. Пришел к понятию механического эквивалента теплоты. В 1824 г. опубликовал сочинение «Размышления о движущей силе огня и
о машинах способных развить эту силу».
Слайд 52 Цикл Карно является самым экономичным и представляет
собой круговой процесс, состоящий из двух изотерм и двух адиабат
Слайд 54 ТЕОРЕМА КАРНО
Из всех
периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей и холодильников,
наибольшим КПД обладают обратимые машины.
Причем КПД обратимых машин, работающих по циклу Карно, равны друг другу и не зависят от конструкции машины и от природы рабочего вещества.
При этом КПД меньше единицы.
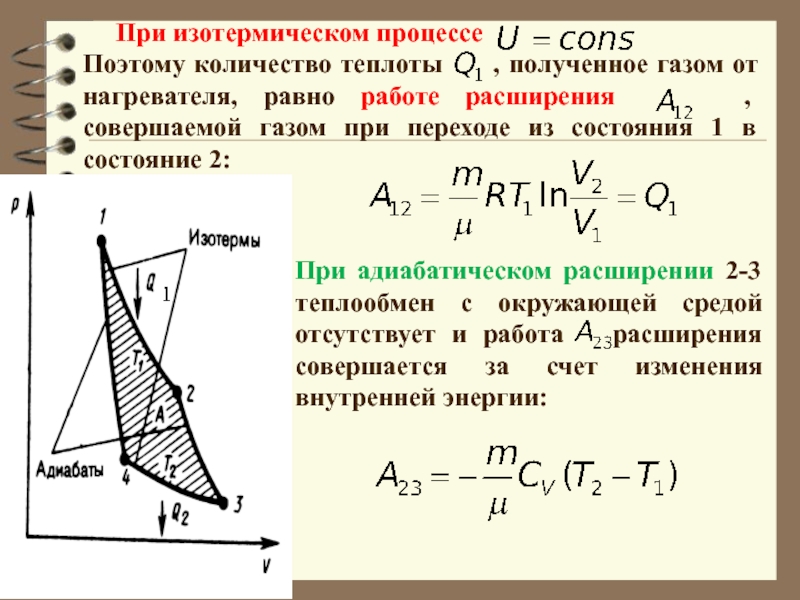
Слайд 55Поэтому количество теплоты , полученное газом от нагревателя,
равно работе расширения , совершаемой газом при переходе
из состояния 1 в состояние 2:
При изотермическом процессе
При адиабатическом расширении 2-3 теплообмен с окружающей средой отсутствует и работа расширения совершается за счет изменения внутренней энергии:
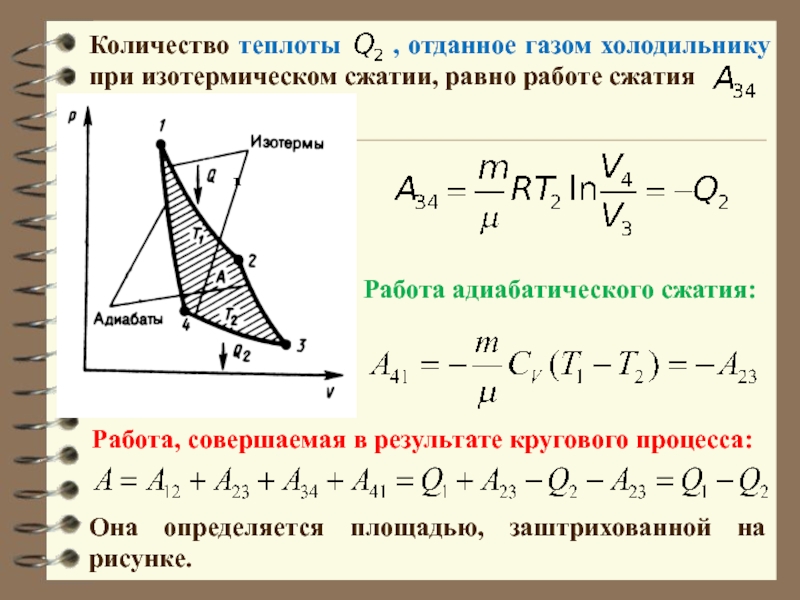
Слайд 56Количество теплоты , отданное газом холодильнику при изотермическом
сжатии, равно работе сжатия
Она определяется площадью, заштрихованной на рисунке.
Работа,
совершаемая в результате кругового процесса:
Работа адиабатического сжатия:
Слайд 57 Применив уравнение для адиабат 2-3 и 4-1, получим:
и , откуда
Термический КПД цикла Карно:
Слайд 58 Видно, что η < 1 и зависит
от разности температур между нагревателем и
холодильником (и не зависит от конструкции машины и рода рабочего тела). Это ещё одна формулировка теоремы Карно.
Цикл Карно, рассмотренный нами, был на всех стадиях проведен так, что не было необратимых процессов, (не было соприкосновения тел с разными температурами). Поэтому здесь самый большой КПД. Больше получить в принципе невозможно.
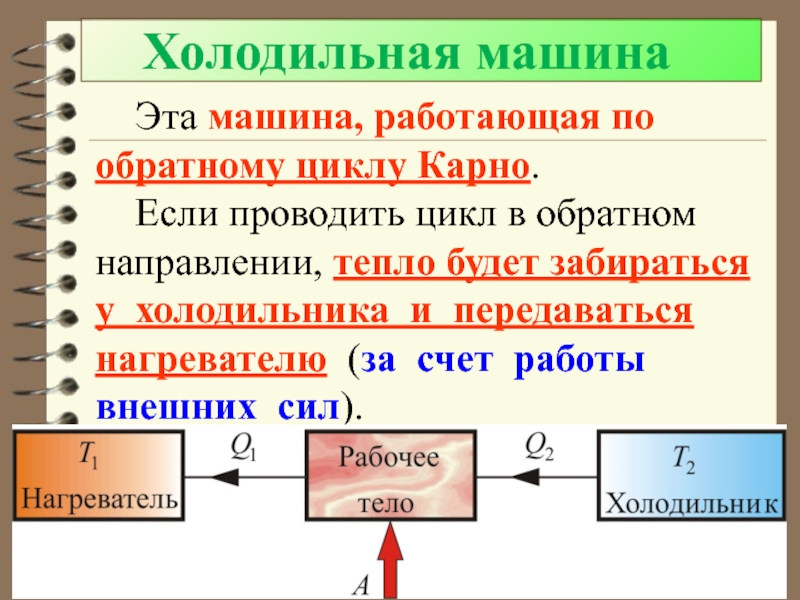
Слайд 60 Холодильная машина
Эта машина, работающая по обратному циклу
Карно.
Если проводить цикл в обратном направлении, тепло будет забираться у
холодильника и передаваться нагревателю (за счет работы внешних сил).
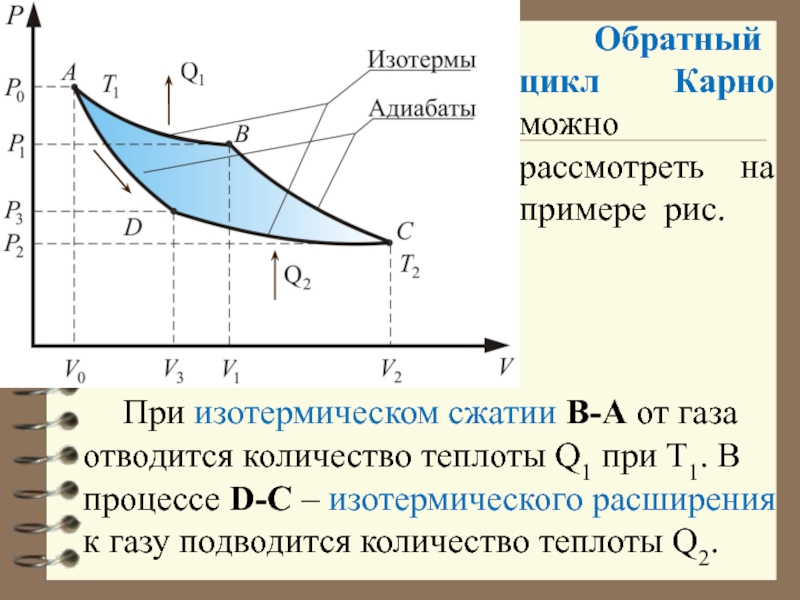
Слайд 61 Обратный цикл Карно можно рассмотреть на примере рис.
При изотермическом сжатии В-А от газа отводится количество теплоты
Q1 при Т1. В процессе D-С – изотермического расширения к газу подводится количество теплоты Q2.
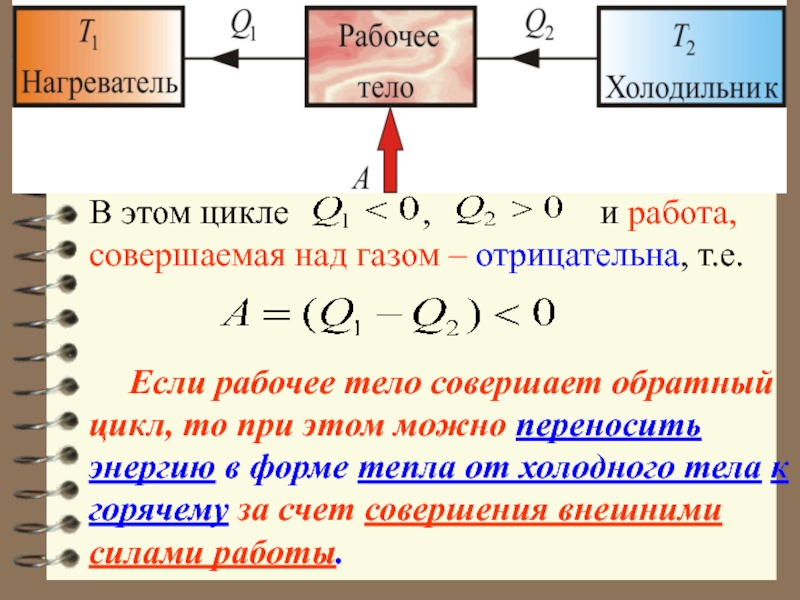
,
и работа, совершаемая над газом – отрицательна, т.е.
Если рабочее тело совершает обратный цикл, то при этом можно переносить энергию в форме тепла от холодного тела к горячему за счет совершения внешними силами работы.
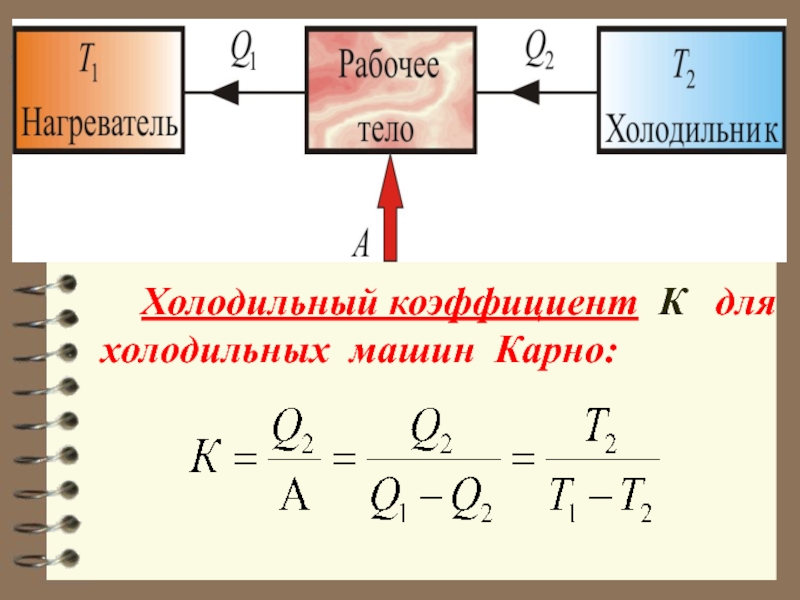
Слайд 63 Холодильный коэффициент К для холодильных машин Карно:
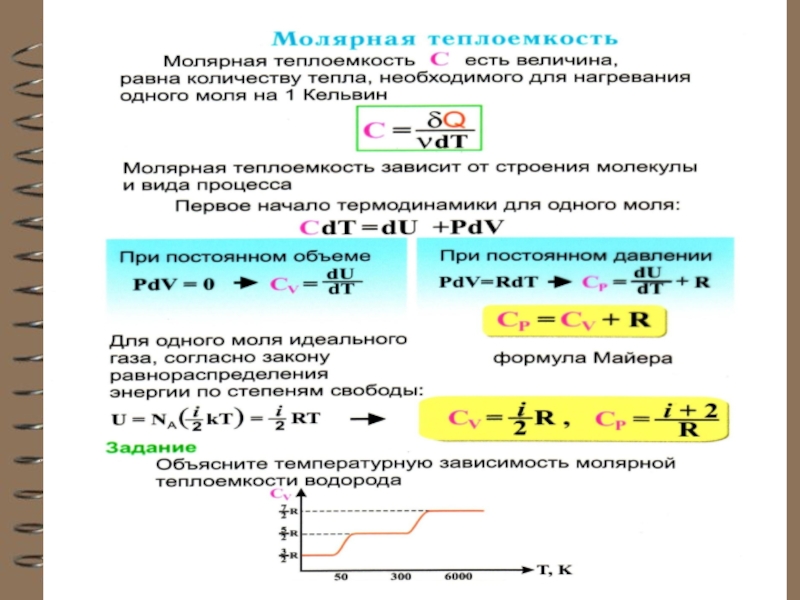
Слайд 64 Теплоёмкость идеального газа
Теплоёмкость тела характеризуется
количеством теплоты, необходимой для нагревания этого тела на один градус
Размерность теплоемкости: [C] = Дж/К.
Теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости.
Слайд 65 Удельная теплоёмкость Суд – есть количество теплоты, необходимое для
нагревания единицы массы вещества на
1 градус
[Cуд] = Дж/(кг∙К).
Для газов удобно пользоваться молярной теплоемкостью Сμ количество теплоты, необходимое для нагревания
1 моля газа на 1 градус
[Cμ] = Дж/(мольК).
Слайд 66 Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы
при нагревании.
Если газ нагревать при постоянном объёме, то всё подводимое
тепло идёт на нагревание
газа, то есть изменение его
внутренней энергии.
Теплоёмкость при
постоянном объёме СV
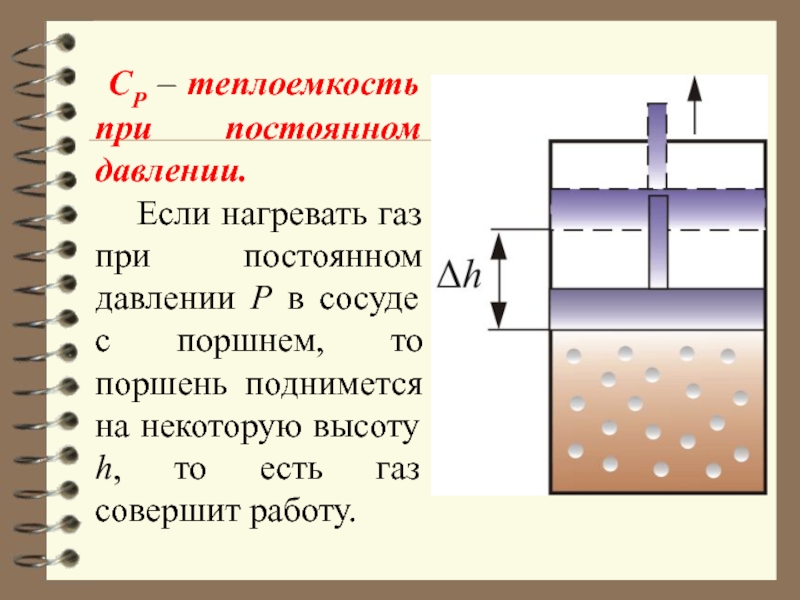
Слайд 67 СР – теплоемкость при постоянном давлении.
Если нагревать
газ при постоянном давлении Р в сосуде с поршнем, то
поршень поднимется на некоторую высоту h, то есть газ совершит работу.
Слайд 68 Следовательно, проводимое тепло затрачивается и на нагревание и на совершение
работы. Отсюда ясно, что
Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляет-ся передача тепла.
Следовательно Q и С не являются функциями состояния. Величины СР и СV оказываются связанными простыми соотношениями. Найдём их.
Слайд 69
При изобарическом процессе кроме увеличения внутренней энергии
происходит совершение работы газом (из I начала ТД):
(для 1 моля)
Из основного уравнения молекулярно-кинетической теории для 1моля:
При изобарическом процессе Р = const.
Тогда получим:
Слайд 70Это уравнение Роберта Майера для одного моля газа. Из него
следует, что физический смысл универсальной газовой постоянной в том, что
R – численно равна работе, совершаемой одним молем газа при нагревании на один градус при изобаричес-ком процессе.
Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж.
Для ν молей:
Слайд 71 В общем случае
так как внутренняя энергия U
может зависеть только от температуры.
В
случае 1 моля идеального газа спра-ведлива формула изм. внутренней энергии:
Из этого следует, что для 1 моля:
Слайд 72 Внутренняя энергия идеального газа является только функцией температуры (и не
зависит от V, Р и тому подобных величин), поэтому формула
справедлива для любого процесса ( для 1 моля).
Для произвольной массы идеального газа:
Слайд 73 Внутренняя энергия одного моля идеального одноатомного газа равна:
- молярная теплоемкость при постоянном объеме СV – величина постоянная, от температуры не зависит.
Слайд 74 Внутренняя энергия одного моля идеального газа c i степенями свободы
равна:
молярная теплоемкость при постоянном объеме СV – величина постоянная, от температуры не зависит.
Слайд 75 Учитывая физический смысл R для изобарических процессов
можно записать:
(для одного моля). Отсюда для одноатомного:
Тогда,
молярная теплоемкость при постоянном давлении для одноатомных газов:
Слайд 76
Для одного моля идеального
газа:
Постоянная адиабаты (коэффициент Пуассона) для идеального
газа:
Для одноатомного идеаль-
ного газа (i = 3):
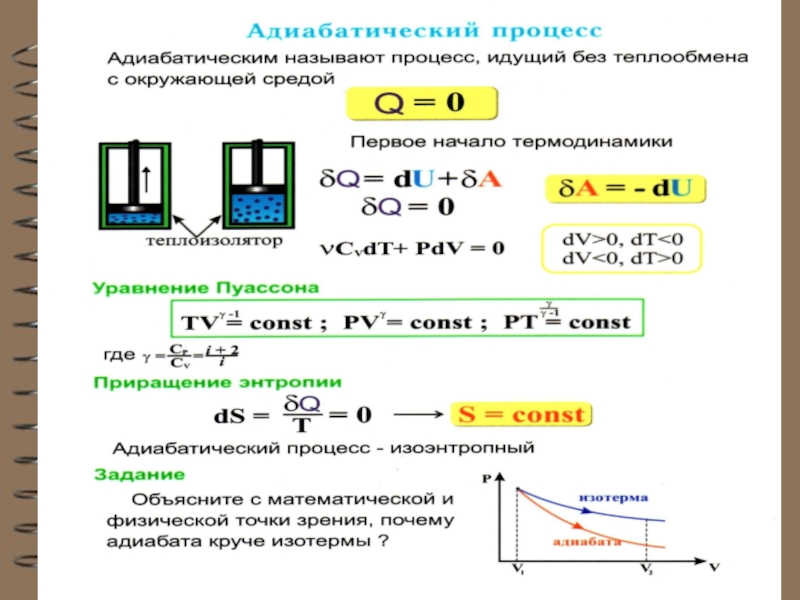
Слайд 78 Адиабатный (адиабатический) процесс
Это процесс, происходящий без теплообмена с окружающей
средой, т.е.
При адиабатном процессе работа
системы (или над системой) совершается за счет изме-нения внутренней энергии газа:
(из I начала ТД: при ).
Вывод уравнения адиабаты.
и A = PdV :
Для 1 моля идеального газа:
Слайд 79 Подставляя dT в уравнение:
Группируя PdV:
Делим на
где
Т.к. γ = const ( для одноатомного газа γ = 5/3 ), то
Слайд 80уравнение Пуассона или уравнение адиабаты для идеального газа
Или в переменных Т и V уравнение адиабаты
для идеального газа:
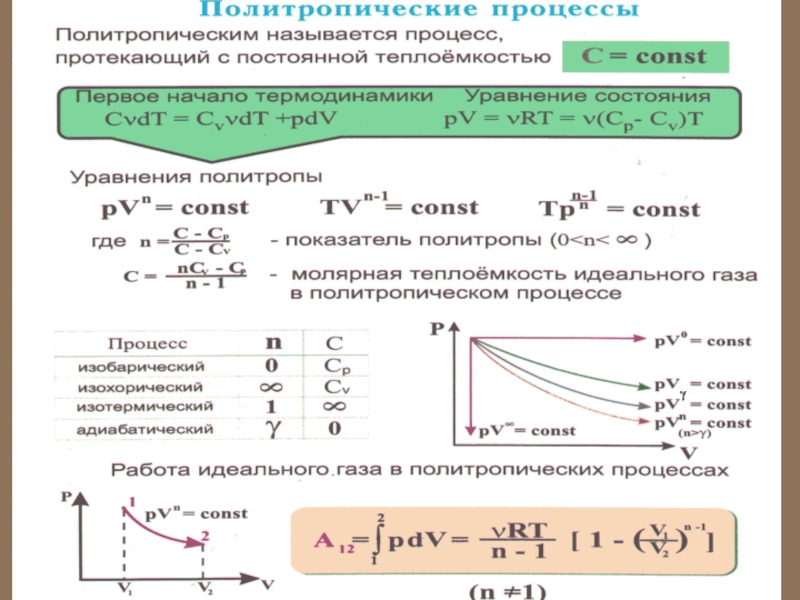
Слайд 82 Здесь уместно рассмотреть еще и политропный процесс – такой процесс,
при котором изменяются все основные параметры системы, кроме теплоемкости, т.е.
С = const.
Уравнение политропы
или
Здесь n – показатель
политропы:
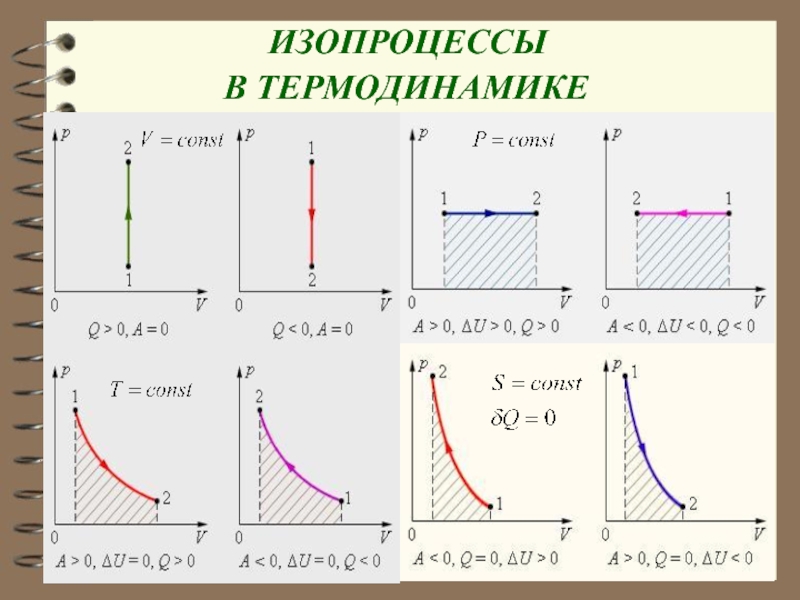
Слайд 83 С помощью показателя n можно легко описать любой
изопроцесс:
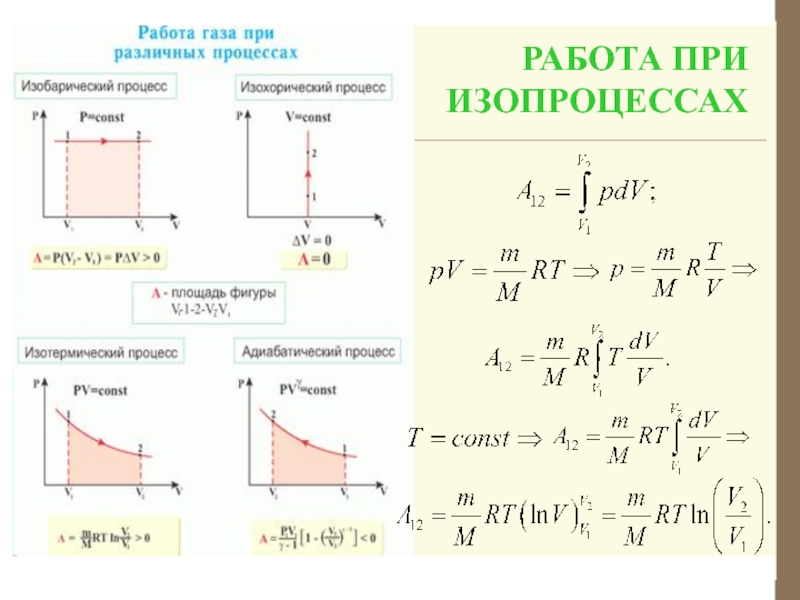
1. Изобарный процесс Р = const, n = 0
2. Изотермический процесс Т = const, n = 1,
3. Изохорный процесс V = const,
Слайд 844. Адиабатический процесс Q = 0,
n
= γ, Сад = 0.
Во всех этих процессах работу можно
вычислить по одной формуле: