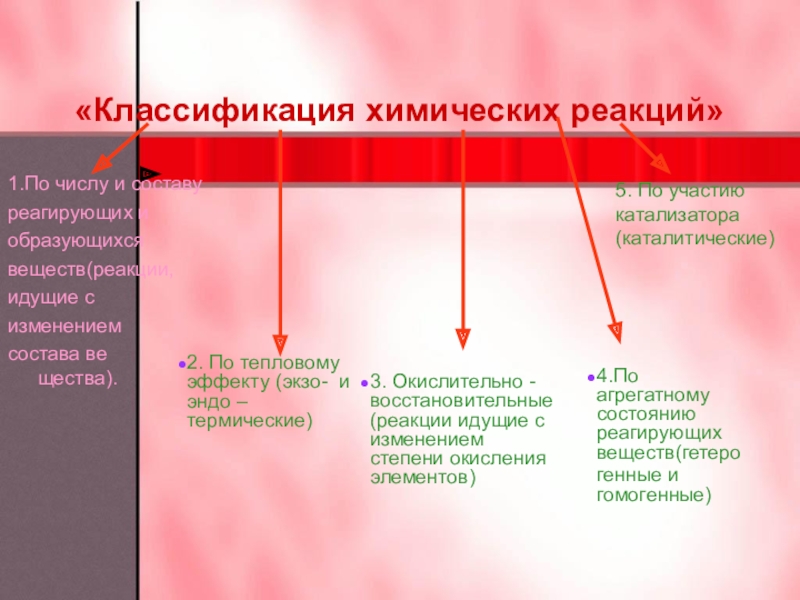
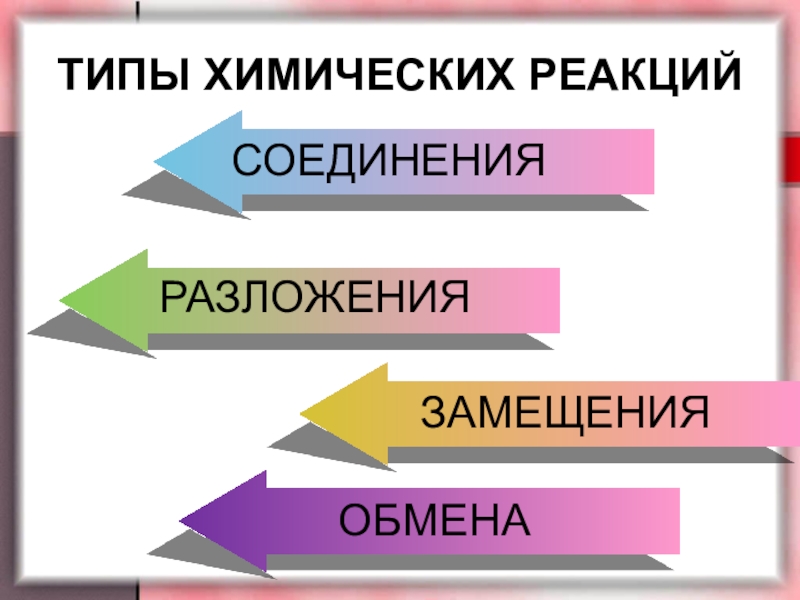
они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют
свои свойства и состав. Без химических реакций невозможна жизнь и все многообразие веществ. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.Сегодня мы продолжим знакомство с этим удивительным и волшебным миром.