Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Типы химических связей
Содержание
- 1. Типы химических связей
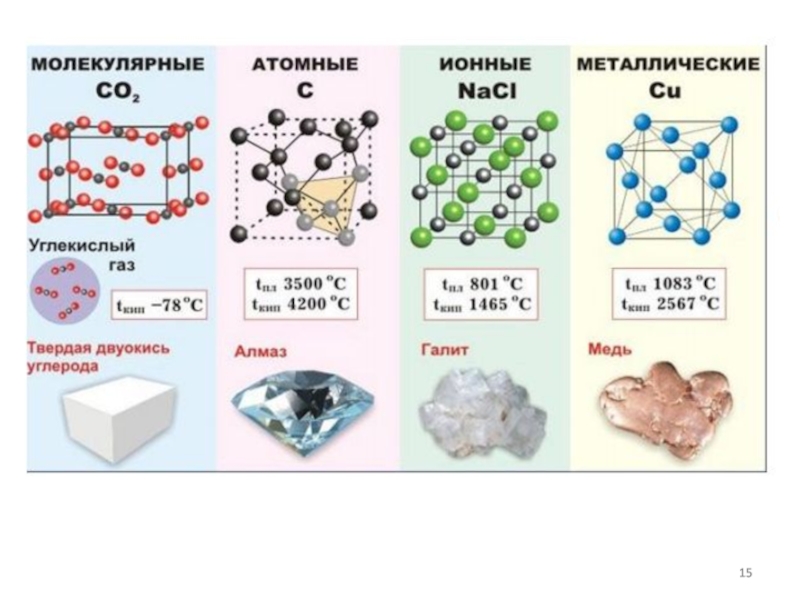
- 2. Типы связей в кристаллах-гетерополярные (ионные, ковалентные полярные)-гомополярные
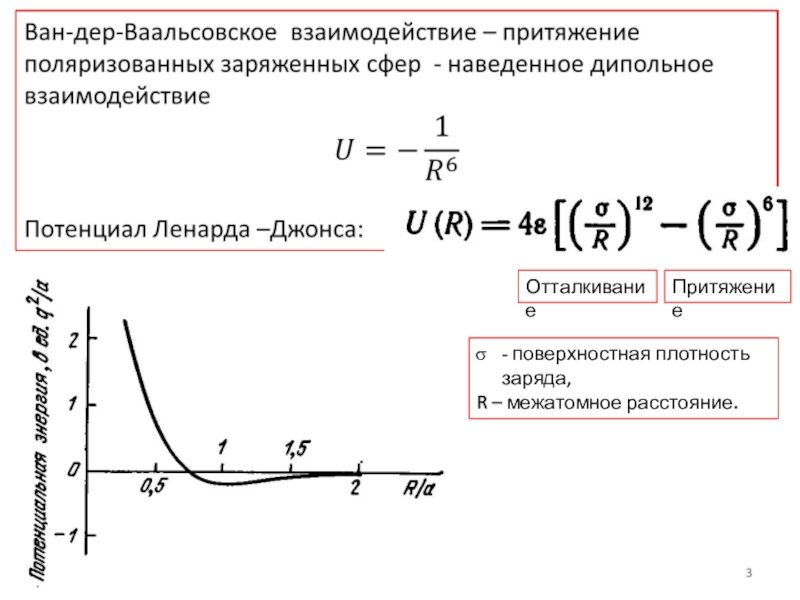
- 3. ОтталкиваниеПритяжение- поверхностная плотность заряда, R – межатомное расстояние.
- 4. Энергия решетки ионного кристаллаПрочность связей характеризуется энергией,
- 5. (химические соединения, молекула которых является диполем: вода, метиловый спирт, глицерин).
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Водородная связь – подвид ионнойАтом водорода отдает
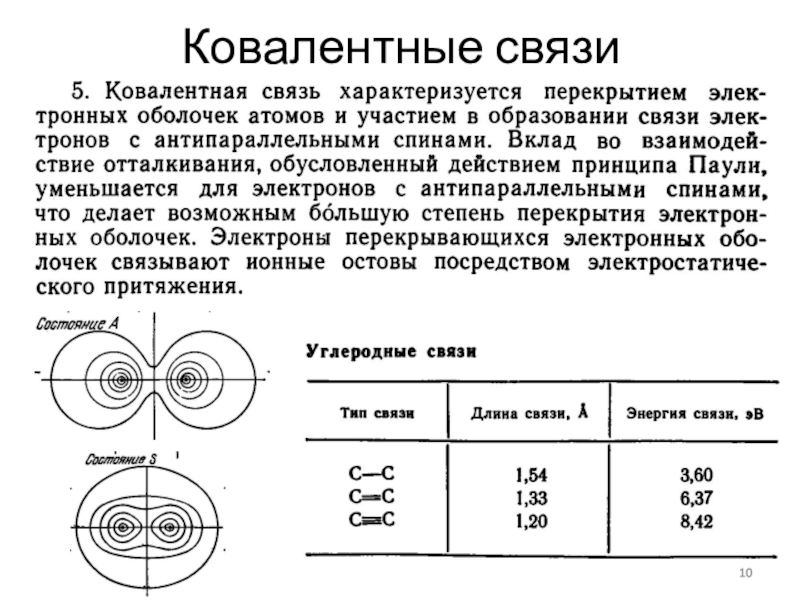
- 10. Ковалентные связи
- 11. Пи и сигма ковалентные связиКонцепция введена Полингом.
- 12. Гибридизация орбиталейКонцепция введена Лайнусом Полингом.Гибридизация орбиталей — гипотетический процесс смешения
- 13. Металлическая связьОбычно металлы формируют ОЦК, ГЦК или
- 14. Металлическая связь в соединенияхЭлектронные соединения (фазы Юм-Розери)Их
- 15. Слайд 15
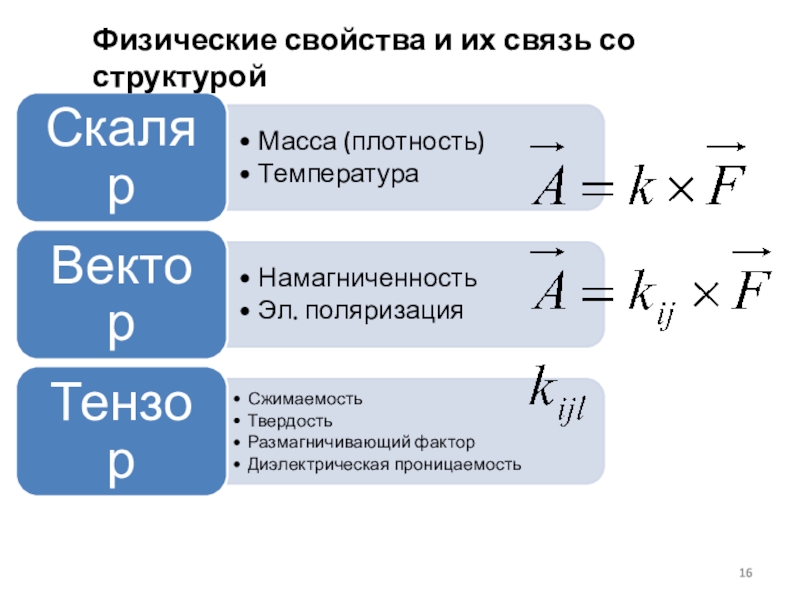
- 16. Физические свойства и их связь со структурой
- 17. Скалярные свойстваПлотность зависит от типа структуры, коэффициента
- 18. ТеплопроводностьФигуры плавления на гранях
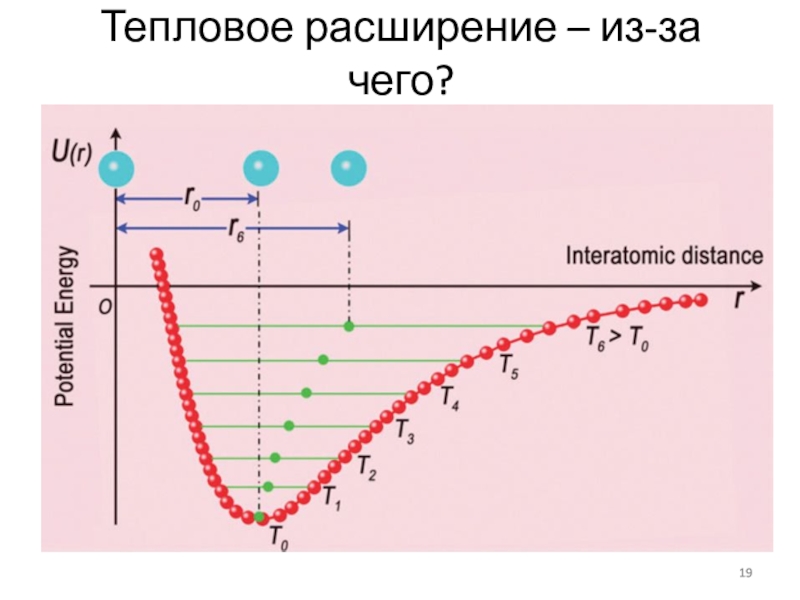
- 19. Тепловое расширение – из-за чего?
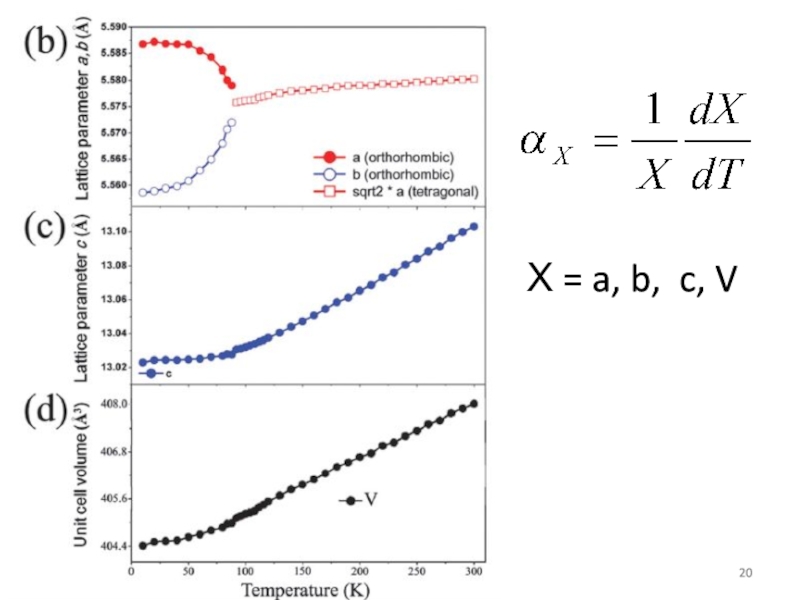
- 20. Х = a, b, c, V
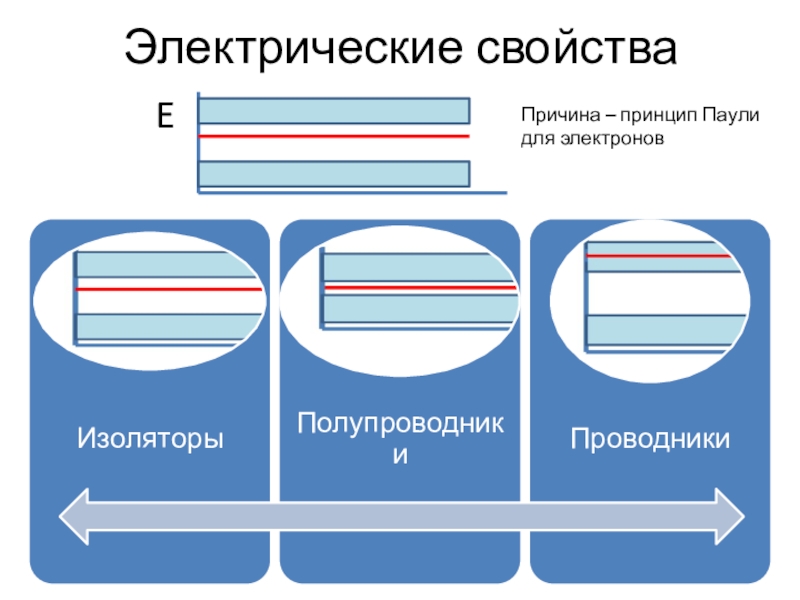
- 21. Электрические свойстваEПричина – принцип Паули для электронов
- 22. Полярными являются направления, противоположные концы которых не
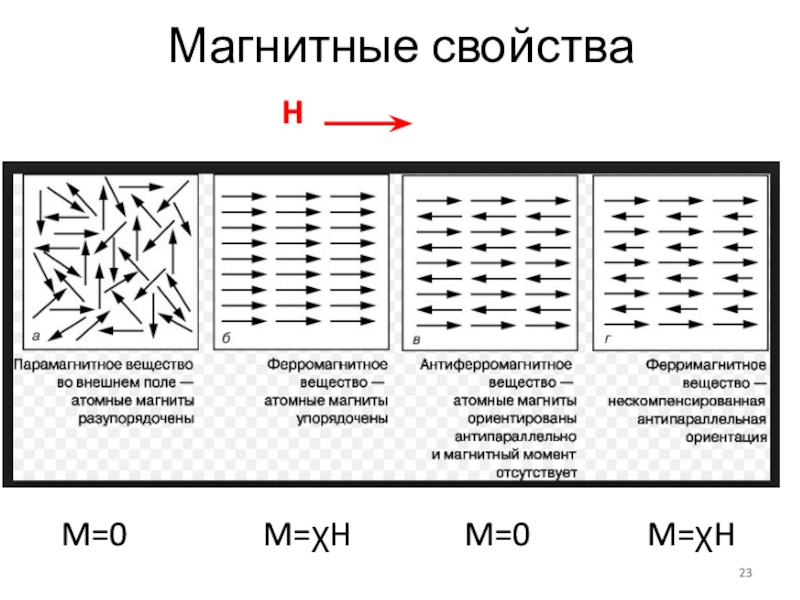
- 23. Магнитные свойстваHM=0M=HM=HM=0
- 24. Диамагнетики – молекулы со скомпенсированными магнитными моментами.
- 25. Механические свойстваТвердость – степень сопротивления внешнему механическому воздействию.
- 26. Слайд 26
- 27. Измерение (микро)твердости по Виккерсу (гостировано)Micromet-5103 -
- 28. СпайностьСпайность – свойство кристаллов колоться по плоскостям,
- 29. Деформация под действием силыДеформация сопровождается изменением величин
- 30. Причина: Атомы выходят за пределы связей
- 31. Скачать презентанцию
Слайды и текст этой презентации
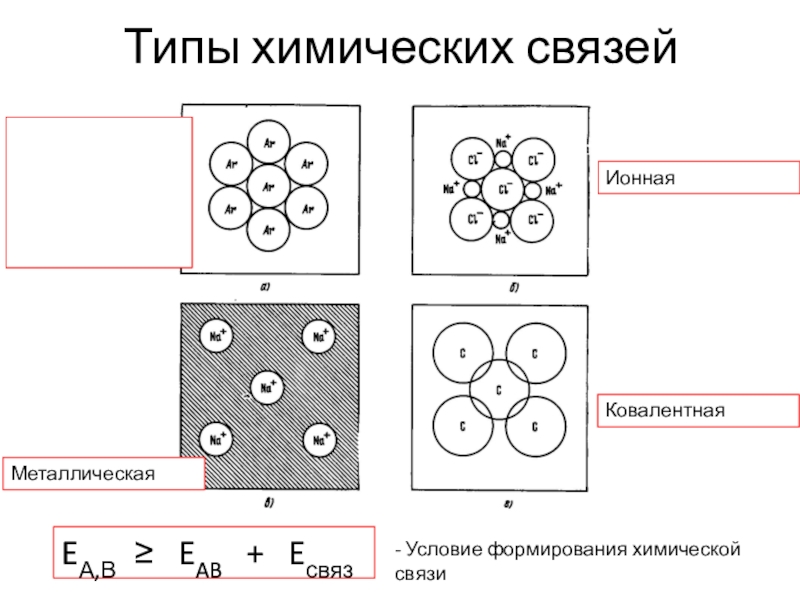
Слайд 2Типы связей в кристаллах
-гетерополярные (ионные, ковалентные полярные)
-гомополярные (ковалентные неполярные)
-металлические
-вандерваальсовские.
Идеальные плотнейшие
упаковки атомов возможны только в структурах минералов с ненаправленными, т.е.
полностью ионными или металлическими связями.Для минералов с ковалентными связями – связь формируется за счет обобществления электронов на орбиталях p, d, f (их форма не шаровая, со строго определенной ориентацией в пространстве направлений, по которому могут связаться соседние атомы).
Поэтому в минералах с ковалентной связью устойчивость структуры зависит от двух факторов:
а) соотношения размеров атомов;
б) характера расположения в пространстве валентных орбиталей
p, d, f- электронов (квантовая химия).
Если одновременно существует несколько типов связи - гетеродесмические структуры. Иначе – гомодесмические.
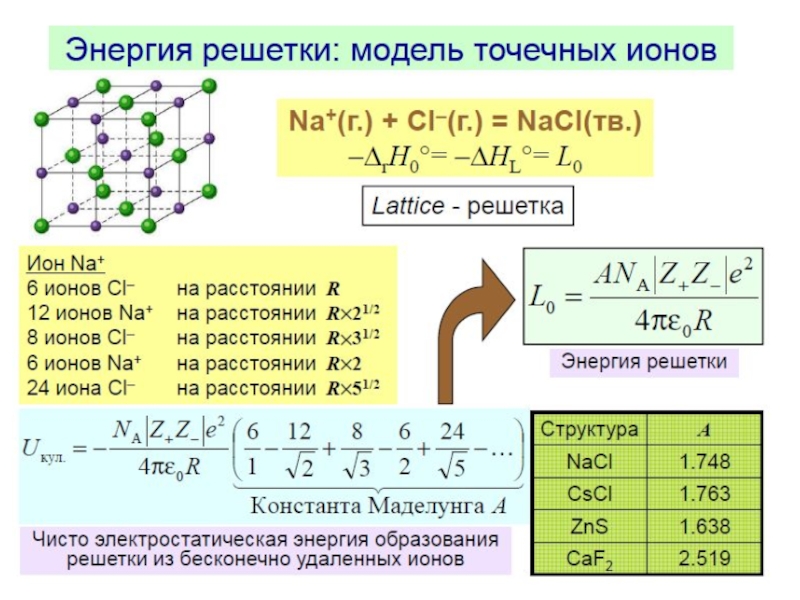
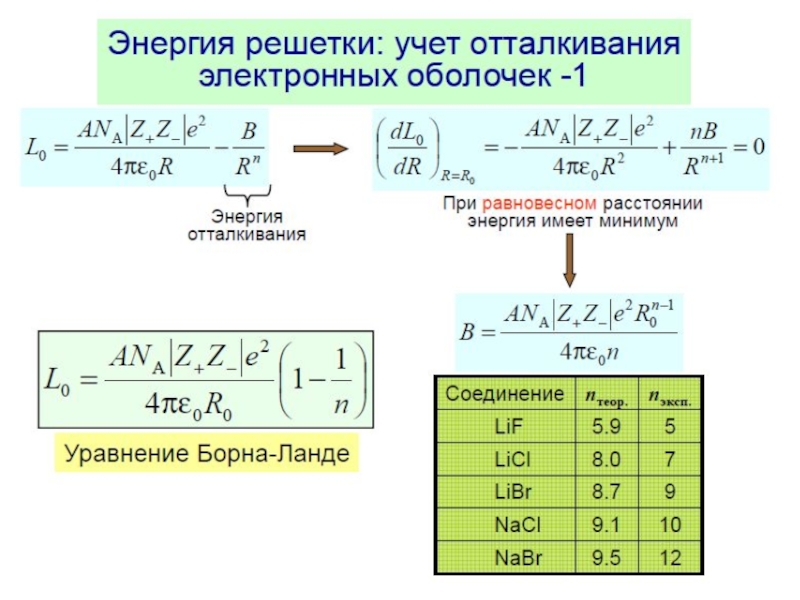
Слайд 4Энергия решетки ионного кристалла
Прочность связей характеризуется энергией, которую нужно затратить
для разъединения кристалла на составляющие его частицы (энергией решетки).
При
повышении температуры энергия решетки уменьшается из-за «разрыхления» под воздействием тепловых колебаний, при этом внутренняя энергия увеличивается.Энергия решетки определяет основные физические свойства кристаллов: температуру плавления, механическую прочность, твердость и т. д. Чем больше энергия решетки кристалла, тем более он устойчив (выше температура плавления).
Различия в энергиях решетки разных веществ сказываются и на их реакционной способности. Вещества с наименьшей энергией будут, как правило, более реакционно-способными.
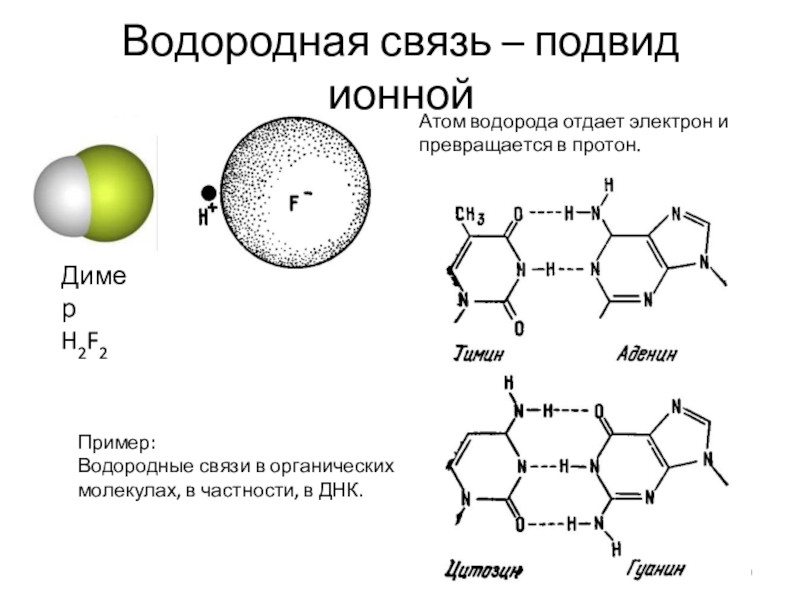
Слайд 9Водородная связь – подвид ионной
Атом водорода отдает электрон и превращается
в протон.
Пример:
Водородные связи в органических молекулах, в частности, в
ДНК.Димер
H2F2
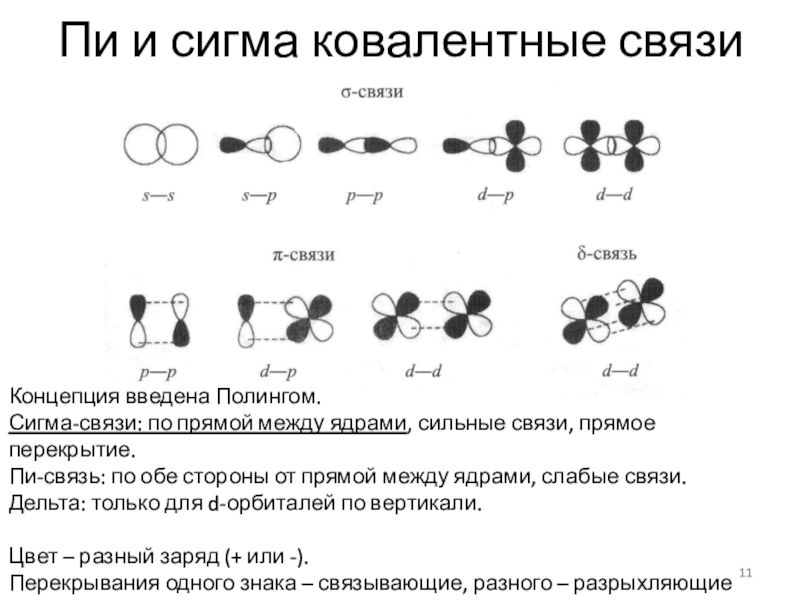
Слайд 11Пи и сигма ковалентные связи
Концепция введена Полингом.
Сигма-связи: по прямой
между ядрами, сильные связи, прямое перекрытие.
Пи-связь: по обе стороны от
прямой между ядрами, слабые связи.Дельта: только для d-орбиталей по вертикали.
Цвет – разный заряд (+ или -).
Перекрывания одного знака – связывающие, разного – разрыхляющие связи.
Слайд 12Гибридизация орбиталей
Концепция введена Лайнусом Полингом.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p,
d, f) орбиталей многоатомной молекулы с возникновением орбиталей, эквивалентных по
своим характеристикам.Два правила теории отталкивания электронных пар Гиллеспи — Найхолма:
1. Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга (отталкивание).
2. Все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра (эквивалентными по энергии).
sp
sp2
sp3
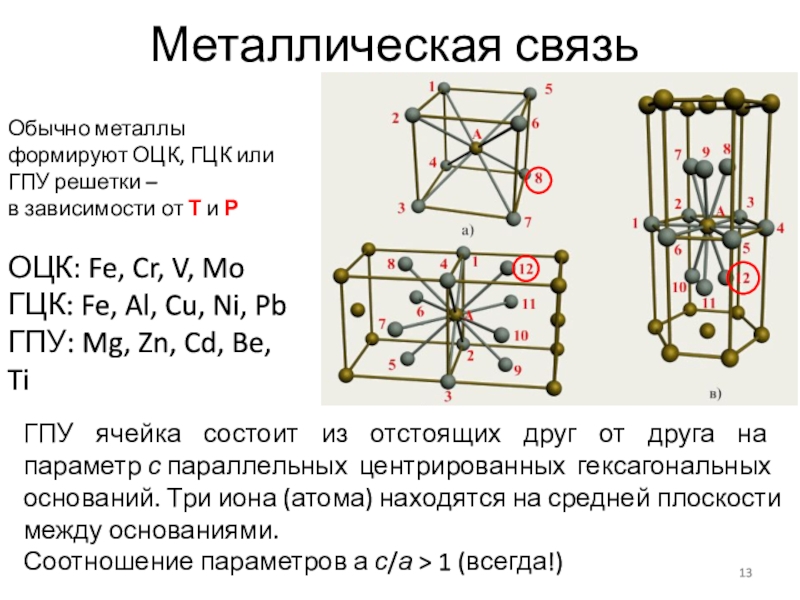
Слайд 13Металлическая связь
Обычно металлы формируют ОЦК, ГЦК или ГПУ решетки –
в зависимости от Т и Р
ОЦК: Fe, Cr, V, Mo
ГЦК: Fe, Al, Cu, Ni, Pb
ГПУ: Mg, Zn, Cd, Be, Ti
ГПУ ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
Соотношение параметров а с/а > 1 (всегда!)
Слайд 14Металлическая связь в соединениях
Электронные соединения (фазы Юм-Розери)
Их стабильность определяется свойствами
электронного газа. Электронная концентрация (число валентных электронов на один атом)
в таких соединениях может быть равной:3/2 - соединение имеет ОЦК-структуру;
21/13 - сложная кубическая структура;
7/4 – ГПУ структура.
Пример: медно-цинковый сплав
Cu(1+) - Zn(2+) для CuZn e=(1+2)/(1+1)=3/2 ОЦК,
для Cu5Zn8 e=(5⋅1+8⋅2)/(5+8)= 21/13 сложная кубическая структура,
CuZn3 e=(1⋅1+3⋅2)/(1+3) =7/4 ГПУ структура.
Фазы Лавеса (соединения)
Их стабильность имеет геометрическую природу —это плотнейшие упаковки атомов разного размера. Фазы Лавеса образуются при соотношении атомных радиусов компонентов, близком к 1,225, имеют стехиометрию A2B и сложные решётки.
Примеры —Co2Ti, Fe2Mo, MgCu2.
Слайд 17Скалярные свойства
Плотность зависит от типа структуры, коэффициента упаковки, атомной массы,
валентностей и (атомных) радиусов частиц.
С увеличением коэффициента упаковки возрастает
плотность вещества. Пример: при полиморфном переходе углерода от структуры графита (КЧ = 3) к структуре алмаза (КЧ = 4), плотность меняется от 2,2г/см³ до 3,5г/см³
Плотность кристалла связана с его относительной молекулярной массой М (удельный вес), объемом элементарной ячейки V, и числом молекул n в элементарной ячейке:
ρ=nM/NаV
Объем элементарной ячейки V определяется по ПЭЯ (рентгенография).
Реальная плотность кристалла обычно меньше из-за наличия дефектов и может быть чувствительным индикатором степени дефектности структуры. Для ее определения применяют пикнометрию.
Слайд 18Теплопроводность
Фигуры плавления на гранях
куба
гекс. призмы фигуры типа «кирпич»Для наглядного представления симметрии и анизотропии свойства пользуются указательной поверхностью, радиус-векторы которой характеризуют относительные величины свойства в данном направлении.
Шар и эллипсоид вращения
с круговыми сечениями, Ln
L PC
L L2 PC
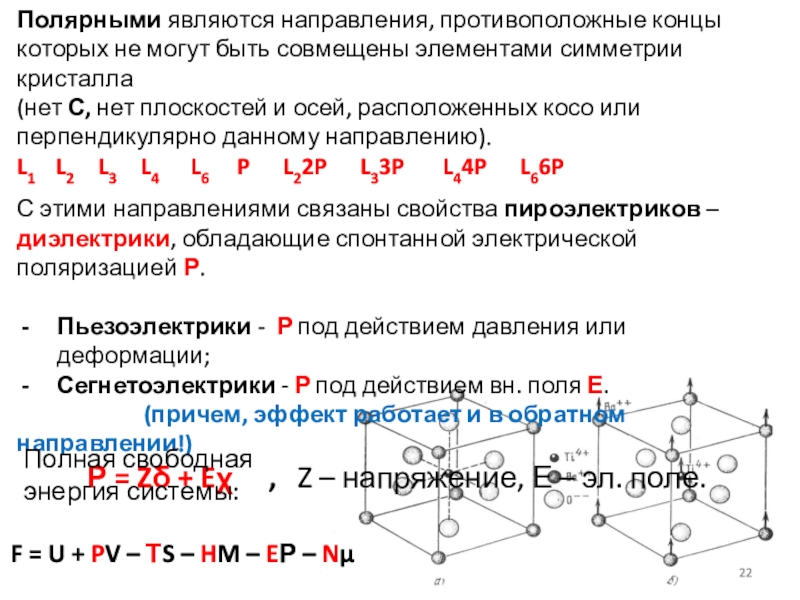
Слайд 22Полярными являются направления, противоположные концы которых не могут быть совмещены
элементами симметрии кристалла
(нет С, нет плоскостей и осей, расположенных косо
или перпендикулярно данному направлению). L1 L2 L3 L4 L6 P L22P L33P L44P L66P
С этими направлениями связаны свойства пироэлектриков – диэлектрики, обладающие спонтанной электрической поляризацией Р.
Пьезоэлектрики - Р под действием давления или деформации;
Сегнетоэлектрики - Р под действием вн. поля Е.
(причем, эффект работает и в обратном направлении!)
Р = Z + E , Z – напряжение, Е – эл. поле.
Полная свободная энергия системы:
F = U + PV – ТS – HM – EР – N
Слайд 27Измерение (микро)твердости
по Виккерсу (гостировано)
Micromet-5103
- угол между гранями алмазной
пирамидки 136;
Р – нагрузка (кг)
d – диагональ отпечатка (мм).
HV= 0.5/10
– 300.Нагрузка/время (с)
Анизотропия твердости
Розетки твердости каменной соли
Слева – грань куба, справа – грань октаэдра
Слайд 28Спайность
Спайность – свойство кристаллов колоться по плоскостям, параллельным граням (действительным
или возможным).
Проходит по наислабейшим связям.
Пример: слюда - -но пинакоиду {001}.
Используя
правило Бравэ и теорию Вульфа по спайности можно сделать вывод о структуре кристалла.Оценки степени совершенства спайности:
1) Весьма совершенная – без затруднений (минералы со слоистой структурой: слюды, графит и др.);
2) Совершенная – скол на толстые пластинки, бруски с ровными поверхностями (кальцит, галенит, ортоклаз);
3) Средняя - поверхность раскалывания не ровная и не блестящая;
4) Несовершенная - скол неровный (апатит, нефелин, аметист) и обнаруживается с трудом.
Ряд минералов не имеет спайности (например, магнетит).
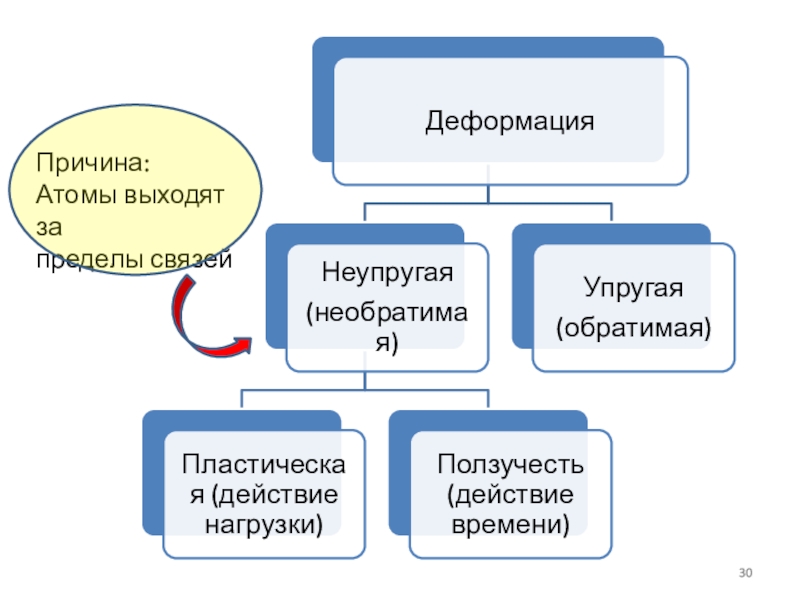
Слайд 29Деформация под действием силы
Деформация сопровождается изменением величин межатомных сил, мерой
чего является упругое механическое напряжение.
Деформации разделяют на обратимые (упругие) и
необратимые (пластические, ползучести).Деформации ползучести — это необратимые деформации, происходящие с течением времени.
Способность веществ пластически деформироваться называется пластичностью. При пластической деформации металла одновременно с изменением формы меняется ряд свойств — в частности, при холодном деформировании повышается прочность.
Способность после деформации возвращаться к исходной форме – упругость.