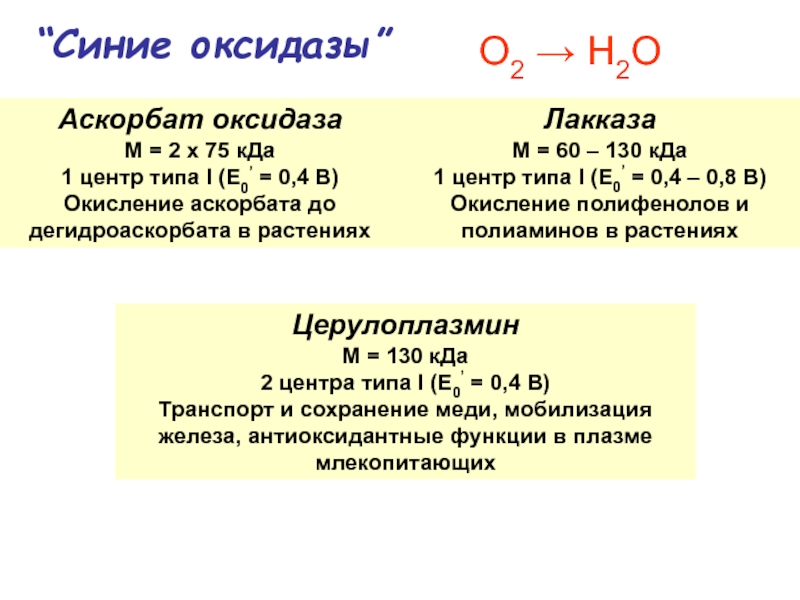
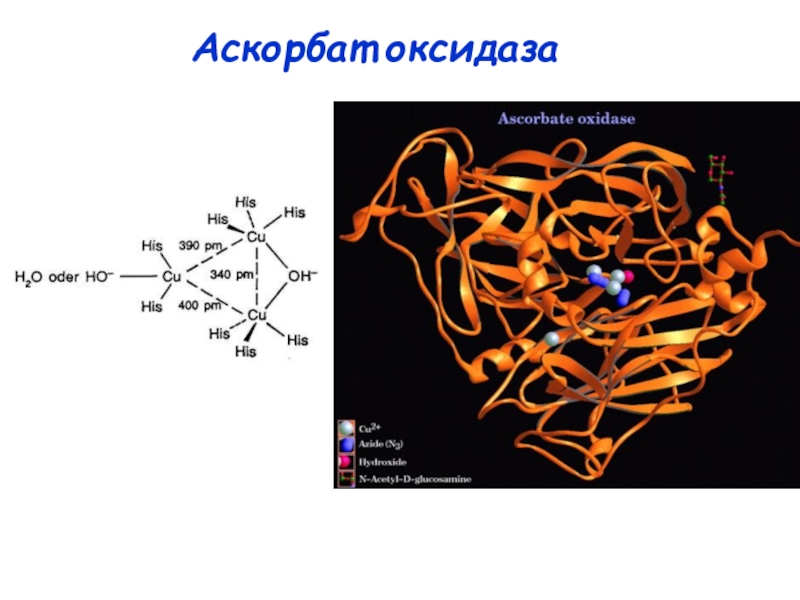
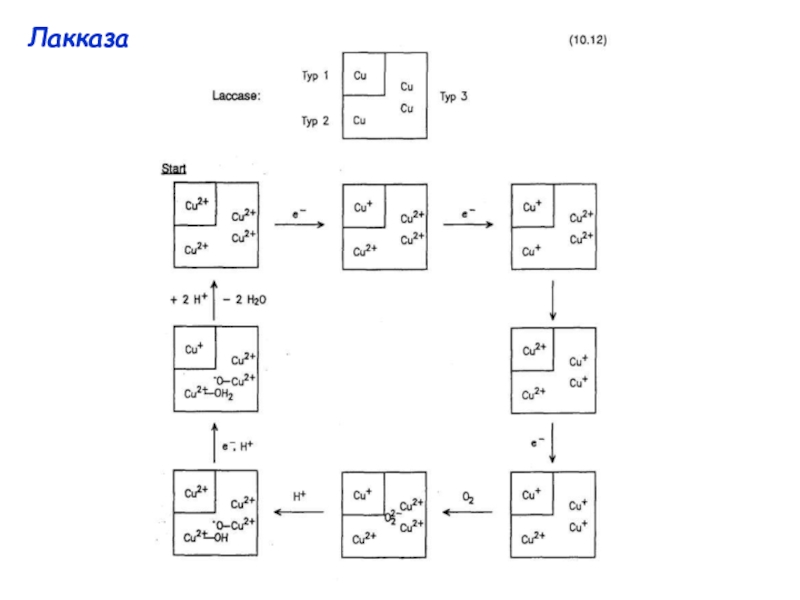
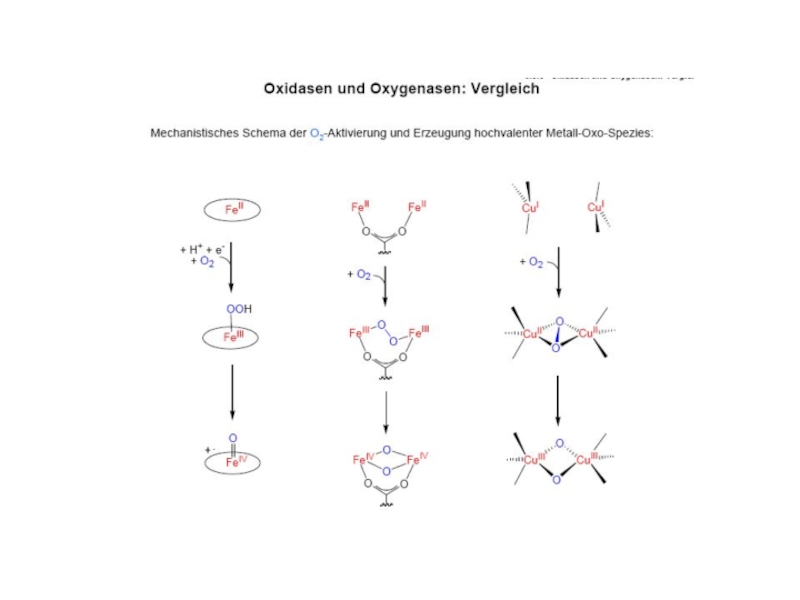
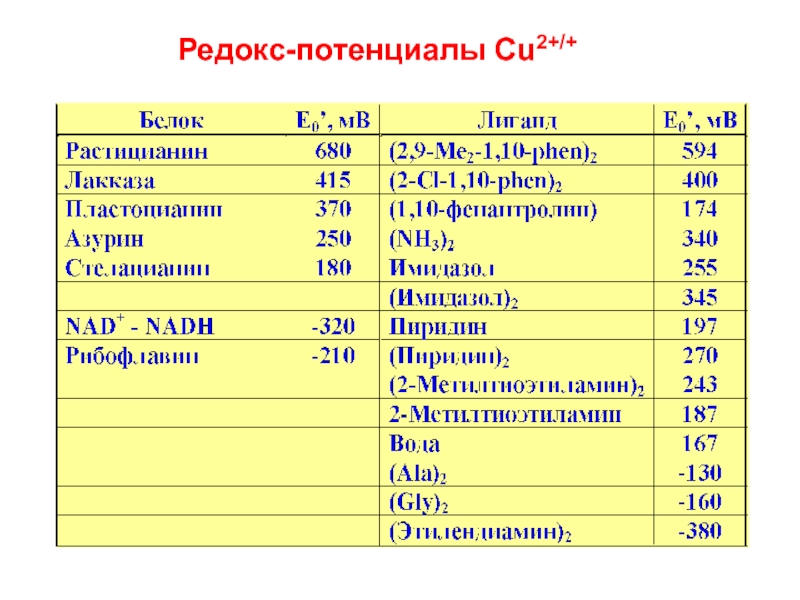
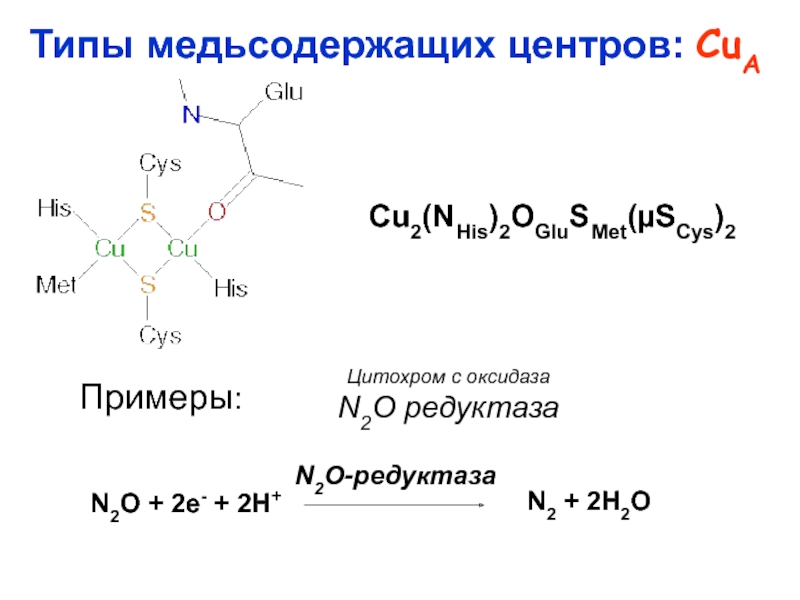
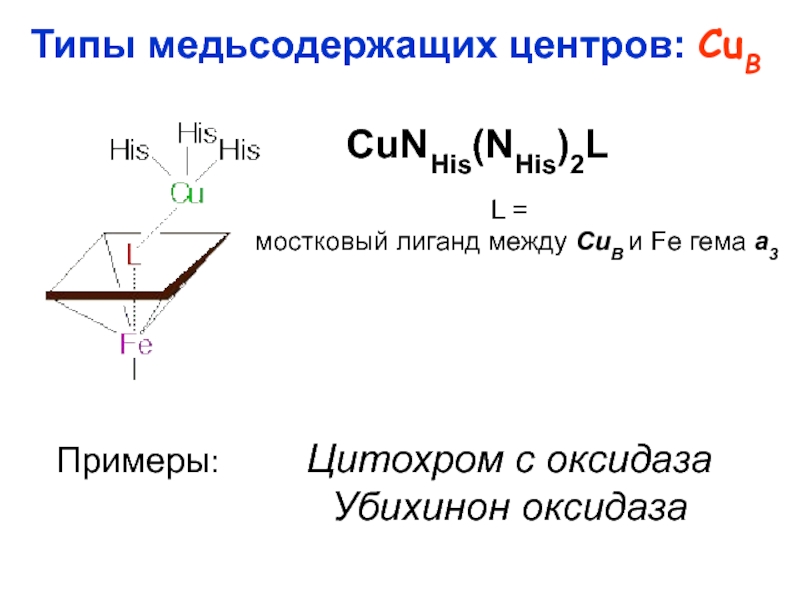
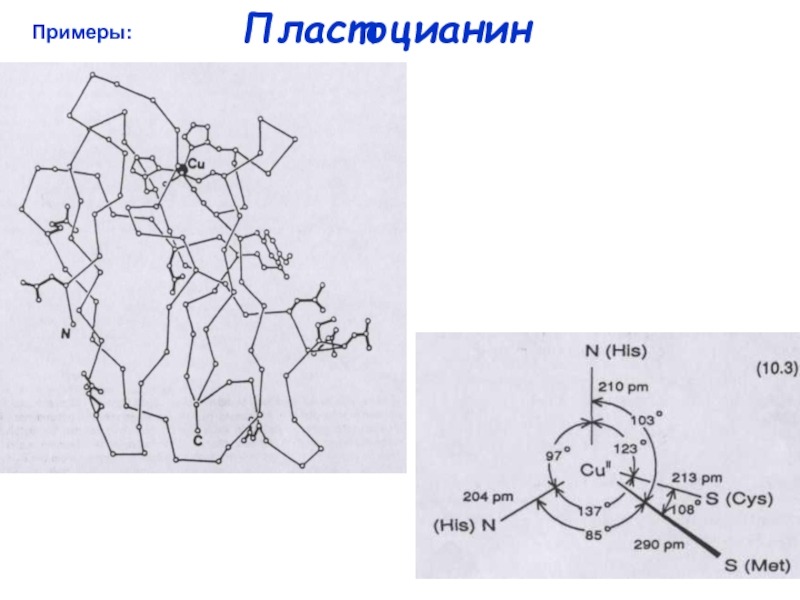
лакказа) R = O (Glu) (фитоцианины) R = H2O
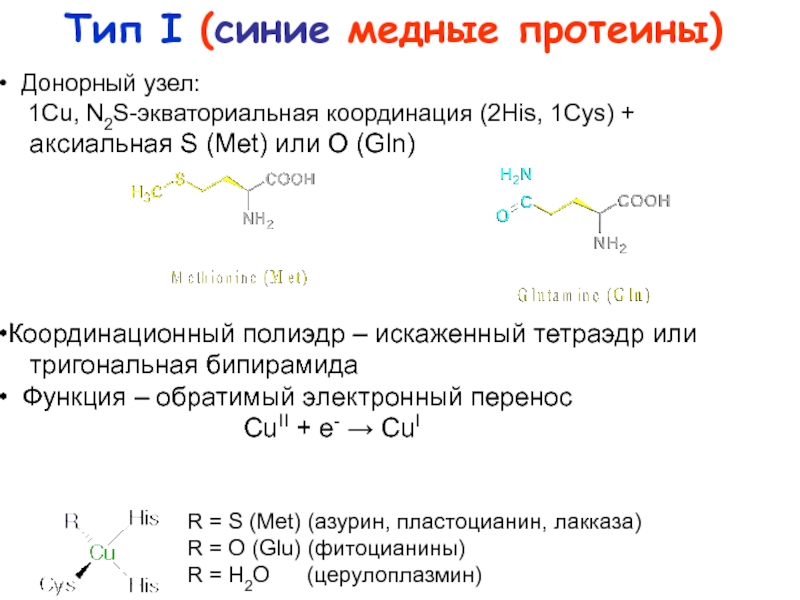
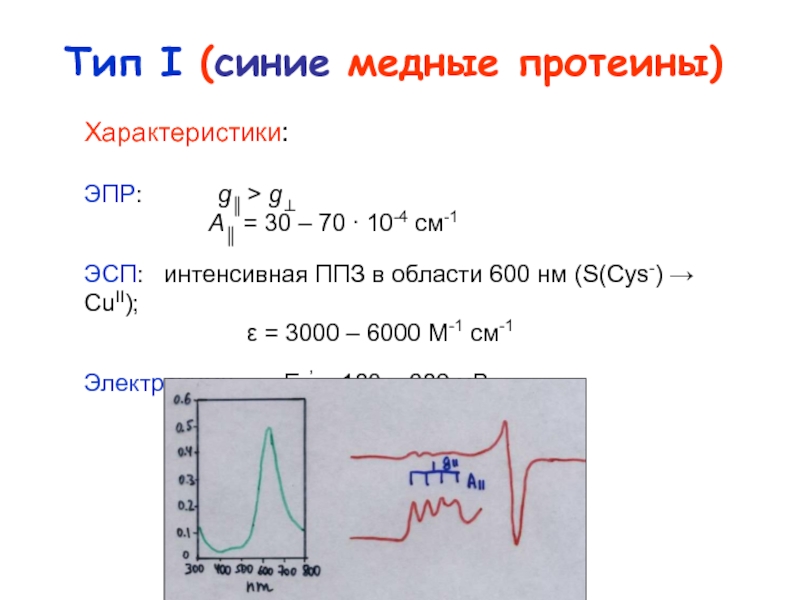
(церулоплазмин) Донорный узел:
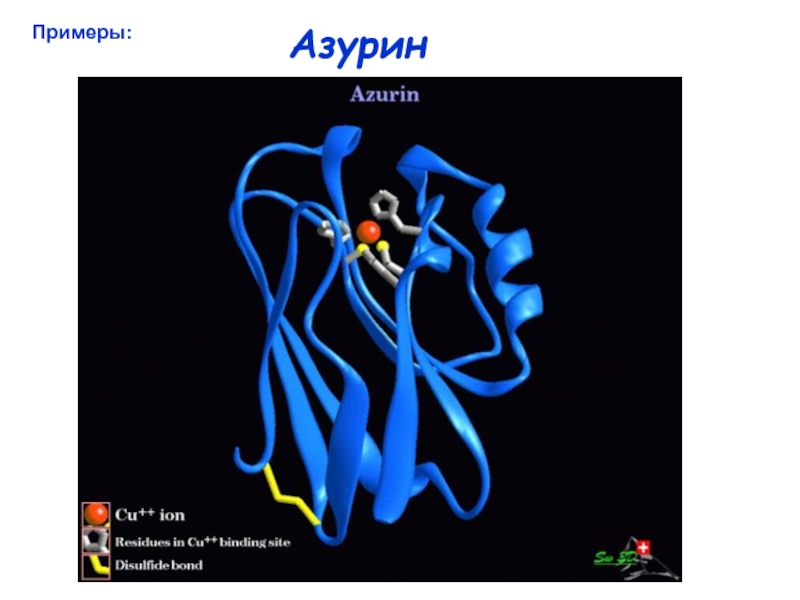
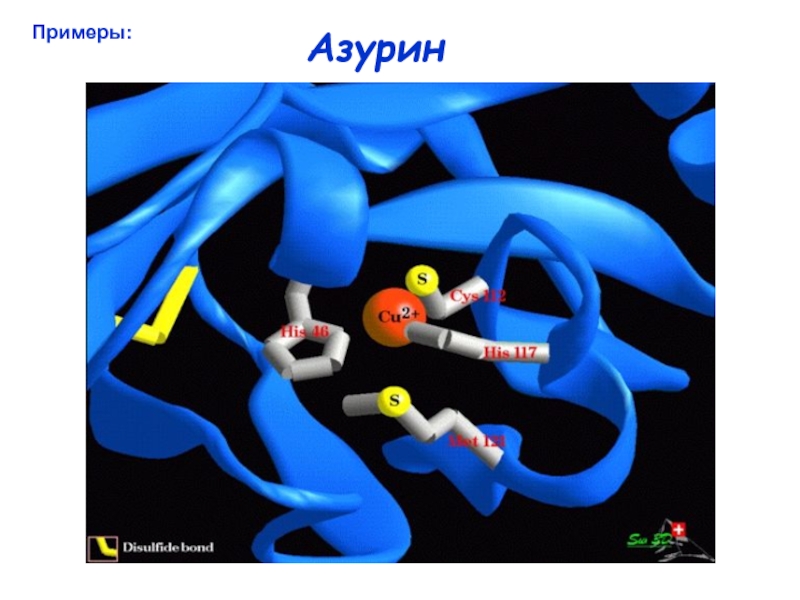
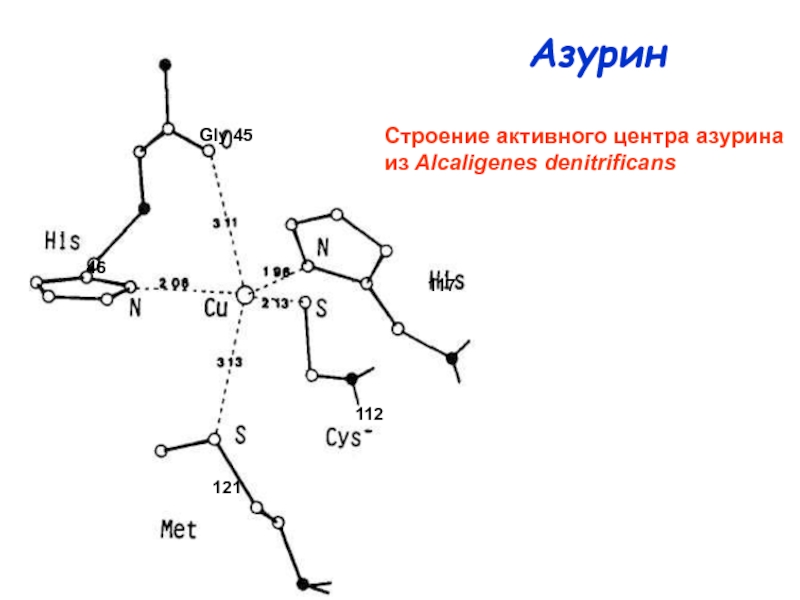
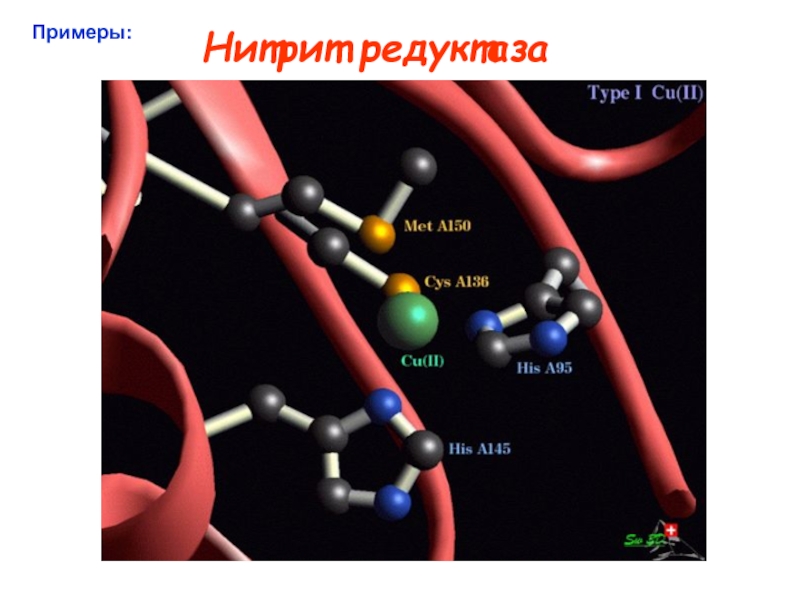
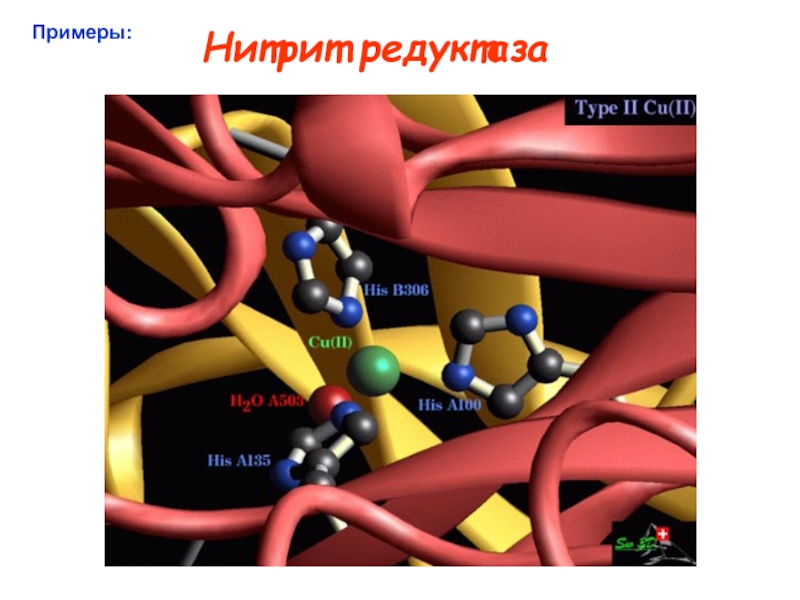
1Cu, N2S-экваториальная координация (2His, 1Cys) +
аксиальная S (Met) или O (Gln)
Координационный полиэдр – искаженный тетраэдр или
тригональная бипирамида
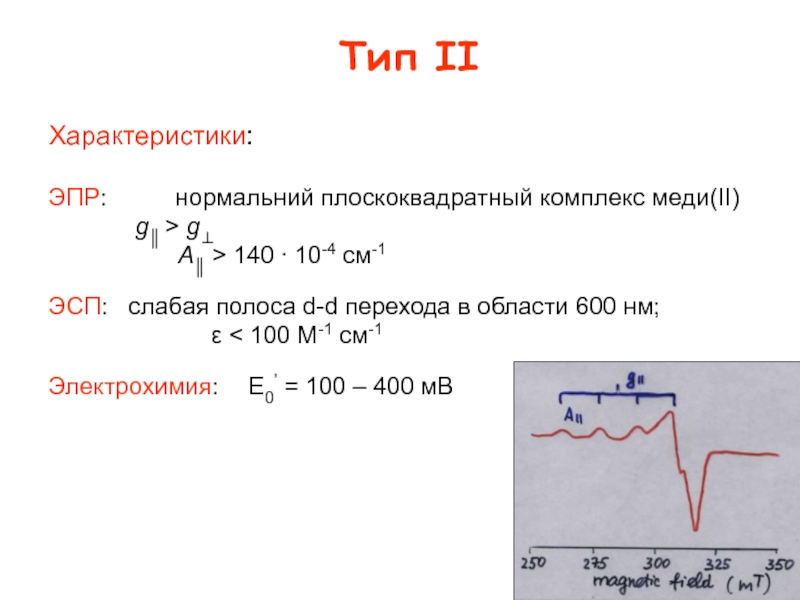
Функция – обратимый электронный перенос
CuII + e- CuI

![Типы медьсодержащих центров :
Cu
Медьсодержащие
протеины Cu[(N)His]mRn L = N, O или S-доноры; R = O или Cu[(N)His]mRn L = N, O или S-доноры; R = O или S-доноры m](/img/thumbs/a3876c6fa57b54fa5ea145f64254a541-800x.jpg)

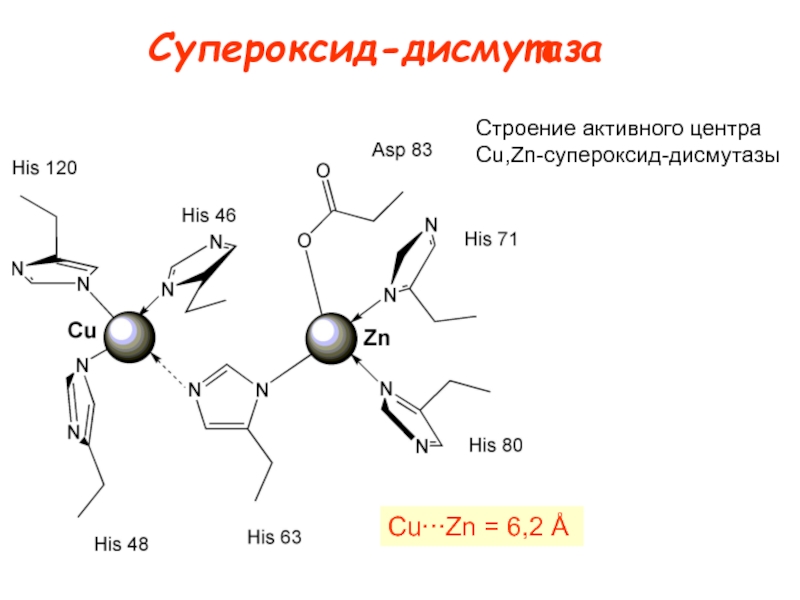
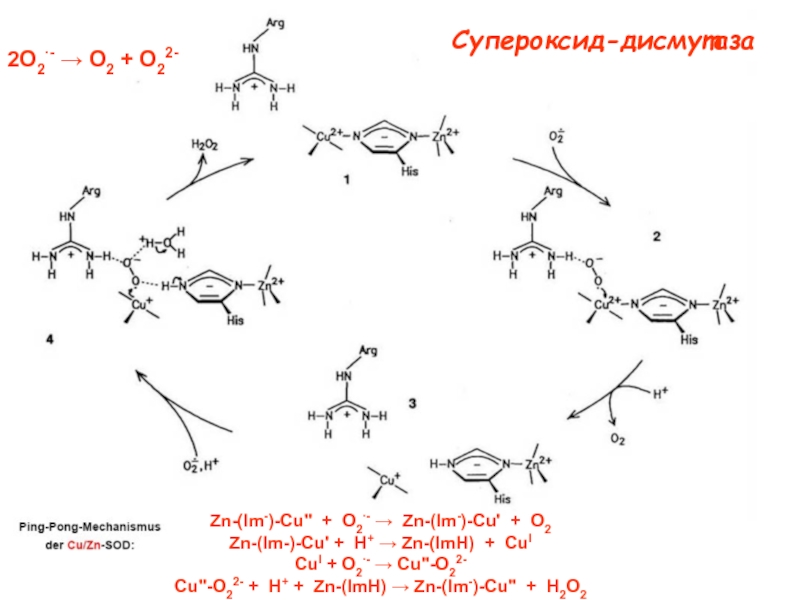
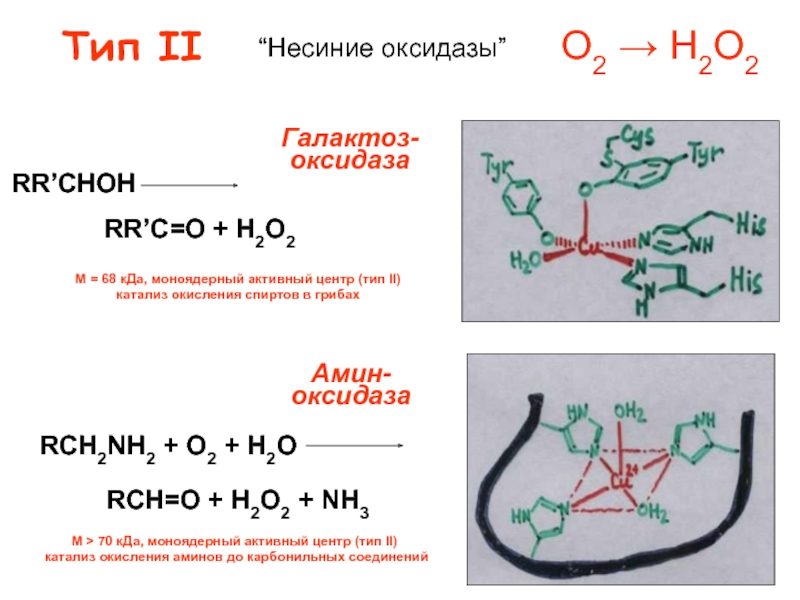
![Типы медьсодержащих центров :
Cu
Медьсодержащие
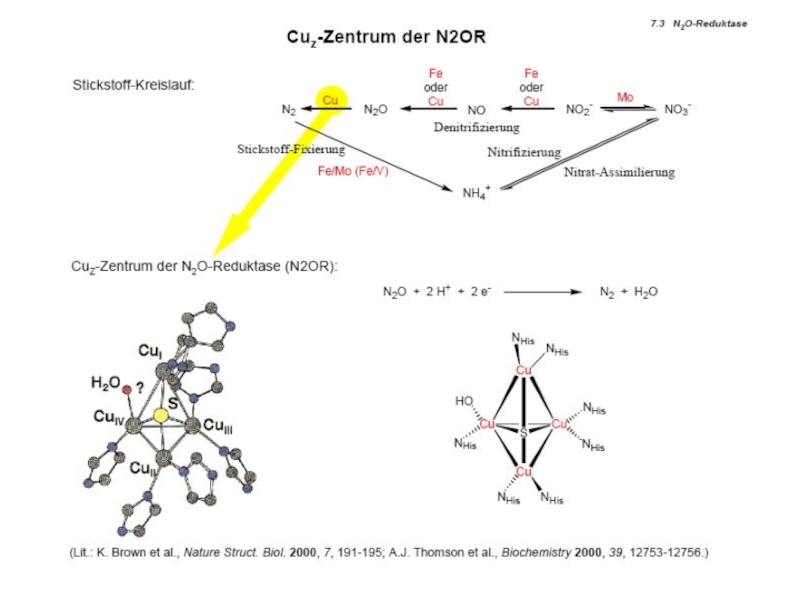
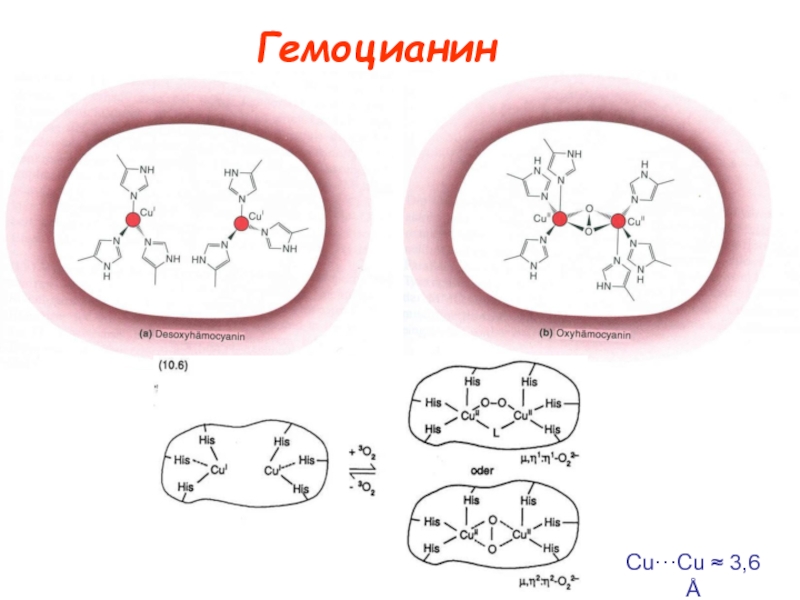
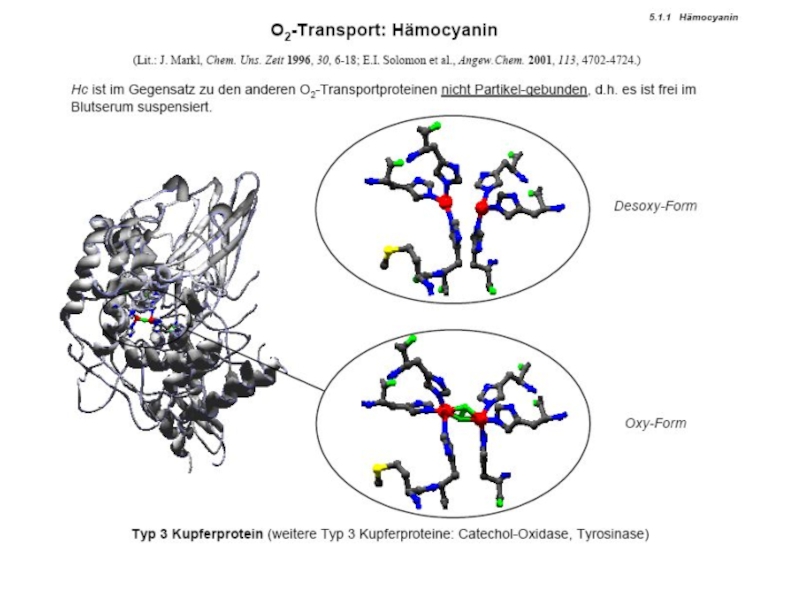
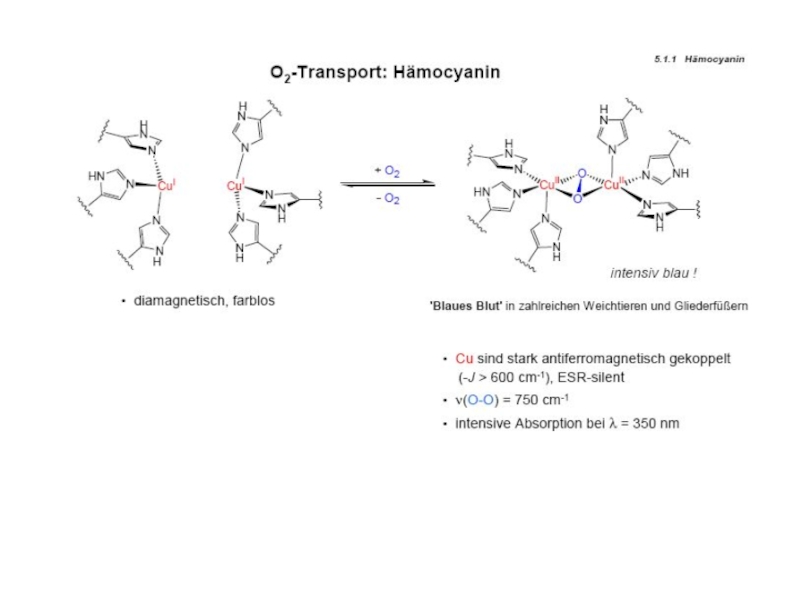
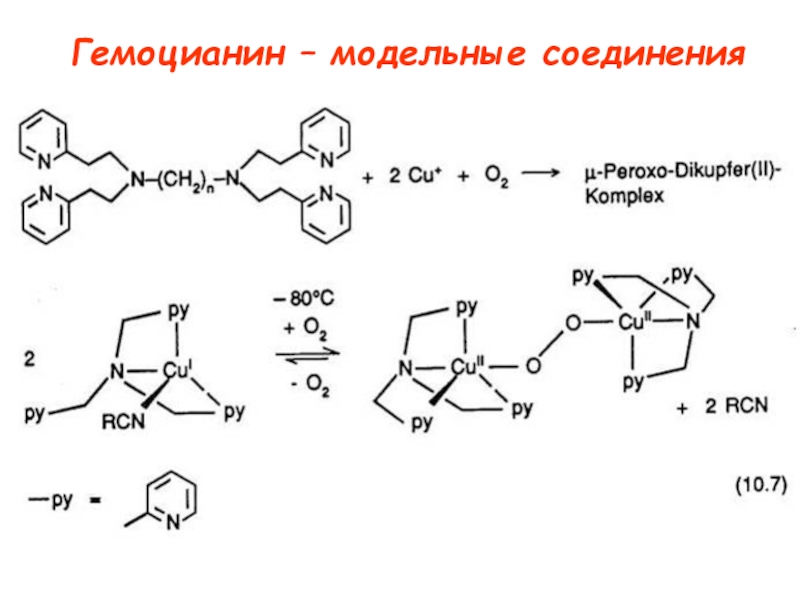
протеины µO2[Cu(N His)3]2 Катехолоксидаза Гемоцианины Тирозиназа Тип III Примеры: Cu2-димер; N3···N3 донорный µO2[Cu(N His)3]2 Катехолоксидаза Гемоцианины Тирозиназа Тип III Примеры: Cu2-димер; N3···N3 донорный узел Полиэдр – тригональная антипризма Функции](/img/tmb/4/345812/fda4ae67b3f0f25399c2cc953d89cae4-800x.jpg)
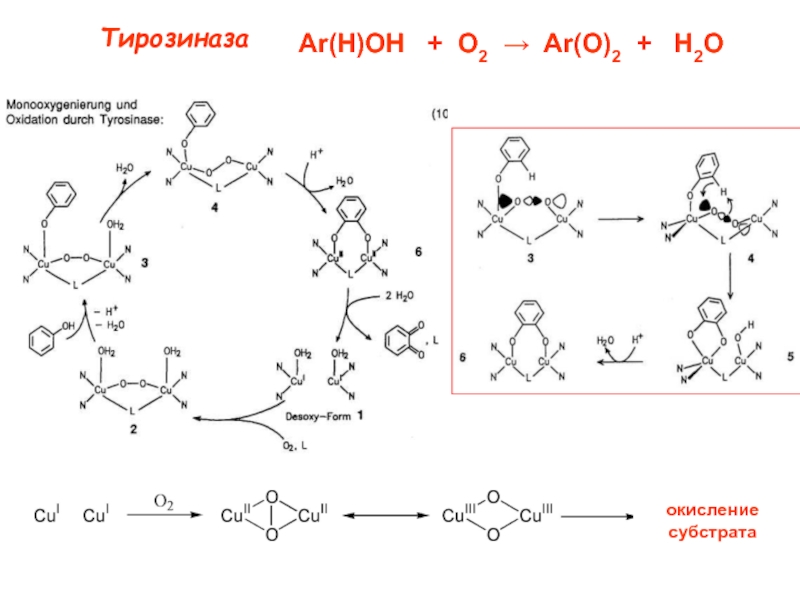
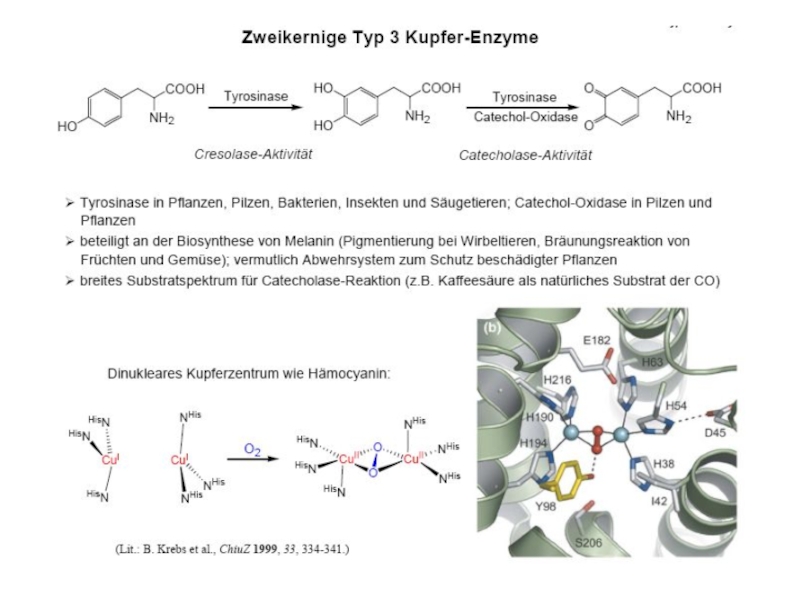
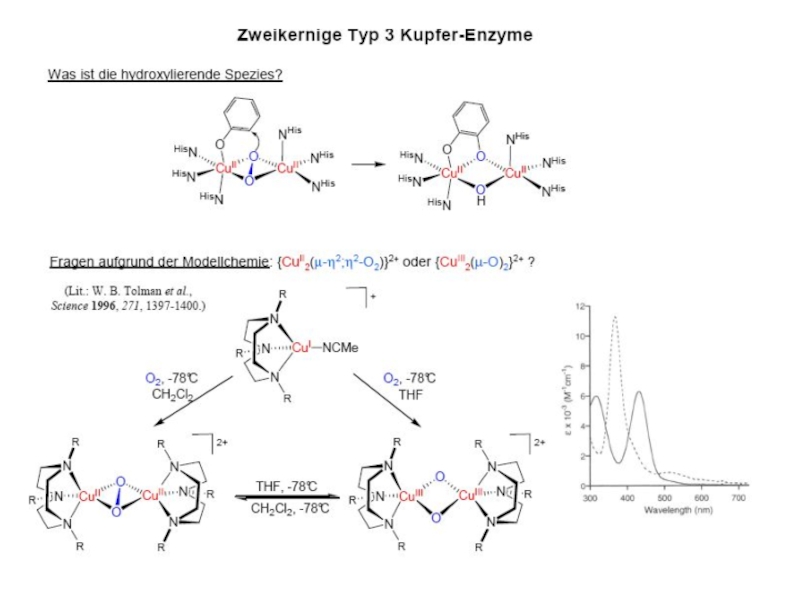
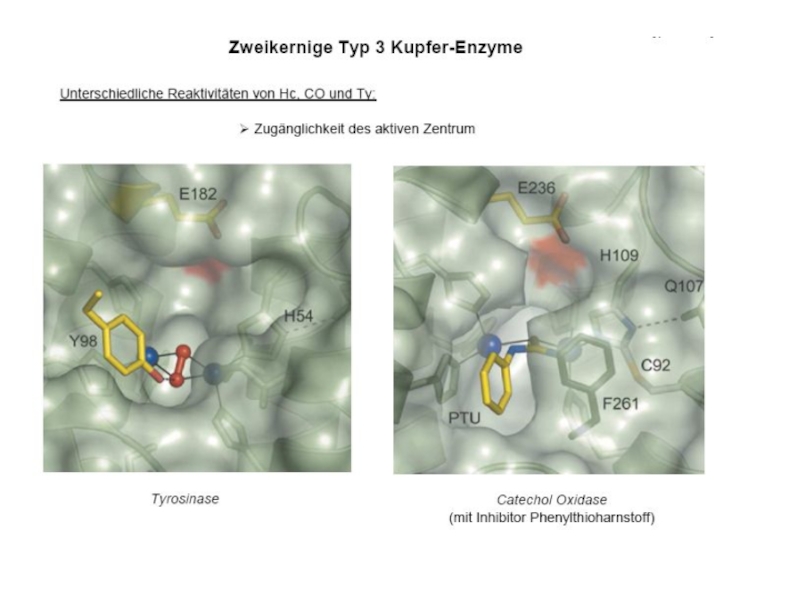
![Типы медьсодержащих центров :
Cu
Медьсодержащие
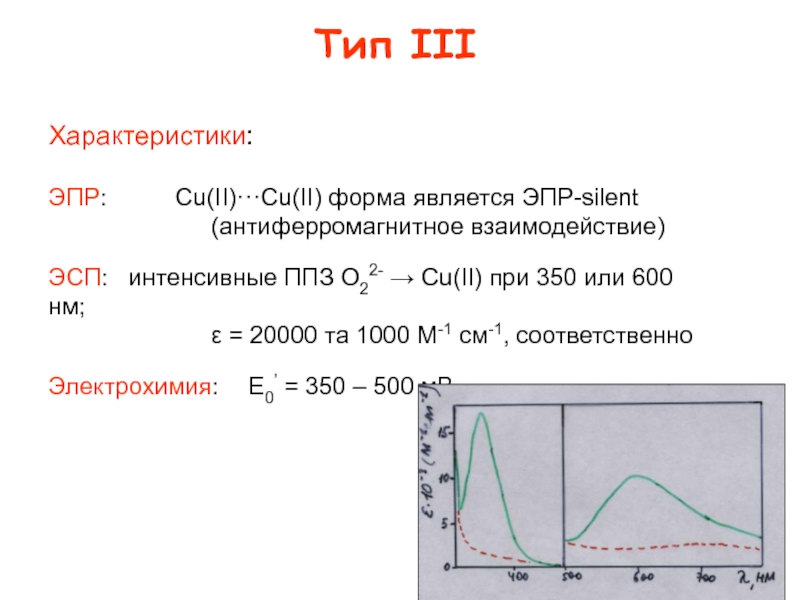
протеины Cu(N His)2OH·µOH[Cu(N His)3]2 Синие оксидазы: Аскорбат оксидаза ЛакказаЦерулоплазмин Триядерный центр (Тип II + Cu(N His)2OH·µOH[Cu(N His)3]2 Синие оксидазы: Аскорбат оксидаза ЛакказаЦерулоплазмин Триядерный центр (Тип II + Тип III)Примеры: Cu3-тример; N3···N3···N2O донорный](/img/tmb/4/345812/ba95c6d4284ec6169ffd2099545565aa-800x.jpg)