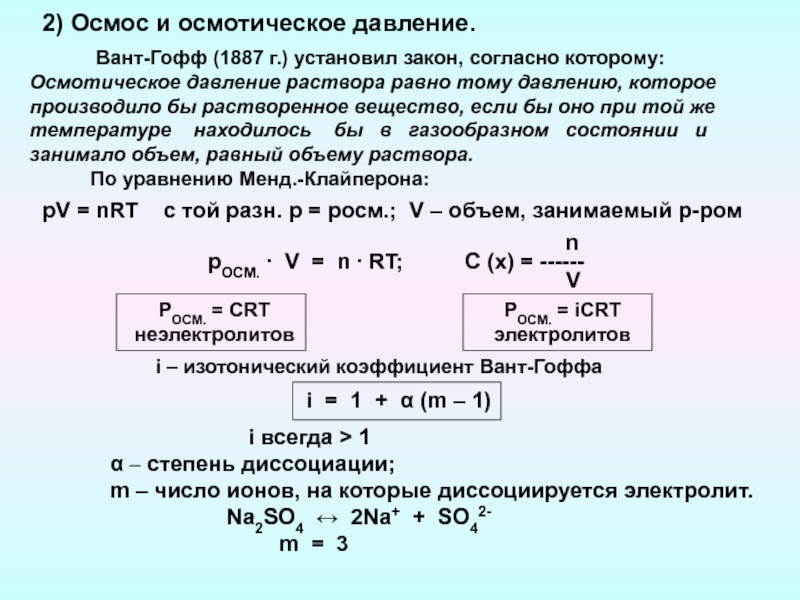
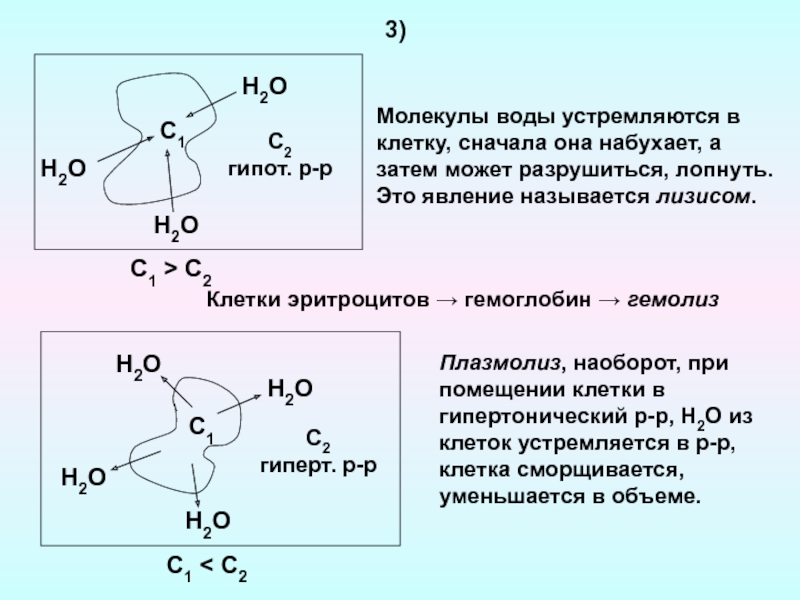
связаны с водными растворами:
2/3 части веса тела взрослого человека – Н2ОПечень, мозг, кожа 70 % Н2О
Мышцы, сердце 70 - 80 %
Почки, соединительные ткани 80 - 82 %
Кровь 83 %
Слюна, моча, пот 95 - 99 %
Раствор = растворитель + растворенное вещество.