реагентов и продуктов, находят окислитель, восстановитель и среду.
2. Записывают
формулы окислителя и восстановителя и соответствующие продукты реакции в ионном виде.
3. Составляют ионные уравнения полуреакций восстановления и окисления, соблюдая для каждой из них законы сохранения числа атомов и заряда.
4. Находят наименьшее общее кратное (н.о.к.) числа переданных в каждой полуреакции электронов и подбирают дополнительные множители для уравнений полуреакций так, чтобы число принятых электронов стало равным числу отданных электронов.
5. Составляют ионное уравнение реакции
6. Уравнивают числа остальных атомов, участвующих в реакции, и получают уравнение реакции с подобранными коэффициентами.
K2Cr2O7 + H2SO4 + H2S S + Cr2(SO4)3 ...
Ок Среда Вс
Cr2O72– + H+ + H2S S + Cr3+ + H2O
Cr2O72– (Оф) → Cr3+ (Вф)
H2S (Вф) → S (Оф)
Cr2O72– + 8H+ + 6e– = 2Cr3+ + 7H2O
H2S – 2e– = S + 2H+
н.о.к. 6
Cr2O72– + 8H+ + 6e– = 2Cr3+ + 7H2O | 1
H2S – 2e– = S + 2H+ | 3
Cr2O72– + 8H+ + 3H2S = 3S + 2Cr3+ + 7H2O
K2Cr2O7 + 4H2SO4 + 3H2S = 3S + Cr2(SO4)3 + 7H2O + K2SO4
17















![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Подбор числа атомов водорода и кислородаКислотная среда[HI] = H+[OII] + 2H+ Подбор числа атомов водорода и кислородаКислотная среда[HI] = H+[OII] + 2H+ = H2OЩелочная среда[HI] + OH– =](/img/thumbs/f4c2e7be0c14e3eb10ae8d6c2db21b7b-800x.jpg)









![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Комплексные соединенияКоординационное число (КЧ) 6Дентатность лиганда 1Заряд комплекса 3– Внешняя сфераВнутренняя сфераЛигандыКомплексообразовательNa3[Co(NO2)6]30 Комплексные соединенияКоординационное число (КЧ) 6Дентатность лиганда 1Заряд комплекса 3– Внешняя сфераВнутренняя сфераЛигандыКомплексообразовательNa3[Co(NO2)6]30](/img/thumbs/9f5771434e9b182307e18ab8cabf9b20-800x.jpg)

![Уральский государственный
аграрный университет
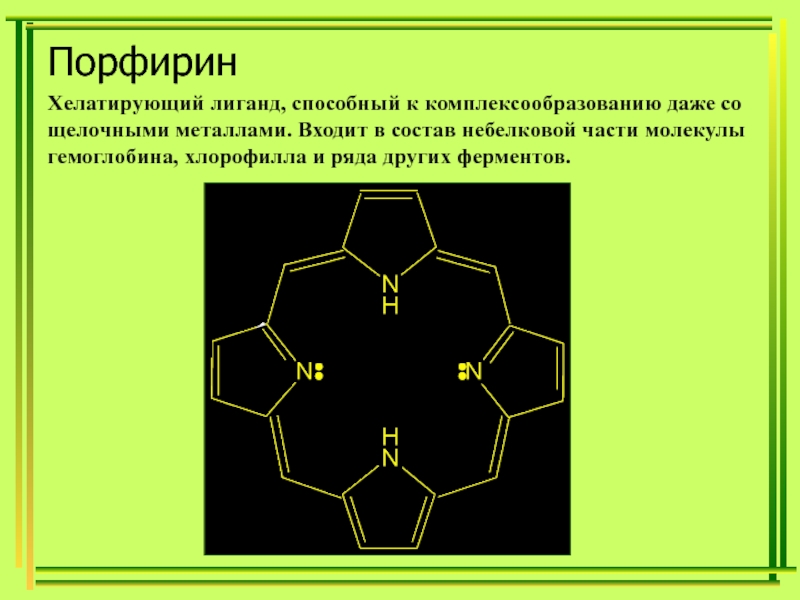
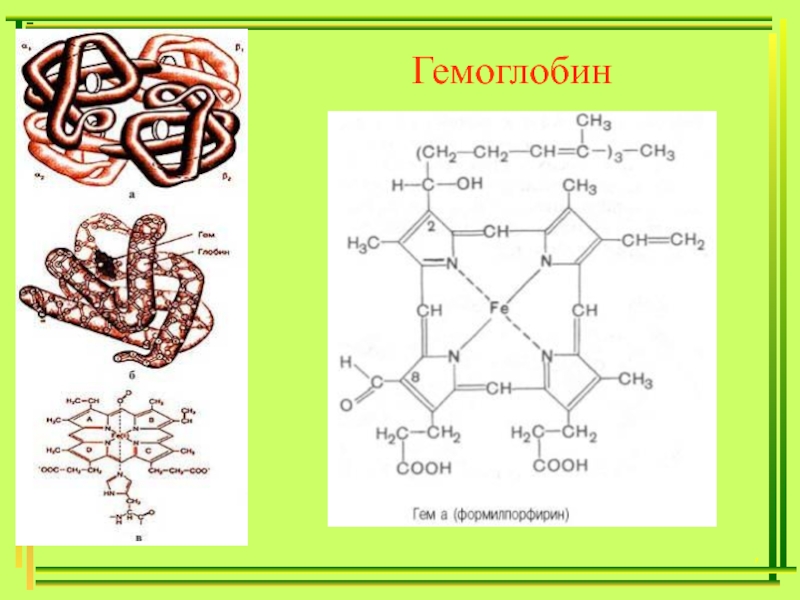
д.х.н., проф. Хонина Татьяна ПримерыГексанитрокобальтат(III) натрия Na3[Co(NO2)6]Гидроксид диамминсеребра(I) [Ag(NH3)2]OH Тетраиодомеркурат(II) калия K2[HgI4] ,Тетрароданомеркурат(II) аммония (NH4)2[Hg(SCN)4]32 ПримерыГексанитрокобальтат(III) натрия Na3[Co(NO2)6]Гидроксид диамминсеребра(I) [Ag(NH3)2]OH Тетраиодомеркурат(II) калия K2[HgI4] ,Тетрароданомеркурат(II) аммония (NH4)2[Hg(SCN)4]32](/img/thumbs/f931fefc98a70a017330d48d3a9fe159-800x.jpg)
![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Примеры[Cu(H2O)4]2+ катион тетрааквамеди(II)[Zn(OH)4]2– тетрагидроксоцинкат-ион[Cr(H2O)5OH]2+ катион гидроксопентааквахрома(III)K[BF4] тетрафтороборат калия33 Примеры[Cu(H2O)4]2+ катион тетрааквамеди(II)[Zn(OH)4]2– тетрагидроксоцинкат-ион[Cr(H2O)5OH]2+ катион гидроксопентааквахрома(III)K[BF4] тетрафтороборат калия33](/img/tmb/4/327066/581d3b549a3b4304092fd484df7335da-800x.jpg)
![Уральский государственный
аграрный университет
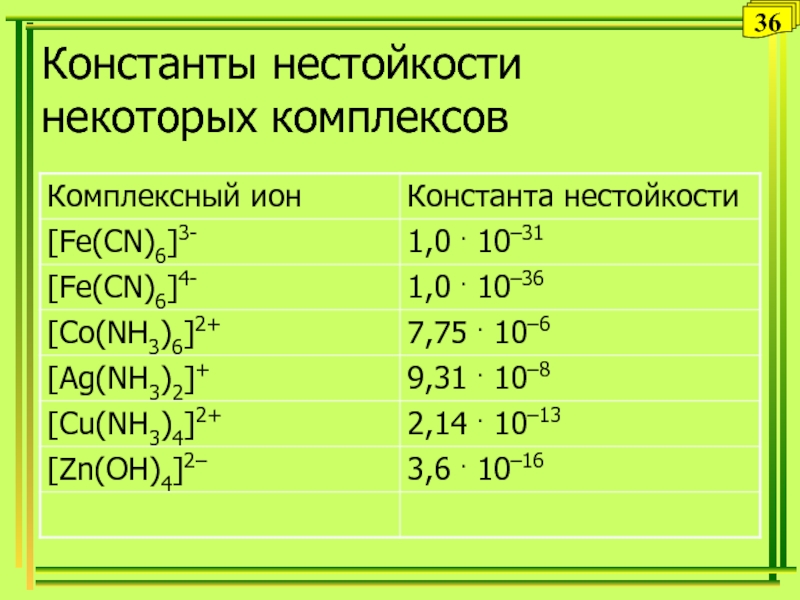
д.х.н., проф. Хонина Татьяна Комплексные соединения в растворахПервичная диссоциация комплексных соединенийK3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-[Cu(NH3)4]SO4 Комплексные соединения в растворахПервичная диссоциация комплексных соединенийK3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42-[Ag(NH3)2]Cl = [Ag(NH3)2]+](/img/thumbs/df50b7db29c091f890f3876d3a4eb034-800x.jpg)
![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Вторичная диссоциация комплексов[Ag(NH3)2]+ [Ag(NH3)]+ + NH3[Ag(NH3)]+ Ag+ + NH3 Вторичная диссоциация комплексов[Ag(NH3)2]+ [Ag(NH3)]+ + NH3[Ag(NH3)]+ Ag+ + NH3](/img/thumbs/73b562917d23239ead1aa922560ea90d-800x.jpg)