Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок физики Тема : Планетарная модель атома. Постулаты Бора. Спектры
Содержание
- 1. Урок физики Тема : Планетарная модель атома. Постулаты Бора. Спектры
- 2. Цель урока:Расширить знания учащихся по вопросу строения
- 3. Актуализация
- 4. Гипотеза о том, что вещества состоят из
- 5. Ломоносов Михаил Васильевич (8/19.11.1711 - 4/15.04.1765 )
- 6. Конкретные представления о строении
- 7. В 1904 году японский физик
- 8. Модель строения атома ТомсонаАтом – шар, по
- 9. Модель строения атома Томсона «пудинг с изюмом»
- 10. Модель Томсона
- 11. Резерфорд Эрнест (1871–1937) – английский физик, основоположник
- 12. Идея опыта Резерфорда:Зондировать атом
- 13. Слайд 13
- 14. Слайд 14
- 15. Статистика вспышек
- 16. Результаты опытов
- 17. Обнаружилось, что
- 18. Выводы из опытов:Положительный заряд сосредоточен в малой
- 19. На основе выводов из опытов Резерфордом была
- 20. Выводы: В центре атома находится положительно заряженное
- 21. Недостатки модели атома Резерфорда Данная модель не
- 22. Попыткой спасения планетарной
- 23. 1922 г. - Нильсу Бору присуждена Нобелевская премия
- 24. I постулат: Атомная система может находиться только
- 25. II постулат: Излучение света атомом происходит при
- 26. Энергетический уровень – энергия, которой обладает атомный
- 27. Частота излучения или поглощения
- 28. Слайд 28
- 29. Линейчатые спектры – излучения - поглощения
- 30. h =h/2π =1,05*10-34 Дж – приведенная постоянная
- 31. Слайд 31
- 32. На длине окружности каждой стационарной орбиты укладывается
- 33. Строение атомавещество молекулаатомядроэлектронынуклоныпротонынейтроныкварки
- 34. Луи де Бройль ДИРАК ПОЛЬ АДРИЕН МОРИС Вернер Карл ГейзенбергЭрвин Шрёдингер
- 35. Вопросы на закрепление:1.
- 36. Слайд 36
- 37. Домашнее задание:
- 38. Желаю удачи в изучении физики и познании мира!
- 39. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Цель урока:
Расширить знания учащихся по вопросу строения атома
Изучить фундаментальный эксперимент
английского физика Э. Резерфорда
Доказать ядерную модель атома на основе
опытов Резерфорда Раскрыть недостатки данной модели и пути их разрешения /
преодоления
Слайд 3 Актуализация знаний
Что вам известно
о строении вещества?
Как мы узнаем о строении вещества?
Каково строение атома?
Как можно узнать о строении атома?
Что такое электрон?
Входят ли электроны в состав ядра?
Имеет ли ядро атома внутреннюю структуру?
Слайд 4Гипотеза о том, что вещества состоят из большого числа атомов,
зародилась свыше двух тысячелетий назад.
«Существует предел деления – атом, не
подверженное никаким изменениям».«Делимость вещества бесконечна».
АРИСТОТЕЛЬ
(384 до н.э. – 322 до н.э)
Слайд 5Ломоносов Михаил Васильевич
(8/19.11.1711 - 4/15.04.1765 )
М. В. Ломоносов
утверждает, что все вещества состоят из «корпускул» — «молекул», которые
являются «собраниями» «элементов» — «атомов»: «Элемент есть часть тела, не состоящая из каких-либо других меньших и отличающихся от него тел... Учёный указывает на шарообразную его форму. Именно М. В. Ломоносову принадлежит мысль о «внутреннем вращательном движении частиц».Слайд 6 Конкретные представления о строении атома развивались по мере
накопления физикой фактов о свойствах вещества.
1888 г. Борис Николаевич Чичерин
рассматривал атом как сложную систему, состоящую из положительно заряженной центральной массы и окружающих ее отрицательных оболочек. Частицы с отрицательным зарядом (электроны) обладают наибольшей подвижностью, а общее число оболочек возрастало с увеличением атомной массы элемента. Атом, по Чичерину, подобен Солнечной системе.1897 г - Дж. Дж. Томсон доказал существование электрона, измерил его заряд и массу.
1897 г - В. Вебер впервые высказал мысль об электронном строении атома ( электроны входят в состав атома).
1905 г - Ф. Линдеман утверждал, что атом кислорода имеет форму кольца, а атом серы - форму лепешки.
1903-1904 г - Дж. Дж. Томсон предложил модель атома в виде положительно заряженного шара, в котором «плавают» электроны.
1907 г. Николай Александрович Морозов создал модель строения атома, исходя из периодического закона Менделеева. Атом он представлял в форме куба, внутри которого находится + q заряд, в узлах — отрицательный
Слайд 7 В 1904 году японский физик Хантаро Нагаока предложил
модель атома, построенную по аналогии с планетой Сатурн. В этой
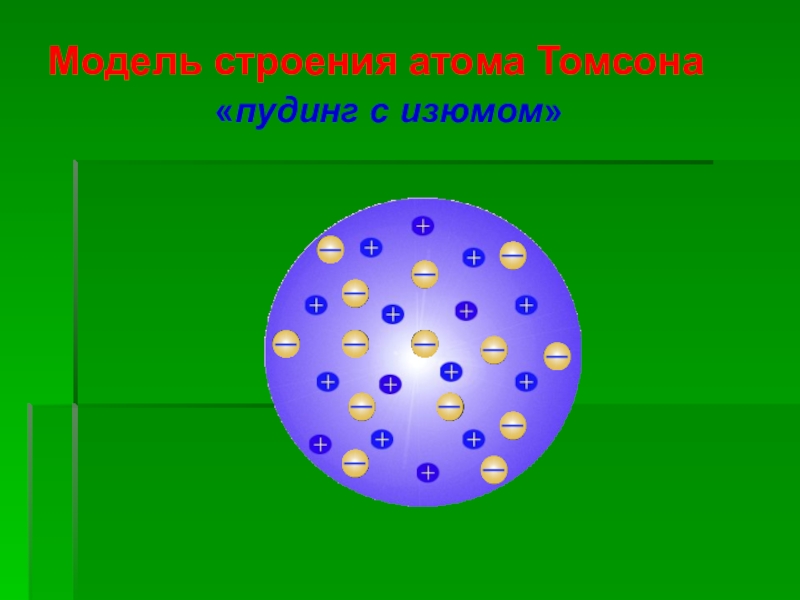
модели вокруг маленького положительного ядра по орбиталям вращались электроны, объединённые в кольца.Слайд 8Модель строения атома Томсона
Атом – шар, по всему объёму которого
равномерно распределён положительный заряд.
Внутри шара находятся электроны.
Каждый электрон может совершать
колебательные движения только около своего положения равновесия.Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю.
Слайд 10 Модель Томсона нуждалась в
экспериментальной проверке. Важно было убедиться, действительно ли
положительный заряд распределён по всему объёму атома с постоянной плотностью.В 1909 г. Эрнест Резерфорд совместно со своими сотрудниками Г. Гейгером и
Э. Марсденом провёл ряд опытов по исследованию состава и строения атомов.
Слайд 11Резерфорд Эрнест (1871–1937) – английский физик, основоположник ядерной физики. Его
исследования посвящены атомной и ядерной физике, радиоактивности.
Своими фундаментальными открытиями в
этих областях заложил основы современного учения о радиоактивности и теории строения атома.В 1899 г. открыл α - и β- лучи.
Вместе с Ф. Содди в 1903 г. разработал теорию радиоактивного распада и установил закон радиоактивных превращений.
В 1903 г. доказал, что альфа-лучи состоят из положительно заряженных частиц. Предсказал существование трансурановых элементов.
В 1908 г. ему была присуждена Нобелевская премия.
В 1931 г. Э. Резерфорд за свои научные заслуги стал пэром Англии, получив титул лорда Нельсона
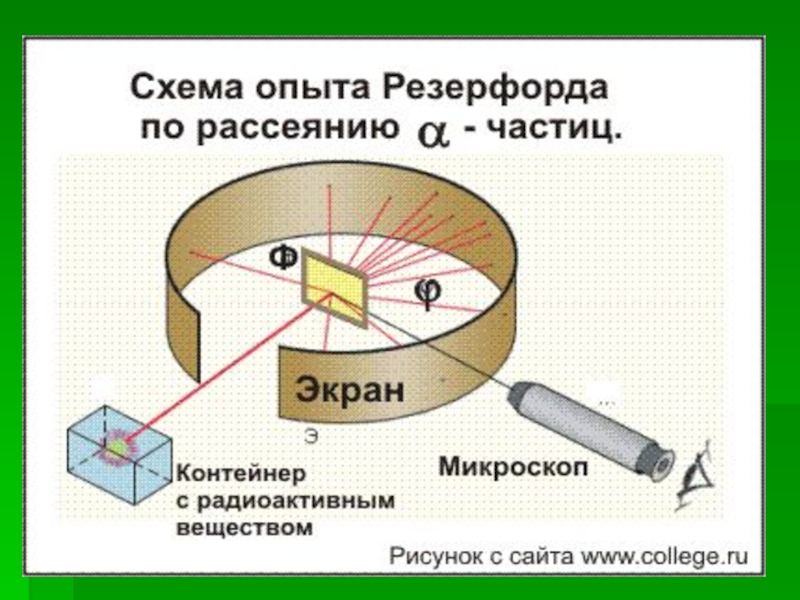
Слайд 12 Идея опыта Резерфорда:
Зондировать атом альфа - α–частицами.
α-частицы
возникают при распаде радия.
Масса α-частицы в 8000 раз больше
массы электрона.Положительный электрический заряд α-частицы в 2 раза больше заряда электрона.
Скорость α-частицы около 15 000 – 20 000 км/с.
α-частица является ядром атома гелия.
Выяснить внутреннюю структуру атома:
Распределение массы
Распределение положительного и отрицательного заряда
Размеры атома
Слайд 16 Результаты опытов :
Подавляющая часть α-частиц
- более 90% -проходит сквозь фольгу практически без отклонения или
с отклонением на малые углы Некоторая небольшая часть α-частиц - менее 1% - при прохождении через фольгу отклоняется на значительные углы( 90, 120, 150 градусов)
Объяснить этот результат на основе модели Томсона оказалось невозможным.
Слайд 17 Обнаружилось, что некоторые
α-частицы отклонялись
на большие углы, до 180º.
Резерфорд понял, что такое отклонение возможно
лишь при встрече с положительно заряженной частицей большой массы. Малая вероятность отклонения на большие углы говорила о том, что эта положительная частица имеет малые размеры, порядка 10-14 м. Электроны, по Резерфорду, движутся вокруг ядра.
Оказалось, что радиус ядра R(1014 ÷ 1015)м и зависит от числа нуклонов в ядре.
Слайд 18Выводы из опытов:
Положительный заряд сосредоточен в малой части атома –
ядре;
Практически вся масса атома сосредоточена в этом ядре – 99,4%
Отклонения
альфа-частиц на большие углы происходят в результате столкновения альфа – частиц с ядром одного из атомов;Теоретические расчеты позволили оценить размеры ядер атомов – порядка
м, тогда как размеры атома м
Слайд 19На основе выводов из опытов Резерфордом была предложена планетарная
модель атома
Конец ХIХ - начало ХХ века
Слайд 20Выводы:
В центре атома находится положительно заряженное ядро, вокруг
которого вращаются по определенным орбитам электроны.
Основная масса атома сосредоточена
в ядре m ядра - 99,4% m атома.D атома = 10 –10 м
D ядра ~ 10-14 - 10 – 15 м
Атом электрически нейтрален – абсолютное значение суммарного отрицательного заряда электронов равно положительному значению заряда ядра.
q ядра = +Z e
Слайд 21Недостатки модели атома Резерфорда
Данная модель не согласуется с наблюдаемой стабильностью
атомов. По законам классической электродинамики Максвелла вращающийся вокруг ядра электрон
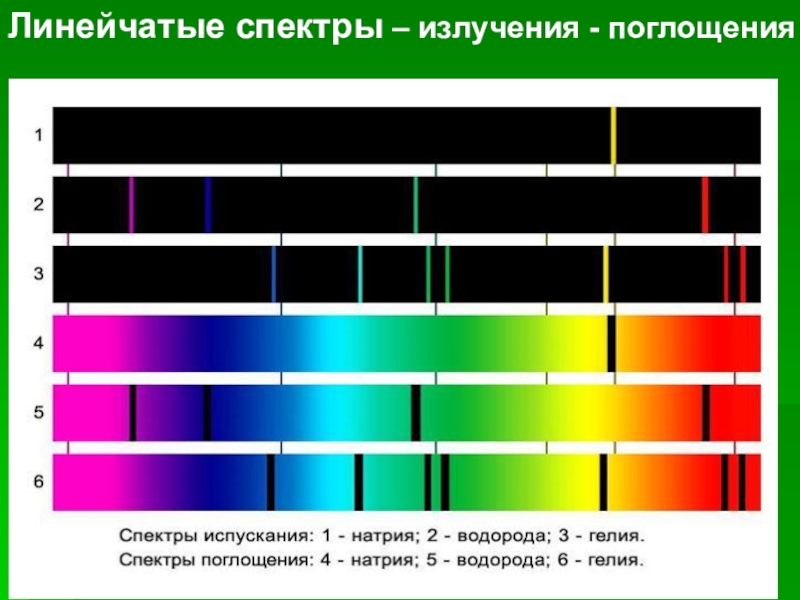
должен непрерывно излучать электромагнитные волны, а поэтому терять свою энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него.Данная модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента.
К явлениям атомных масштабов законы классической физики неприменимы.
Слайд 22 Попыткой спасения планетарной модели атома стали
постулаты
Нильса Бора
(07.10.1885 г. – 08.11.1962 г.)
Слайд 24I постулат: Атомная система может находиться только в особых стационарных
или квантовых состояниях, каждому из которых соответствует определенная энергия En.
В стационарных состояниях атом не излучает.
Слайд 25II постулат: Излучение света атомом происходит при переходе атома из
стационарного состояния с большей энергией Em в стационарное состояние с
меньшей энергией En . Энергия излученного фотона равна разности энергий стационарных состояний:h = 6,63·10–34 Дж·с – постоянная Планка,
ν – частота фотона
hν = Em – En
Слайд 26Энергетический уровень – энергия, которой обладает атомный электрон в определенном
квантовом состоянии.
Основное состояние атома – состояние с минимальной энергией.
В основном
состоянии электрон находится ближе всего к ядру и его энергия связи с ядром максимальна.Слайд 30h =h/2π =1,05*10-34 Дж – приведенная постоянная Планка;
n –
главное квантовое число;
при n =1 атом находится в основном
стационарном невозбужденном состоянииm – масса электрона, v – скорость вращения электрона по круговой орбите, r – радиус круговой орбиты, n – главное квантовое число, n ≥ 1
Слайд 32На длине окружности каждой стационарной орбиты укладывается целое число n
длин волн де Бройля ,
соответствующих движению электрона:
n- главное квантовое число
Слайд 35 Вопросы на закрепление:
1. В чём заключается
сущность модели Томсона?
2. В чём заключалась идея опыта Резерфорда?
3. Объясните
по схеме опыт Резерфорда по рассеиванию альфа-частиц.4. Объясните причину рассеивания альфа-частиц атомами вещества.
5. В чём сущность планетарной модели атома?
6. В чем противоречивость модели атома Резерфорда?
Слайд 36
Проверим себя
Минитест
1. В атоме кремния 14 электронов. Выберите правильное утверждение.
А. В ядре атома кремния 14 частиц.
Б. В ядре атома кремния 14 протонов.
В. Масса положительного иона кремния больше массы атома кремния.
Г. Среди утверждений нет правильного.
2. Существуют ли атомные ядра с зарядом меньшим, чем у одного протона? Почему?
3. Является ли нейтральным атом гелия, если вокруг его ядра обращается один электрон?
4. В ядре атом серебра 107 частиц. Вокруг ядра обращаются 47 электронов. Сколько в ядре этого атома нейтронов и протонов?
5. В результате трения стеклянной палочки о шёлк ей сообщён положительный заряд. Объясните, все ли атомы, из которых состоит заряженная палочка, нейтральны. Почему? Изменилась ли масса стеклянной палочки после сообщения ей положительного заряда? Как? Почему?
Карточка «Атом или ион»
Тест «Модели атомов»