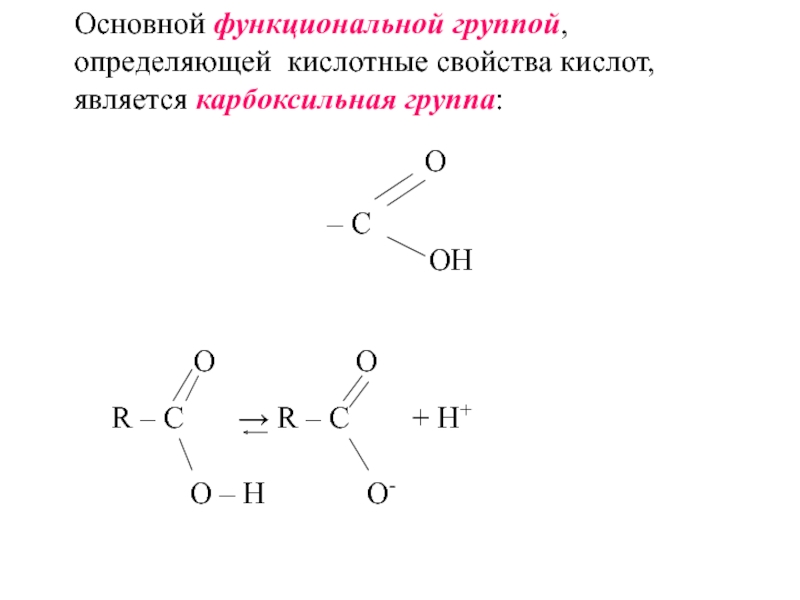
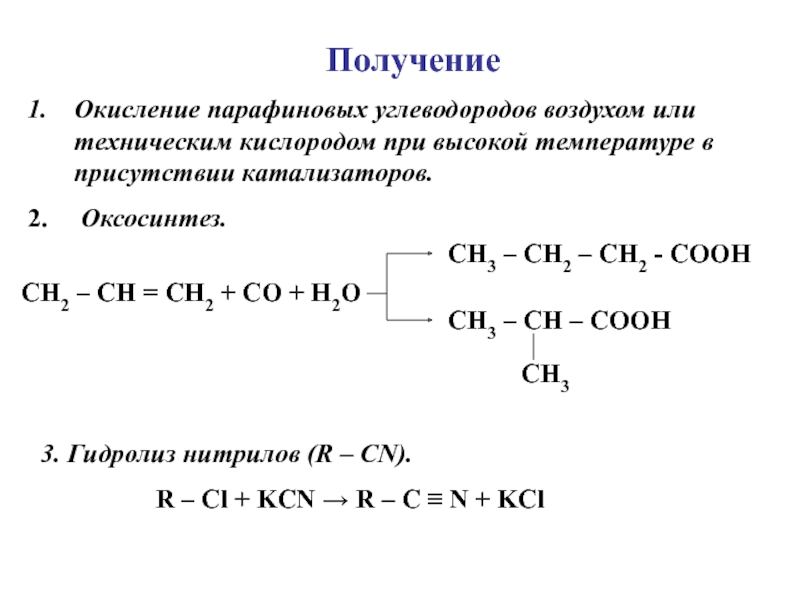
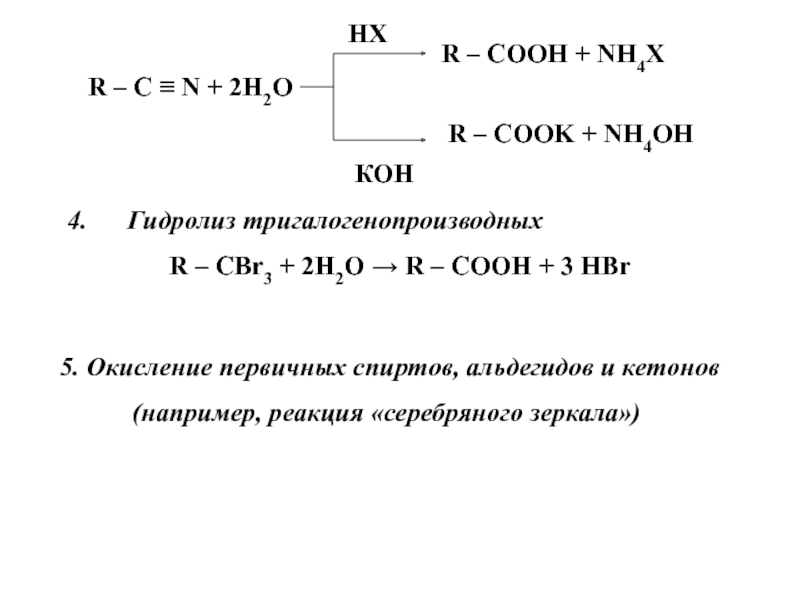
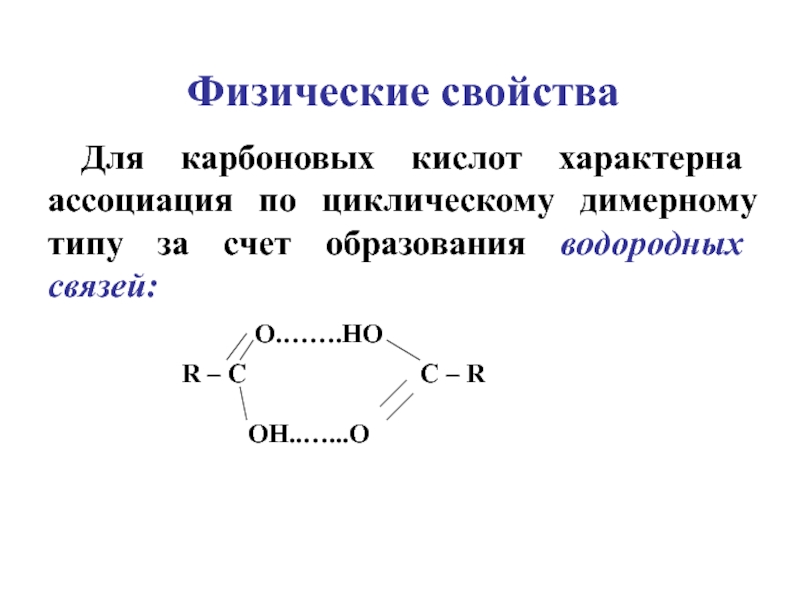
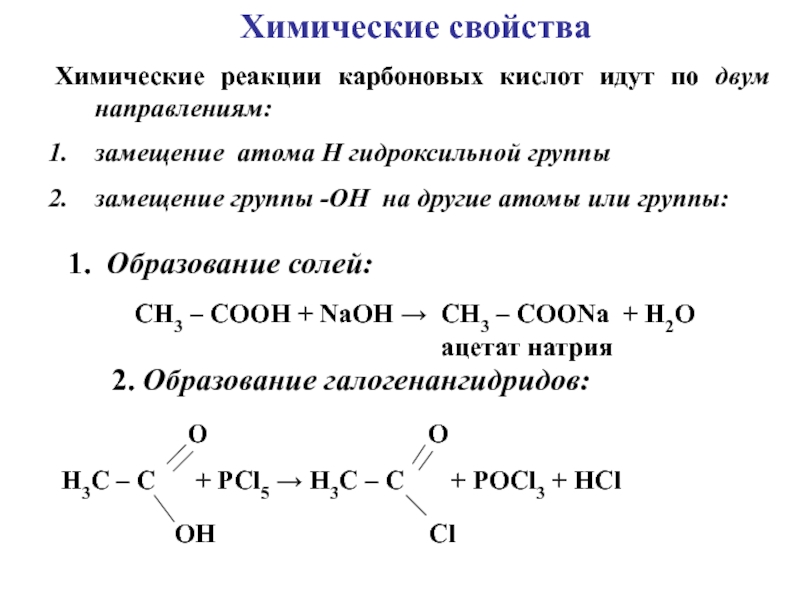
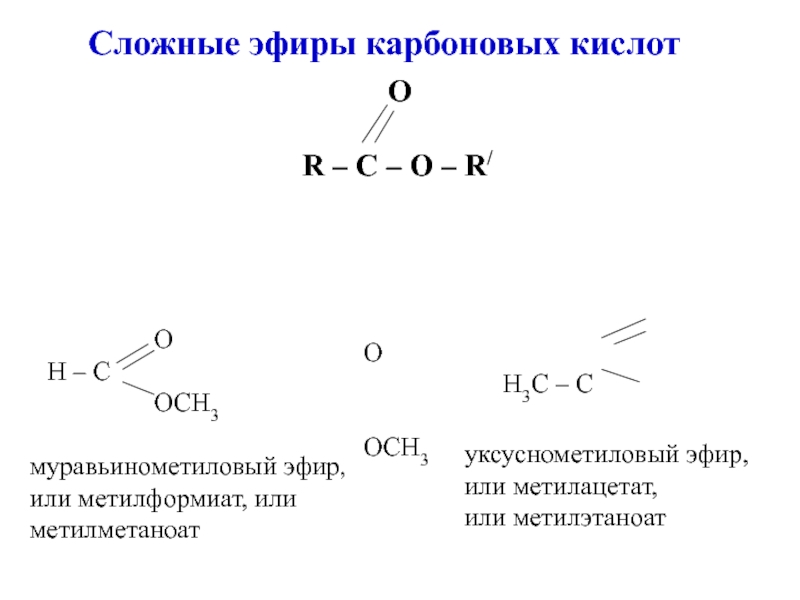
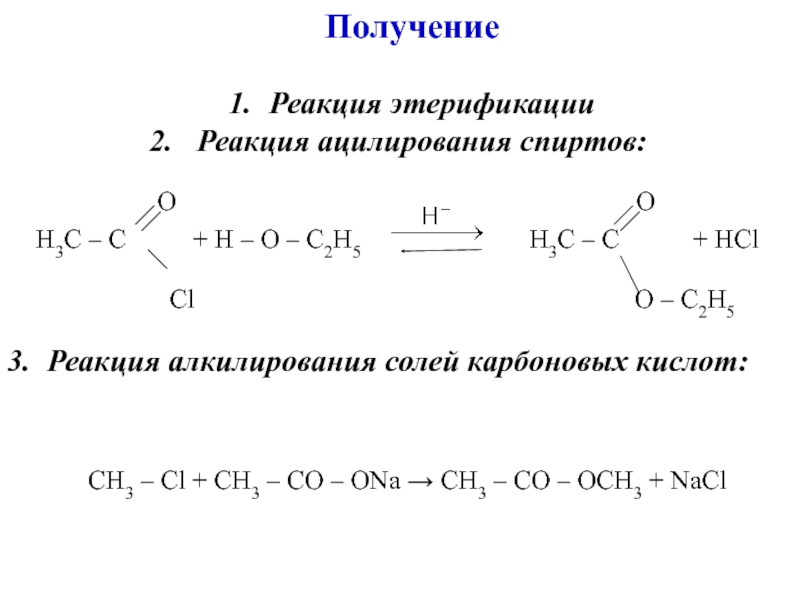
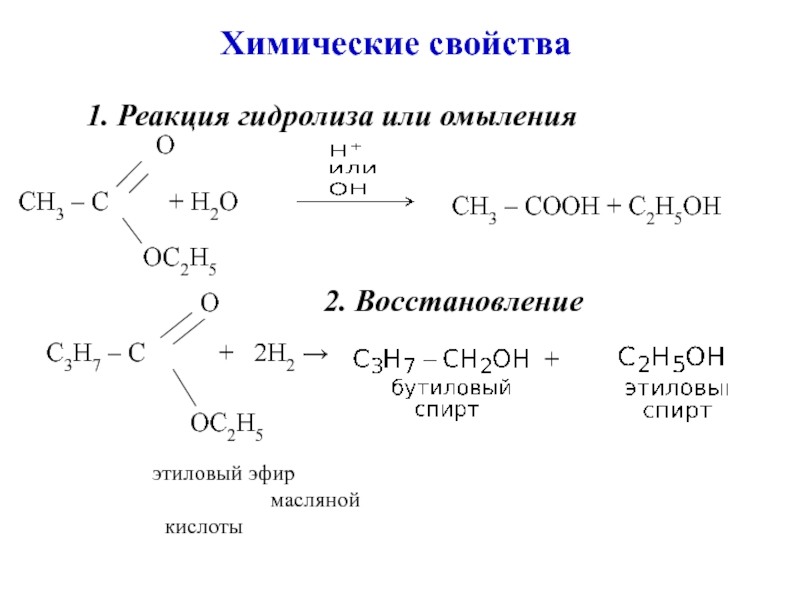
углеводородов, в молекулах которых один или несколько атомов Н замещены
на соответствующее число карбоксильных групп (– СООН).Одноосновные предельные карбоновые кислоты образуют гомологический ряд, общая формула которого CnH2n+1COOH.
Н3С – СООН
этановая
(уксусная)
кислота
НООС – СН2 – СООН
малоновая кислота