Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок в 11 классе «Основные способы получения металлов»
Содержание
- 1. Урок в 11 классе «Основные способы получения металлов»
- 2. Способы получения металлов обычно разделяют на три
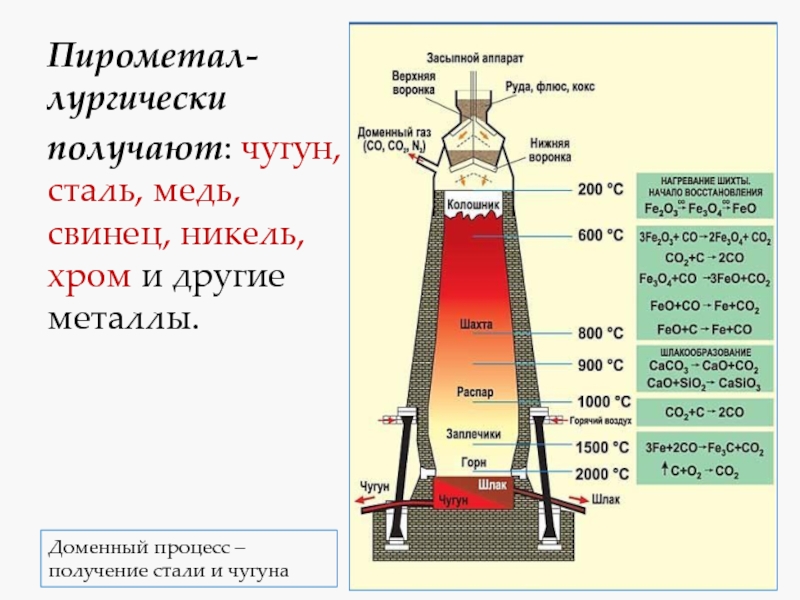
- 3. Пирометал-лургически получают: чугун, сталь, медь, свинец, никель,
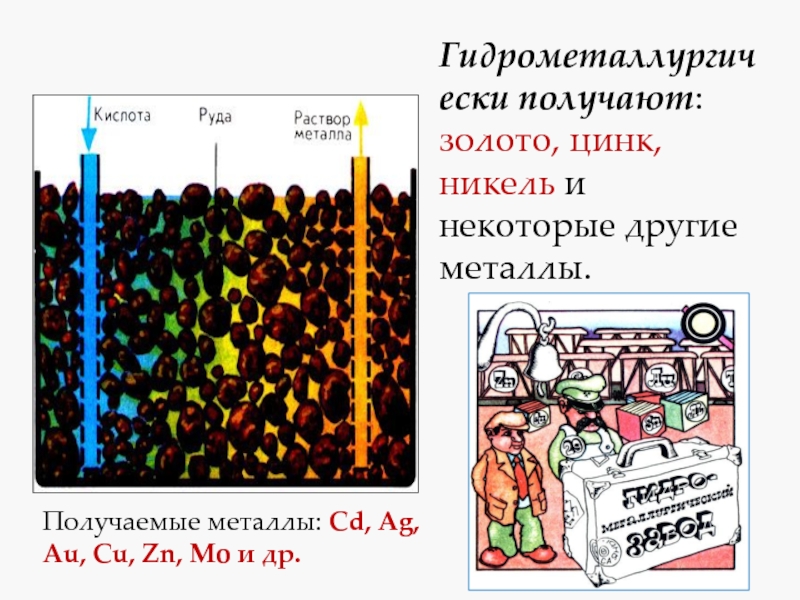
- 4. Гидрометаллургически получают: золото, цинк, никель и некоторые
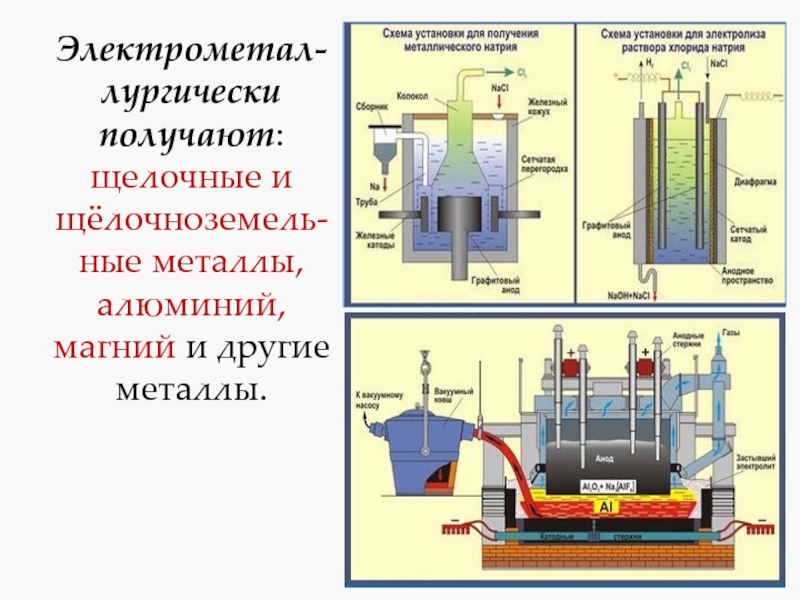
- 5. Электрометал-лургически получают: щелочные и щёлочноземель-ные металлы, алюминий, магний и другие металлы.
- 6. Общие способы получения металлов1. Восстановление металлов из оксидов
- 7. Общие способы получения металлов2. Обжиг сульфидов с последующим
- 8. Общие способы получения металлов3 Алюмотермия (в тех случаях, когда
- 9. Общие способы получения металлов4. Водородотермия - для получения металлов
- 10. Восстановление металлов электрическим током (электролиз)А) Щелочные и щелочноземельные
- 11. Восстановление металлов электрическим током (электролиз)Б) Алюминий в промышленности получают
- 12. Слайд 12
- 13. Примеры заданий по теме: «Общие способы получение
- 14. A3. Какой из металлов вытесняет медь из
- 15. А6. Для осуществления превращений в соответствии со
- 16. А8. Гидрометаллургический метод получения металлов отражает реакция:
- 17. А10. Оксид углерода (II) проявляет восстановительные свойства
- 18. В2. Установите соответствие между формулой вещества и
- 19. В3. Установите соответствие между формулой вещества и
- 20. В4. Установите соответствие между формулой вещества и
- 21. В5. Установите соответствие между формулой вещества и
- 22. В6. Верны ли следующие суждения о промышленных
- 23. В7. Установите соответствие между металлом и способом
- 24. В8. Установите соответствие между металлом и способом
- 25. В9. Установите соответствие между металлом и способом
- 26. Задания с развёрнутым ответом (С2)С1. Напишите уравнения
- 27. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Способы получения металлов
обычно разделяют на три типа:
пирометаллургические - восстановление
при высоких температурах;
электролиз раствора или расплава.Слайд 3Пирометал-лургически
получают: чугун, сталь, медь, свинец, никель, хром и другие
металлы.
Доменный процесс –
получение стали и чугуна
Слайд 4Гидрометаллургически получают: золото, цинк, никель и некоторые другие металлы.
Получаемые металлы:
Cd, Ag, Au, Cu, Zn, Mo и др.
Слайд 5Электрометал-лургически получают: щелочные и щёлочноземель-ные металлы, алюминий, магний и другие
металлы.
Слайд 6Общие способы получения металлов
1. Восстановление металлов из оксидов углем или угарным
газом
MеxOy + C = CO2 + Me,
MеxOy + C = CO + Me,
MеxOy + CO
= CO2 + Meполучают: Fe, Cu, Pb, Sn, Cd, Zn
Например,
1. ZnOy+ C t= CO + Zn
2. Fe3O4+ 4CO t= 4CO2 + 3Fe
3. MgO + C t= Mg + CO
Не подходит для металлов, образующих карбиды с углём.
Слайд 7Общие способы получения металлов
2. Обжиг сульфидов с последующим восстановлением (если металл
находится в руде в виде соли или основания, то последние
предварительно переводят в оксид)1 стадия –
MеxSy+O2 = MеxOy+SO2
2 стадия –
MеxOy + C = CO2 + Me или
MеxOy + CO = CO2 + Me
Например,
1. 2ZnS + 3O2 t= 2ZnO + 2SO2↑
2. MgCO3 t= MgO + CO2↑
Слайд 8Общие способы получения металлов
3 Алюмотермия (в тех случаях, когда нельзя восстановить углём
или угарным газом из-за образования карбида или гидрида)
MеxOy + Al =
Al2O3 + Meполучают: Mn, Cr, Ti, Mo, W, V и др
Например,
1. 4SrO + 2Al t= Sr(AlO2)2 + 3Sr
2. 3MnO2 + 4Al t= 3Mn + 2Al2O3
3. 2Al + 3BaO t= 3Ba + Al2O3 (получают барий высокой чистоты)
Слайд 9Общие способы получения металлов
4. Водородотермия - для получения металлов особой чистоты
MеxOy + H2 =
H2O + Me
Получают металлы большей чистоты: Cu, Ni, W, Fe,
Mo, Cd, PbНапример,
1. WO3 + 3H2 t= W + 3H2O↑
2. MoO3 + 3H2 t= Mo + 3H2O↑
Слайд 10Восстановление металлов электрическим током (электролиз)
А) Щелочные и щелочноземельные металлы получают в промышленности
электролизом расплавов солей (хлоридов):
2NaCl расплав, электр. ток. 2 Na + Cl2↑
CaCl2 расплав, электр. ток.
Ca + Cl2↑расплавов гидроксидов:
4NaOH расплав, электр. ток. 4Na + O2↑ + 2H2O
(!!! используют изредка для Na)
Слайд 11Восстановление металлов электрическим током (электролиз)
Б) Алюминий в промышленности получают в результате электролиза
расплава оксида алюминия в криолите Na3AlF6 (из бокситов):
2Al2O3 расплав в криолите, электр.
ток. 4Al + 3 O2↑В) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO4+2H2O раствор, электр. ток. 2Cu + O2 + 2H2SO4
Слайд 13Примеры заданий по теме: «Общие способы получение металлов»
Задания с выбором
ответа ( А10, А24, А29).
А1. Реакция возможна между
1) Ag и K2SO4 (р-р)2) Zn и KCl (р-р)
3) Mg и SnCl2 (р-р)
4) Ag и CuSO4 (р-р)
А2. Какой из металлов вытесняет железо из сульфата железа (II)?
1) Cu 2) Zn 3) Sn 4) Hg
Слайд 14A3. Какой из металлов вытесняет медь из сульфата меди (II)?
1) Zn 2) Ag
3) Hg 4) AuA4. Формула вещества, восстанавливающего оксид меди (II) - это
1) CO2 2) H2 3) HNO3 4) Cl2
A5. Формула вещества, не восстанавливающего оксид железа (III) -
1) HCl 2) Al 3) H2 4) C
Слайд 15А6. Для осуществления превращений в соответствии со схемой:
Al(OH)3 → AlCl3 → Al необходимо последовательно
использовать1) хлор и водород
2) хлорид натрия и водород
3) хлороводород и цинк
4) соляную кислоту и калий
А7. Пирометаллургический метод получения металлов отражает реакция:
1) HgS + O2 → Hg + SO2
2) CuSO4 + Fe → FeSO4 + Cu
3) 2NaCl (ток)→ 2Na + Cl2
4) CuSO4 + Zn → ZnSO4 + Cu
Слайд 16А8. Гидрометаллургический метод получения металлов отражает реакция:
1) HgS + O2 → Hg + SO2
2) CuSO4 + Fe → FeSO4 + Cu 3) 2NaCl (ток)→ 2Na + Cl2
4) AlCl3 + 3K → Al + 3KCl
А9. В качестве восстановителя при выплавке железа в промышленности
наиболее часто используют
1) водород
2) алюминий
3) натрий
4) кокс
Слайд 17А10. Оксид углерода (II) проявляет восстановительные свойства при нагревании с
1) N2 2) H2S
3) Fe 4) Fe2O3Задания с кратким ответом (В3)
В1. При электролизе раствора AgNO3 на катоде выделяется
1) серебро
2) водород
3) серебро и водород
4) кислород и водород
Слайд 18В2. Установите соответствие между формулой вещества и продуктом электролиза его
водного раствора
ФОРМУЛА ВЕЩЕСТВА
ПРОДУКТЫ ЭЛЕКТРОЛИЗАВОДНОГО РАСТВОРА
А) AgF 1) Ag, F2
Б) NaNO3 2) Ag, O2, HF
B) Pb(NO3)2 3) H2, O2
Г) NaF 4) Pb, O2, HNO3
5) H2, NO2, O2
6) NaOH, H2, F2
Слайд 19В3. Установите соответствие между формулой вещества и продуктом электролиза его
водного раствора
ФОРМУЛА ВЕЩЕСТВА
ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА ВОДНОГО РАСТВОРАА) HgCl2 1) металл, хлор
Б) AlCl3 2) водород, хлор, гидроксид
В) Hg(ClO4)2 металла
Г) Na2SO3 3) водород, кислород
4) металл, кислород, кислота
5) металл, сернистый газ
6) водород, сернистый газ
Слайд 20В4. Установите соответствие между формулой вещества и продуктом электролиза его
водного раствора
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
ВОДНОГО РАСТВОРАА) нитрат цинка 1) цинк, кислород, азотная кислота
Б) бромид цинка 2) водород, кислород
В) бромид калия 3) водород, оксид азота (IV)
Г) нитрат калия 4) цинк, бром
5) водород, бром, гидроксид калия
6) калий, бром
7) калий, оксид азота (IV)
Слайд 21В5. Установите соответствие между формулой вещества и продуктом электролиза его
водного раствора, образующимся на като-де
ФОРМУЛА ВЕЩЕСТВА
ПРОДУКТЫ ЭЛЕКТРОЛИЗАВОДНОГО РАСТВОРА
А) Li2SO4 1) H2
Б) Ba(OH)2 2) O2
В) MgCl2 3) Cl2
Г) SnCl2 4) Li
5) Ba
6) Mg
7) Sn
Слайд 22В6. Верны ли следующие суждения о промышленных способах получения металлов?
А. В основе пирометаллургии лежит процесс восстановления металлов из руд
при высоких температурах.Б. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Слайд 23В7. Установите соответствие между металлом и способом его
электролитического получения.
МЕТАЛЛ
ЭЛЕКТРОЛИЗА) натрий 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) серебро 3) расплава поваренной соли
Г) медь 4) расплавленного оксида
5) раствора оксида в расплав-
ленном криолите
6) расплавленного нитрата
Слайд 24В8. Установите соответствие между металлом и способом его электролитического получения.
МЕТАЛЛ
ЭЛЕКТРОЛИЗА) калий 1) расплавленного нитрата
Б) магний 2) водного раствора гидроксида
В) медь 3) расплава хлорида
Г) свинец 4) расплавленного оксида
5) раствора оксида в расплавленном криолите
6) водного раствора солей
Слайд 25В9. Установите соответствие между металлом и способом его электролитического получения.
МЕТАЛЛ
ЭЛЕКТРОЛИЗА) хром 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) литий 3) расплава соли
Г) барий 4) расплавленного оксида
5) раствора оксида в расплав-
ленном криолите
6) расплавленного нитрата
Слайд 26Задания с развёрнутым ответом (С2)
С1. Напишите уравнения реакций, с помощью
которых можно осуществить превращения:
Cu → Cu(NO3)2
→ Cu(OH)2 → Х → Сu → CuSO4Укажите условия протекания реакций.
C2. Даны вещества: алюминий, оксид марганца (IV), водный раствор сульфата меди и концентрированная соляная кислота.
Напишите уравнения четырёх возможных реакции между этими веществами.