Слайд 1Векторы клонирования в бактериях
Лекция №2
Лектор:
Давыдова Ольга Константиновна, к.б.н., доцент
Слайд 2План лекции:
Способы введения рекомбинантных ДНК в клетку:
Векторы для переноса измененного
генетического материала. Требования к векторной ДНК, её свойства.
Гены-маркеры.
Типы
векторов: бактериальные плазмиды, вирусы, искусственные хромосомы.
Трансформация.
Электропорация.
Микроинъекция.
Упаковка в липосомы.
Электронная пушка.
Скрининг бактериальных клонов
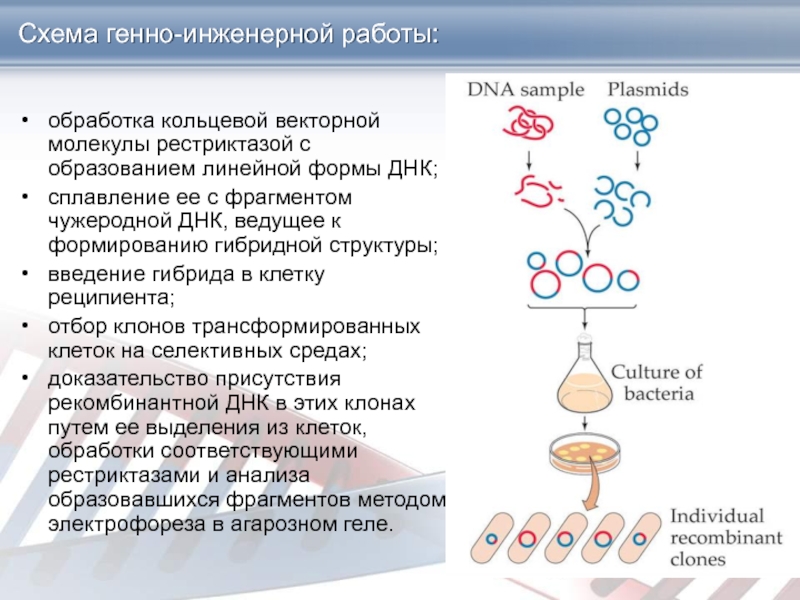
Слайд 3Схема генно-инженерной работы:
обработка кольцевой векторной молекулы рестриктазой с образованием линейной
формы ДНК;
сплавление ее с фрагментом чужеродной ДНК, ведущее к формированию
гибридной структуры;
введение гибрида в клетку реципиента;
отбор клонов трансформированных клеток на селективных средах;
доказательство присутствия рекомбинантной ДНК в этих клонах путем ее выделения из клеток, обработки соответствующими рестриктазами и анализа образовавшихся фрагментов методом электрофореза в агарозном геле.
Слайд 4Введение рекомбинантных ДНК в клетку
используя векторы или
путем прямого введения.
Векторы
- автономно реплицирующиеся молекулы ДНК, которые обеспечивают размножение и работу
встроенного в них определённого гена.
Слайд 5Свойства векторной ДНК
1) способностью автономно реплицироваться в клетке-реципиенте, то есть
быть самостоятельным репликоном;
2) содержать один или несколько маркерных генов, благодаря
экспрессии которых у клетки-реципиента появляются новые признаки, позволяющие отличить трансформированные клетки от исходных;
3) содержать по одному или, самое большее, по два участка (сайта) для различных рестриктаз в разных районах (в том числе в составе маркерных генов), но не в области, ответственной за их репликацию.
Слайд 6Классификация векторов
В качестве прокариотических векторов используются плазмиды, бактериофаги;
в качестве
эукариотических векторов применяют вирусы животных и растений, векторы на основе
2 мкм дрожжей,
а также ряд искусственно сконструированных векторов, способных реплицироваться как в бактериальных, так и в эукариотических клетках (челночные векторы).
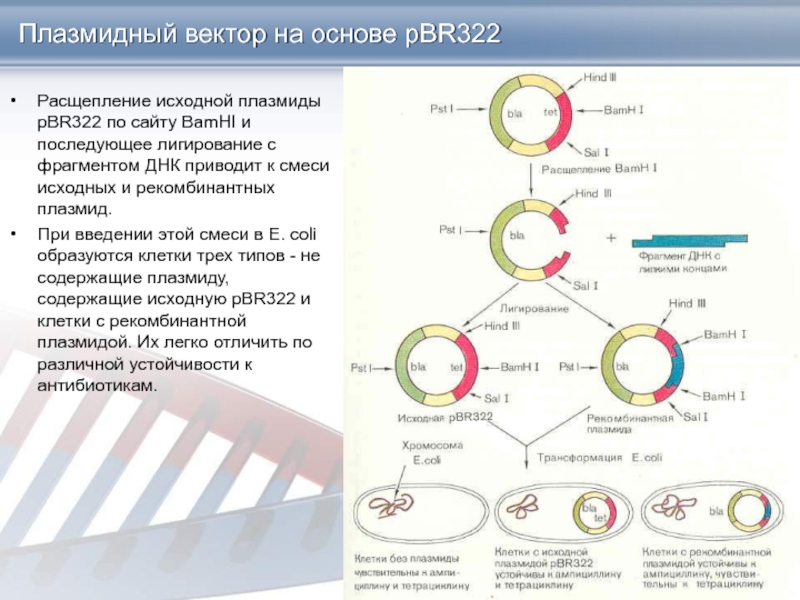
Слайд 8Плазмидный вектор на основе pBR322
В гене tet (тетрациклин) находятся уникальные
участки расщепления рестриктазами Hindlll, BamHI и Sail, а в гене
bla (ампициллин) - участок расщепления Pstl.
Если "разрезать" плазмиду любой из рестриктаз, участок расщепления которой находится в гене tet, и соединить ее методом липких концов с чужеродным фрагментом ДНК, то в полученной рекомбинантной молекуле останется нетронутым только ген blа, а ген tet утрачивает свою активность, поскольку его последовательность разрывается вставкой.
Наоборот, при разрезании плазмиды рестриктазой PstI и внедрении в этот участок фрагмента ДНК инактивируется ген bla тогда как ген tet продолжает обеспечивать синтез белка, придающего Е. coli устойчивость к тетрациклину.
Использование такой методологии позволяет быстро идентифицировать клетки, содержащие рекомбинантные плазмиды.
Слайд 9Плазмидный вектор на основе pBR322
Расщепление исходной плазмиды pBR322 по сайту
BamHI и последующее лигирование с фрагментом ДНК приводит к смеси
исходных и рекомбинантных плазмид.
При введении этой смеси в Е. coli образуются клетки трех типов - не содержащие плазмиду, содержащие исходную pBR322 и клетки с рекомбинантной плазмидой. Их легко отличить по различной устойчивости к антибиотикам.
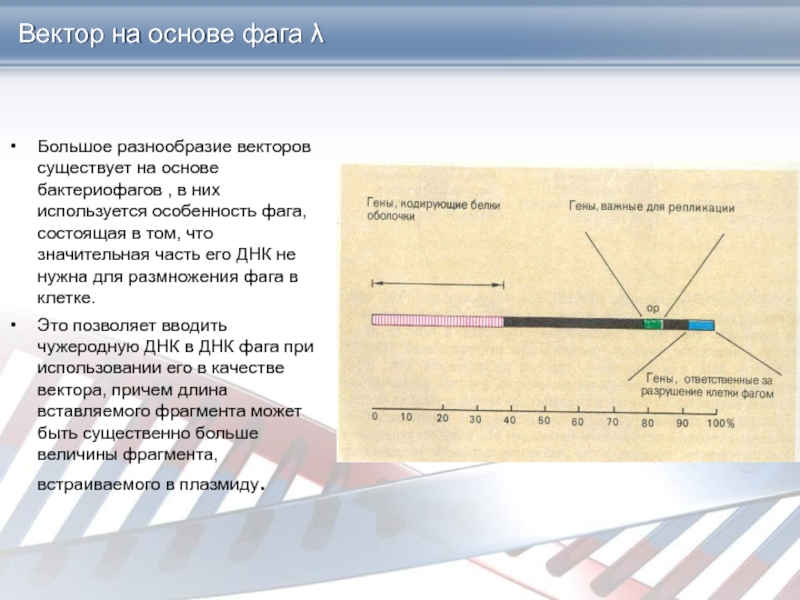
Слайд 11Вектор на основе фага λ
Большое разнообразие векторов существует на основе
бактериофагов , в них используется особенность фага, состоящая в том,
что значительная часть его ДНК не нужна для размножения фага в клетке.
Это позволяет вводить чужеродную ДНК в ДНК фага при использовании его в качестве вектора, причем длина вставляемого фрагмента может быть существенно больше величины фрагмента, встраиваемого в плазмиду.
Слайд 12Вектор на основе фага М13
Нитевидные бактериофаги, такие, как М13, fd
и fl. Фаг М13 представляет собой одноцепочечную циклическую ДНК длиной
около 6407 нуклеотидов. После инфицирования бактериальной клетки одно цепочечная ДНК фага превращается в двухцепочечную репликативную форму (RF), которая во всех отношениях подобна плазмиде. Кроме того, фаговая ДНК содержит короткий участок (500 нуклеотидов), названный межгенной последовательностью (МП или IR), несущественный для ее жизнеспособности.
Таким образом, выделив репликативную форму ДНК и расщепив ее в области несущественного участка, можно с помощью лигазы вставить в место разрыва чужеродную ДНК.
Введение рекомбинантной двухцепочечной молекулы в клетку Е. coli приводит к ее репликации, синтезу (+) -цепи, упаковке последней в белковый чехол и выделению фага в среду.
Далее инфицированная нитевидным фагом клетка, продолжая делиться, хотя и с замедленной скоростью, постепенно выделяет в окружающую среду большое количество фага (200-300 копий на клетку). Этот фаг содержит в вирионе одноцепочечную циклическую ДНК, в которую встроена одна из цепей чужеродной ДНК.

Слайд 14Космиды
В ДНК нормальных фаговых частиц cos-сайты расположены на концах молекул,
они разделяют мономеры фаговой ДНК в конкатемерах, объединяющих несколько соединенных
"голова к хвосту" мономеров, которые являются предшественниками зрелых фаговых ДНК перед упаковкой в фаговые частицы. В процессе упаковки cos-сайты узнаются компонентами ферментативной системы и по ним происходит последовательное отрезание упакованной в фаговую частицу лямбда-ДНК.
Последовательность нуклеотидов лямбда-ДНК, расположенная между двумя cos-сайтами, которая заключает в себе весь фаговый геном (35-45 т.п.о.), может быть замещена in vitro на аналогичный по длине фрагмент чужеродной ДНК и упакована в фаговые частицы. Такая искусственная фаговая частица оказывается нежизнеспособной. Однако после адсорбции химерной фаговой частицы на поверхности бактериальной клетки заключенная в ней ДНК проникает (вводится фаговой частицей) внутрь бактерии и начинает автономно реплицироваться как плазмида, размер которой составляет 30-40 т.п.о. Поскольку такая плазмида (космида) содержит в своем составе селектируемые маркеры в виде генов устойчивости к антибиотикам, ее поддерживают в бактериальных клетках путем выращивания бактерий на среде с соответствующими антибиотиками.

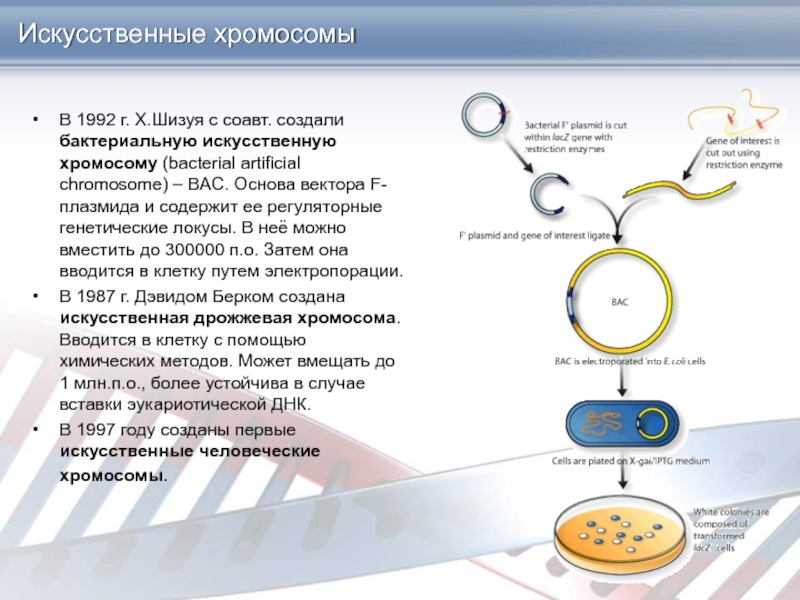
Слайд 15Искусственные хромосомы
В 1992 г. Х.Шизуя с соавт. создали бактериальную искусственную
хромосому (bacterial artificial chromosome) – BAC. Основа вектора F-плазмида и
содержит ее регуляторные генетические локусы. В неё можно вместить до 300000 п.о. Затем она вводится в клетку путем электропорации.
В 1987 г. Дэвидом Берком создана искусственная дрожжевая хромосома. Вводится в клетку с помощью химических методов. Может вмещать до 1 млн.п.о., более устойчива в случае вставки эукариотической ДНК.
В 1997 году созданы первые искусственные человеческие хромосомы.
Слайд 16Векторы на основе вируса SV-40
Примером вирусов, применяемых в качестве векторов,
является вирус SV-40, геном которого представляет собой циклическую ДНК длиной
5243 нуклеотидных оснований с полностью известной последовательностью.
Эукариотические векторы, использующие вирусы, способные формировать вирионы, обладают тем недостатком, что они убивают клетку-хозяина при своем размножении так же как и бактериофаги. Поэтому постоянно делаются попытки разработать векторы, подобные плазмидам. Обычно опухолевые вирусы, в том числе и SV-40, внедряют свою ДНК в хромосому клетки-хозяина. Однако вирус бычьей папилломы в трансформированных клетках существует в виде эписомы (около 100 копий на клетку) и используется в качестве основы для создания эписомных векторов.
Эписома - плазмида, способная существовать в бактериальной клетке как автономно, так и в составе хромосомы. Классические примеры эписом – R-плазмида и F-фактор.
Слайд 17Векторы на основе плазмид агробактерий
Наибольшее развитие получили векторы, сконструированные на
так называемых Ti-плазмидах бактерий Agrobacterium tumefaciens. Эти бактерии инфицируют двудольные
растения и вызывают образование корончатых галлов - своеобразных опухолей растений, клетки которых способны размножаться в культуре без добавления факторов роста.
Было показано, что такая трансформация является следствием внедрения в геном растения части ДНК-tumor-inducing) -плазмиды, получившей название Т (transforming)-ДНК. Трансформированные клетки приобретают способность синтезировать необычные аминокислоты - опины, например, нопалин или октопин, являющиеся производными аргинина и служащие источником питания A. tumefaciens. Какая именно аминокислота синтезируется, зависит от Ti-плазмиды, трансформировавшей клетку: одни бактерии A. tumefaciens несут октопиновые, а другие - нопалиновые плазмиды. И опухолевая трансформация, и синтез опинов вызваны Т-ДНК.
В Т-ДНК содержится несколько генов, контролируемых отдельными промоторами, которые и определяют все свойства опухолевых клеток. Трансформация клеток Т-ДНК стабильно наследуется; некоторые трансформированные культуры существуют без изменения уже более 20 лет. Интегрированная Т-ДНК наследуется по законам Г. Менделя.

Слайд 18Клонирование в дрожжах
Наиболее широко используются штаммы Saccharomyces cerevisiae. Работа с
дрожжами облегчается тем, что, подобно бактериям, они могут расти в
жидкой среде и давать колонии на твердой, генетически хорошо охарактеризованы и имеют сравнительно короткое время генерации.
S. cerevisiae содержит плазмиду Scpl, представляющую собой циклическую молекулу длиной 2 мкм. Ее гибриды с плазмидами Е. coli обычно и используют в качестве векторов.
Селекция дрожжевых клонов, трансформированных такими рекомбинантными плазмидами, основана на применении в качестве клеток-хозяев определенных мутантов, не способных расти на среде, лишенной какого-либо питательного компонента. Векторная плазмида, в свою очередь, содержит ген или гены, которые при попадании в клетку придают ей этот недостающий признак. Трансформанты легко отбираются по их способности давать колонии на обедненной среде.
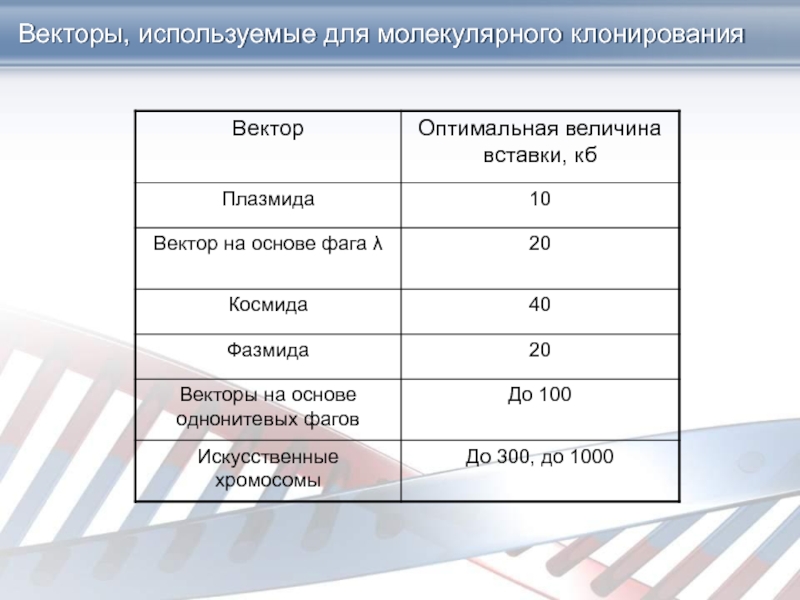
Слайд 19Векторы, используемые для молекулярного клонирования
Слайд 20Трансформация
- процесс поглощения экзогенной ДНК бактериальными клетками, сопровождающийся приобретением ими
новых генетических маркеров.
Частоту трансформации клеток E. coli можно повысить
разными способами: холодовым шоком, введением в инкубационную смесь одновалентных катионов (Rb+), хлорида гексаминкобальта(III) или выращиванием на среде с повышенным содержанием ионов Mg2+ (10-20 мМ).
Трансформация у дрожжей может быть осуществлена только искусственным путем. Для этой цели используют протопласты или обрабатывают клетки солями щелочных металлов. ДНК проникает в дрожжевые протопласты также под действием электрических разрядов (электропорация).
Трансформация клеток млекопитающих осуществима только искусственно в результате микроинъекций чужеродной ДНК в ядра эмбрионов, соматических клеток или путем поглощения ДНК клетками в культуре тканей. Чаще всего ДНК добавляют к смеси р-ра СаСl2 и фосфатного буфера.
Клетки растений не способны поглощать ДНК. При трансформации клеток двудольных растений используют регенерирующие протопласты, поглощающие свободную ДНК и ДНК, заключенную в липосомы.
Слайд 21Трансформация
включает необратимую адсорбцию ДНК клетки-донора (например, выделяемую в среду в
результате лизиса клеток) на поверхности клетки-реципиента. У большинства бактерий адсорбироваться
может ДНК любого происхождения.
Адсорбция осуществляется на специальных рецепторах, где ДНК связывается с особыми белками и "втягивается" в клетку.
При этом одна из нитей ДНК разрушается благодаря нуклеазной активности связывающих ДНК белков, и в клетку поступает уже однонитевая ДНК.
Она тут же обволакивается молекулами белков, которые защищают ДНК от клеточных экзонуклеаз и способствуют ее контакту с хромосомой, а затем рекомбинации с ней.
Поглощение экзогенной ДНК в процессе трансформации и трансфекции может осуществляться лишь компетентными клетками .
Слайд 22Компетентность
- состояние бактериальных клеток, при котором они способны сорбировать экзогенную
ДНК на своей поверхности и поглощать ее, после чего экзогенная
ДНК может быть интегрирована в бактериальную хромосому или существовать в виде внехромосомного элемента.
Состояние компетентности наступает в определенный период жизненного цикла (конец фазы роста). Развитие компетентности может идти по "каскадному" типу: клетки, ставшие компетентными, выделяют в среду низкомол. белок (фактор компетентности), который, адсорбируясь на др. клетках, делает их также компетентными.
Для многих грамположительных бактерий компетентность является естественным свойством.
У грамотрицательных клеток E. coli естественная компетентность отсутствует и клетки приобретают ее лишь в искусственных условиях. Установлено, что при низких температурах и в присутствии двухвалентных катионов клетки E. coli и экзогенная ДНК продуктивно взаимодействуют друг с другом и экзогенная ДНК может с высокой эффективностью проникать внутрь бактериальных клеток.
Слайд 23Электропорация
основана на том, что импульсы высокого напряжения обратимо увеличивают проницаемость
биомембран. Через среду, содержащую клетки и фрагменты ДНК, пропускают высоковольтные
кратковременные импульсы, приводящие к образованию пор в цитоплазматической мембране, время существования и размер которых достаточны для проникновения ДНК из среды в результате действия осмотических сил. При этом объем клетки увеличивается.
В оптимальных условиях электропорации количество трансформантов может достигать 80% выживших клеток.
Электропорирующий эффект зависит от радиуса кривизны клетки. Поэтому мелкие бактериальные клетки эффективно поглощают ДНК при значительно большей напряженности (10 кВ/см и более), чем крупные животные и растительные клетки, эффективно поглощающие ДНК при напряженности поля 1—2 кВ/см.
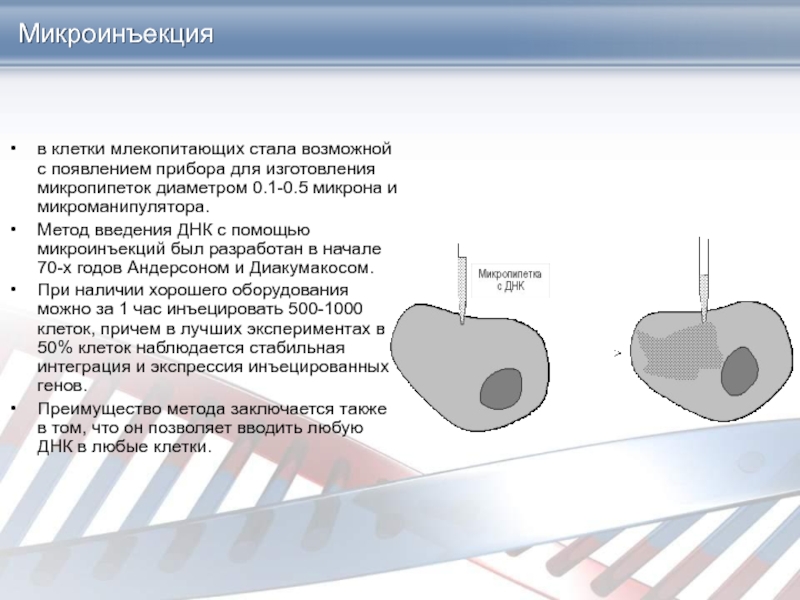
Слайд 24Микроинъекция
в клетки млекопитающих стала возможной с появлением прибора для изготовления
микропипеток диаметром 0.1-0.5 микрона и микроманипулятора.
Метод введения ДНК с помощью
микроинъекций был разработан в начале 70-х годов Андерсоном и Диакумакосом.
При наличии хорошего оборудования можно за 1 час инъецировать 500-1000 клеток, причем в лучших экспериментах в 50% клеток наблюдается стабильная интеграция и экспрессия инъецированных генов.
Преимущество метода заключается также в том, что он позволяет вводить любую ДНК в любые клетки.
Слайд 25Липосомы
используются для защиты экзогенного генетического материала от разрушающего действия рестриктаз.
Липосомы - сферические оболочки, состоящие из фосфолипидов. Получают их путем
резкого встряхивания смеси водного раствора и липидов, либо обрабатывая ультразвуком водные эмульсии фосфолипидов.
Липосомы, состоящие из фосфатидилсерина и холестерина наиболее пригодны для введения ДНК в клетки животных и растений. Системы переноса с помощью липосом низкотоксичны по отношению к клеткам.
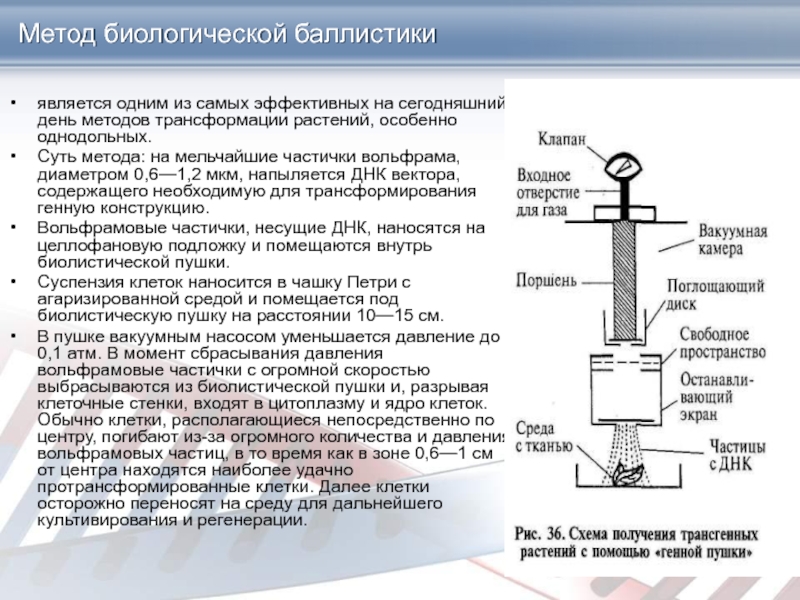
Слайд 26Метод биологической баллистики
является одним из самых эффективных на сегодняшний день
методов трансформации растений, особенно однодольных.
Суть метода: на мельчайшие частички
вольфрама, диаметром 0,6—1,2 мкм, напыляется ДНК вектора, содержащего необходимую для трансформирования генную конструкцию.
Вольфрамовые частички, несущие ДНК, наносятся на целлофановую подложку и помещаются внутрь биолистической пушки.
Суспензия клеток наносится в чашку Петри с агаризированной средой и помещается под биолистическую пушку на расстоянии 10—15 см.
В пушке вакуумным насосом уменьшается давление до 0,1 атм. В момент сбрасывания давления вольфрамовые частички с огромной скоростью выбрасываются из биолистической пушки и, разрывая клеточные стенки, входят в цитоплазму и ядро клеток. Обычно клетки, располагающиеся непосредственно по центру, погибают из-за огромного количества и давления вольфрамовых частиц, в то время как в зоне 0,6—1 см от центра находятся наиболее удачно протрансформированные клетки. Далее клетки осторожно переносят на среду для дальнейшего культивирования и регенерации.
Слайд 27Маркерные гены
Можно выделить 2 группы маркерных генов, позволяющие отличить трансформированные
клетки:
1. Селективные гены, отвечающие за устойчивость к антибиотикам (канамицину,
тетрациклину, неомицину и др.), гербицидам (у растений). Это могут быть гены ауксотрофности по какому-либо субстрату и т.д. Основной принцип работы такого маркера – способность трансформированных клеток расти на селективной питательной среде, с добавкой определенных веществ, ингибирующих рост и деление нетрансформированных, нормальных клеток.
2. Репортерные гены, кодирующие нейтральные для клеток белки, наличие которых в тканях может быть легко тестировано. В качестве репортерных используются гены β-глюкуронидазы (GUS), зеленого флюоресцентного белка (GFP), люциферазы (LUC/LUX), хлорамфениколацетилтрансферазы (CAT).
Слайд 28Селективные гены
Селекция возможна, если в векторной молекуле предусмотрена специальная фенотипическая
система селекции.
Например, если векторная молекула несёт гены устойчивости к антибиотикам,
то на среде с определённым антибиотиком будут расти только клетки трансформантов. Если в векторе содержатся гены устойчивости к 2-м антибиотикам, то при встройке фрагмента ДНК в один из таких генов, клоны клеток содержащих такие гибридные молекулы легко отличить от трансформатов несущих исходные молекулы ДНК на средах с каждым антибиотиком в отдельности.
Плазмида pBR322 E.coli обуславливает устойчивость к ампицилину и тетрациклину
Встройка экзогенного фрагмента ДНК
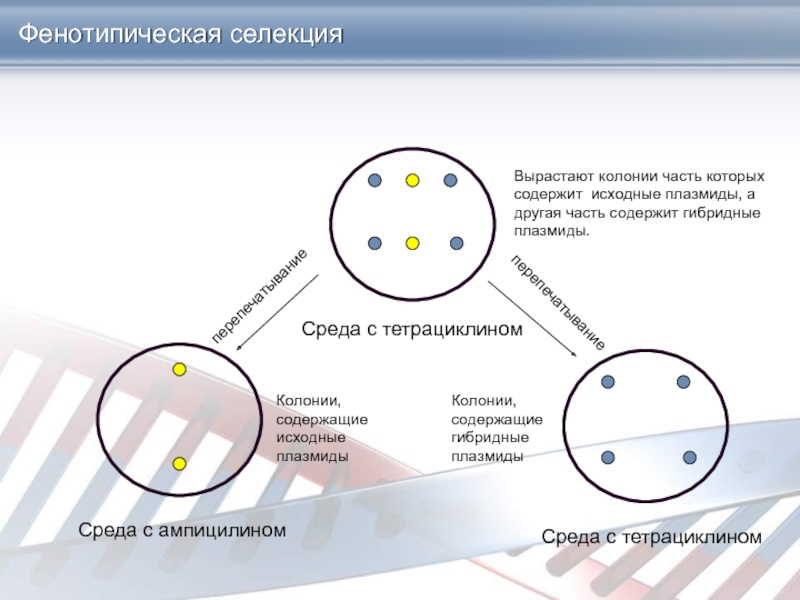
Слайд 29Среда с тетрациклином
Среда с тетрациклином
Среда с ампицилином
перепечатывание
перепечатывание
Вырастают колонии часть которых
содержит исходные плазмиды, а другая часть содержит гибридные плазмиды.
Колонии, содержащие
исходные плазмиды
Колонии, содержащие гибридные плазмиды
Фенотипическая селекция
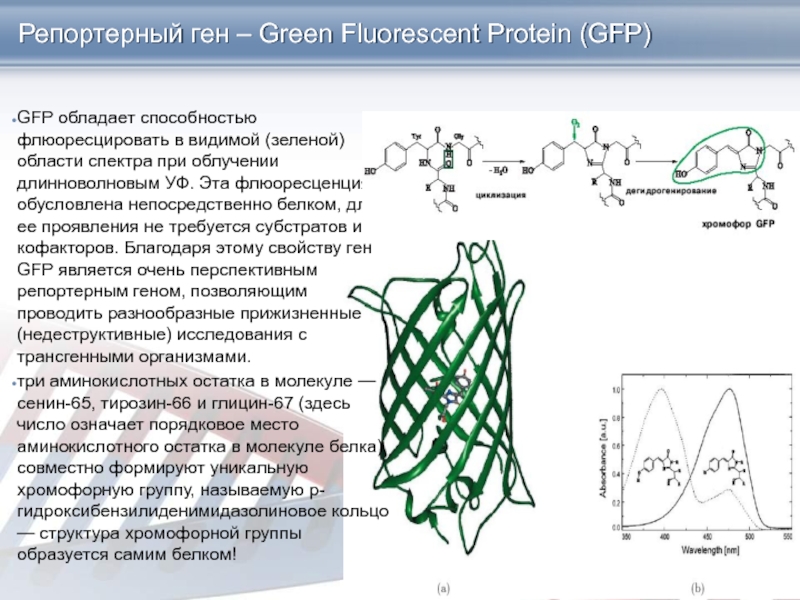
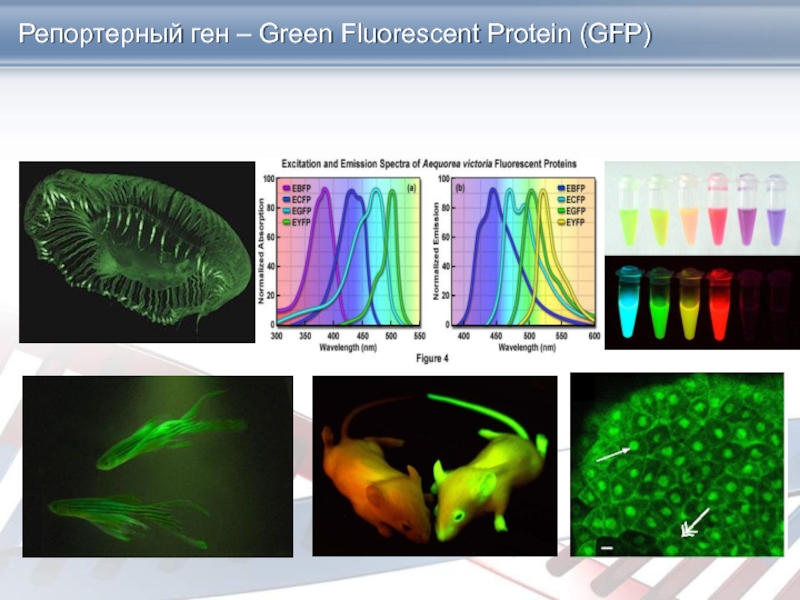
Слайд 30GFP обладает способностью флюоресцировать в видимой (зеленой) области спектра при
облучении длинноволновым УФ. Эта флюоресценция обусловлена непосредственно белком, для ее
проявления не требуется субстратов или кофакторов. Благодаря этому свойству ген GFP является очень перспективным репортерным геном, позволяющим проводить разнообразные прижизненные (недеструктивные) исследования с трансгенными организмами.
три аминокислотных остатка в молекуле — сенин-65, тирозин-66 и глицин-67 (здесь число означает порядковое место аминокислотного остатка в молекуле белка) совместно формируют уникальную хромофорную группу, называемую p-гидроксибензилиденимидазолиновое кольцо — структура хромофорной группы образуется самим белком!
Репортерный ген – Green Fluorescent Protein (GFP)
Слайд 31Репортерный ген – Green Fluorescent Protein (GFP)