Слайд 1VI Регуляция клеточного деления
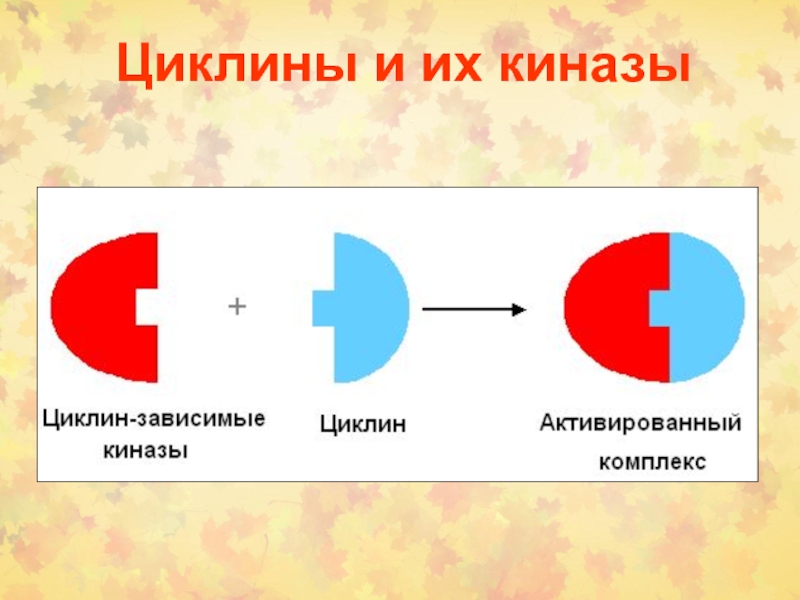
1. Циклины и циклин-зависимые киназы
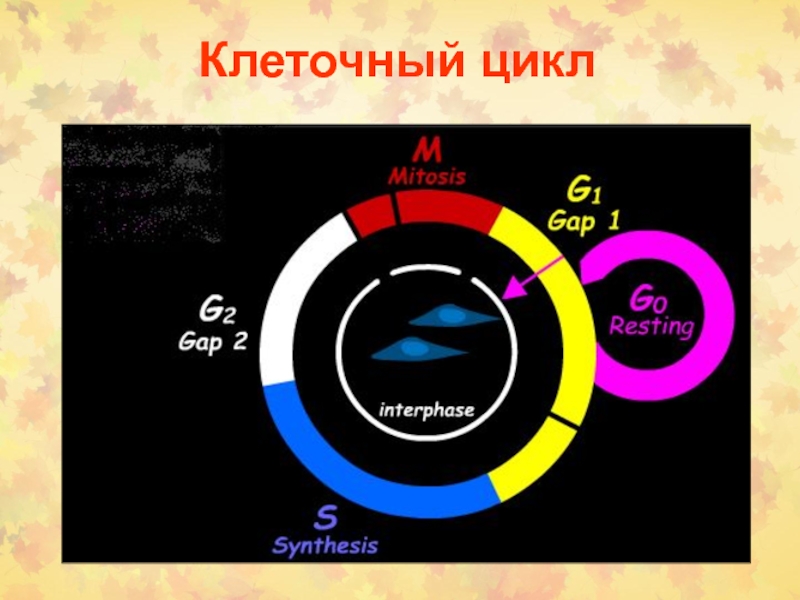
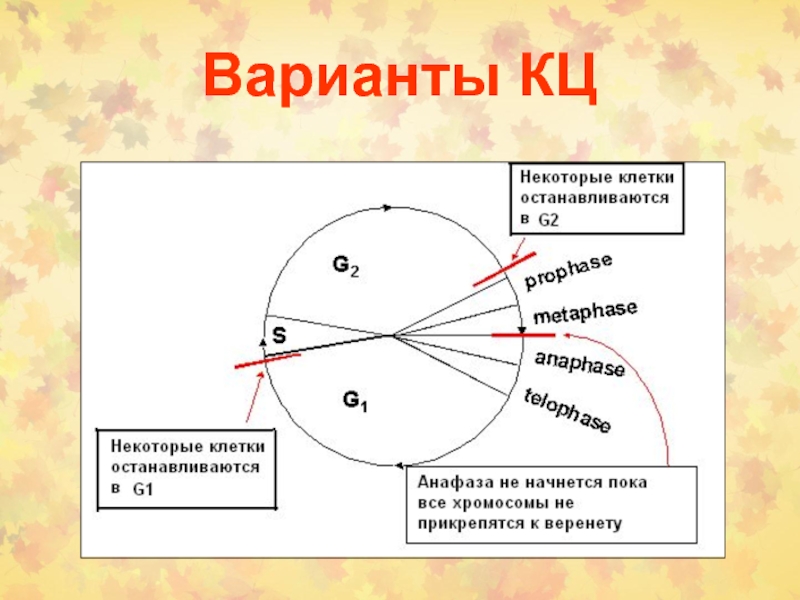
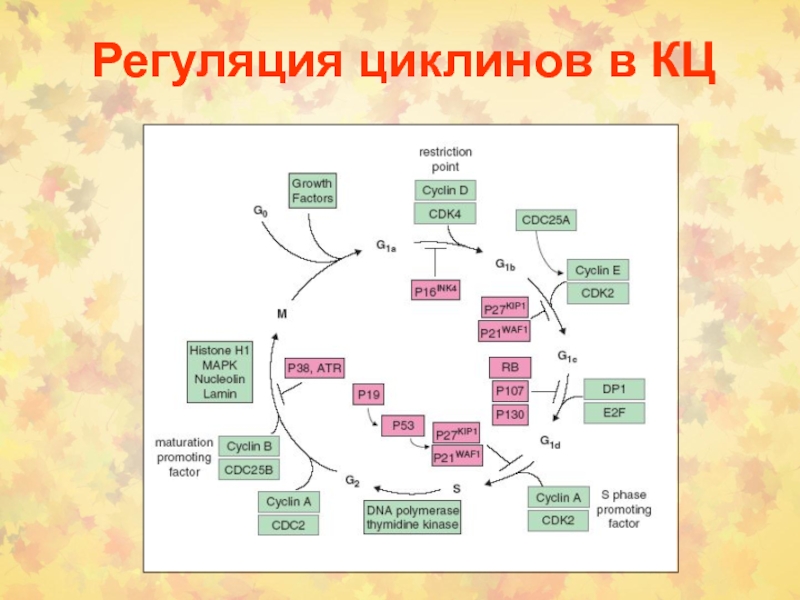
Слайд 3Определение фаз КЦ
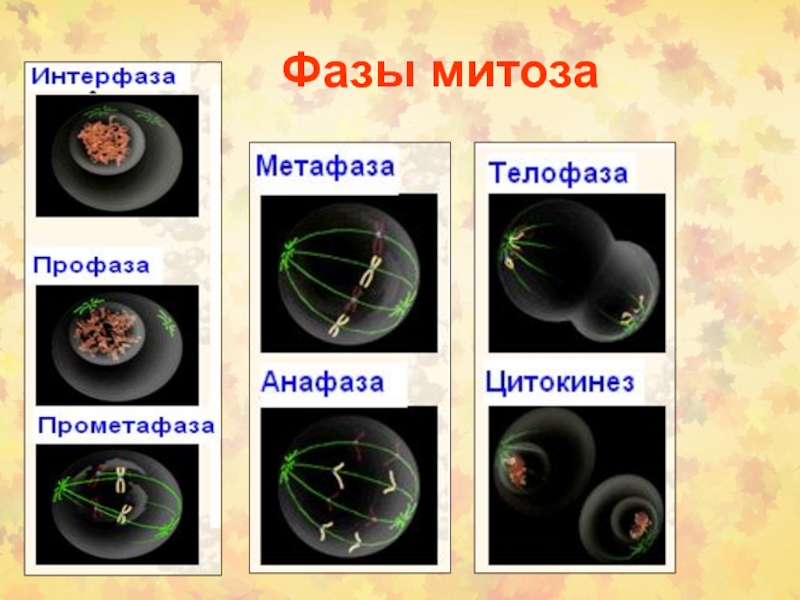
Период между двумя делениями называется интерфазой.
В клетках млекопитающих интерфаза длится от 12 до
24 часов. В это время в клетке постоянно синтезируется РНК, белки. Клетка увеличивается в размерах. Интерфаза делится на 4 периода: Gap (интервал) 0 (G0), Gap 1 (G1), S (synthesis) phase, Gap 2 (G2).
G1 фаза – период высокой метаболической активности и роста клетки между митозом и репликацией ДНК.
S фаза – период синтеза (репликации ДНК). Количество ядерной ДНК увеличивается в два раза от 2n до 4n.
G2 фаза– период подготовки к митозу. Продолжается клеточный рост и синтез необходимых белков
M фаза – деление клетки на две дочерние с уменьшением в них количества ДНК от 4n до 2n.
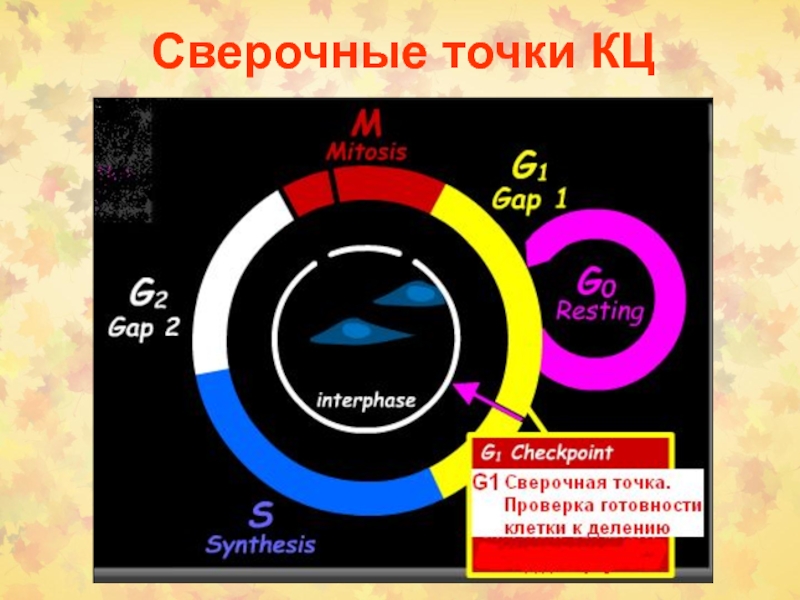
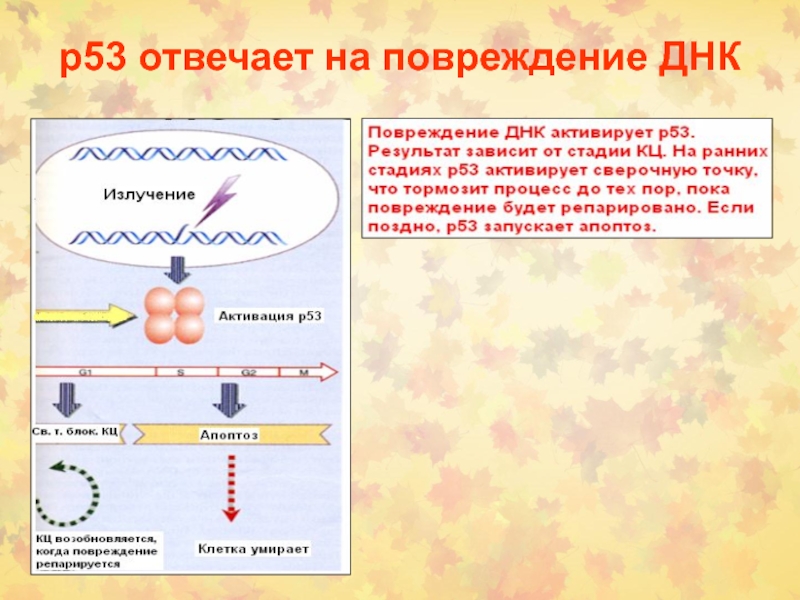
Слайд 5G1-сверочная точка
Проверка повреждения ДНК
Роль белка р53
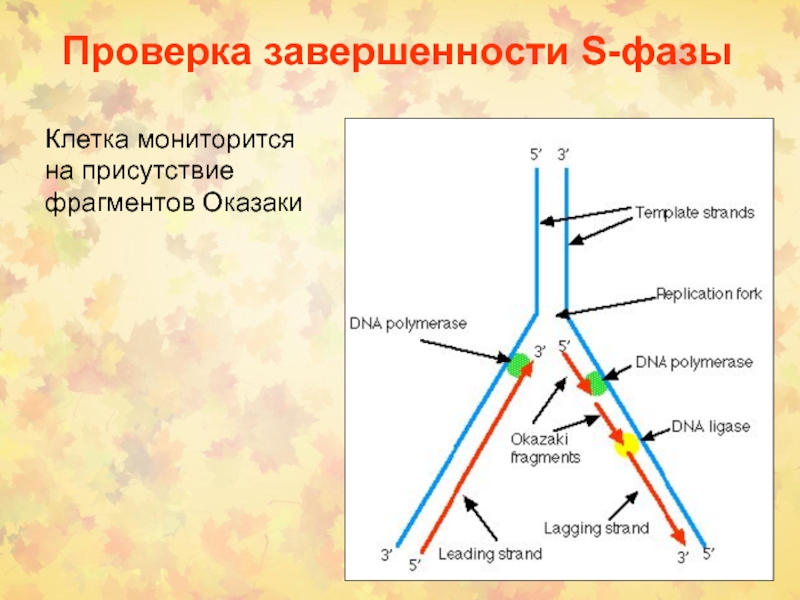
Слайд 7Проверка завершенности S-фазы
Клетка мониторится на присутствие фрагментов Оказаки
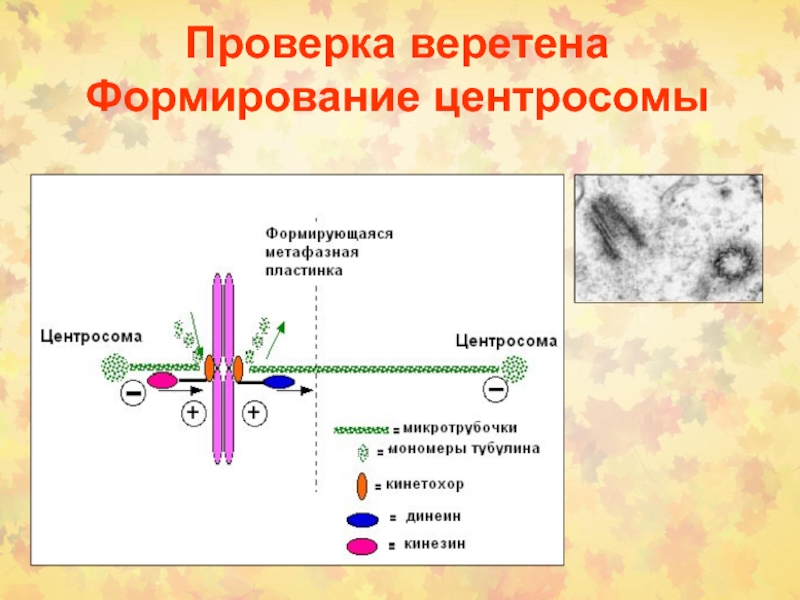
Слайд 9Проверка веретена Формирование центросомы
Слайд 10
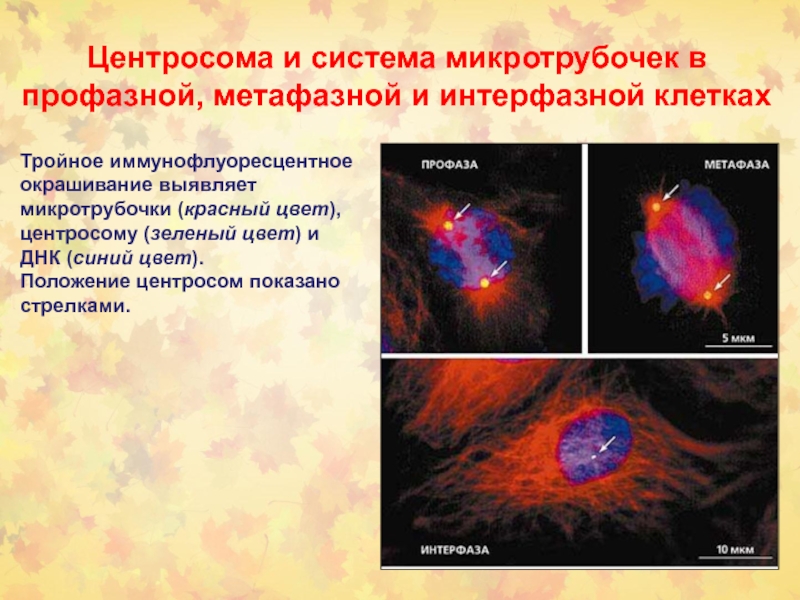
Центросома и система микротрубочек в профазной, метафазной и интерфазной клетках
Тройное
иммунофлуоресцентное окрашивание выявляет микротрубочки (красный цвет), центросому (зеленый цвет) и
ДНК (синий цвет).
Положение центросом показано стрелками.
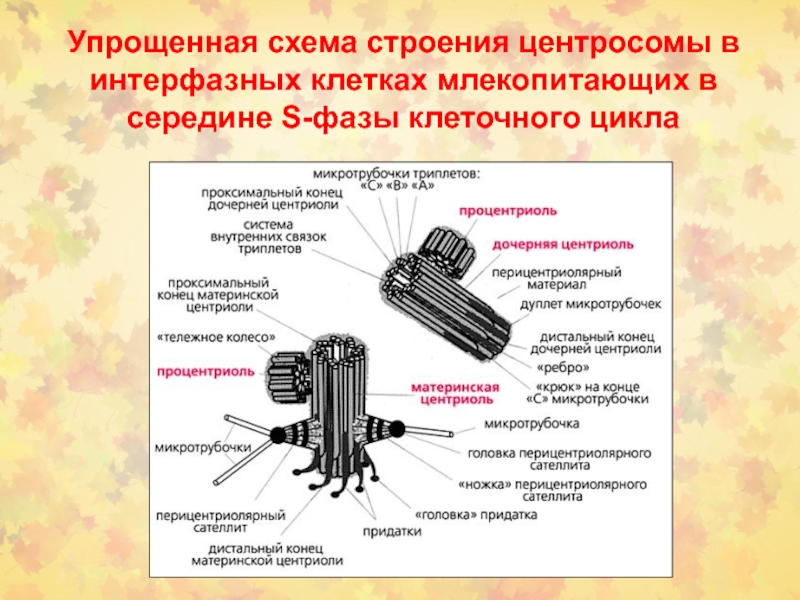
Слайд 11Упрощенная схема строения центросомы в интерфазных клетках млекопитающих в середине
S-фазы клеточного цикла
Слайд 12Ультраструктура центросомы в митотической клетке млекопитающих
Слайд 13Роль BRCА1 в формировании центросомы
BRCA1 - обладает убиквитин-зависимой лигазной
активностью. Контролирует локализацию гамма-тубулина в центросоме
Активен в комплексе с белком
BRCA1 associated ring domain (BARD1)
AURKA фосфорилирует BRCA1, вызывая ингибирование убиквитин-зависимой лигазной активности BRCA1.
Слайд 14Регуляция центросом BRCA1-зависимой убиквитиновой лигазой и
Aurora A киназой
Результат потери
функции BRCA1 и переэкспрессии AURRA (60% РМЖ) – амплификация центросомы
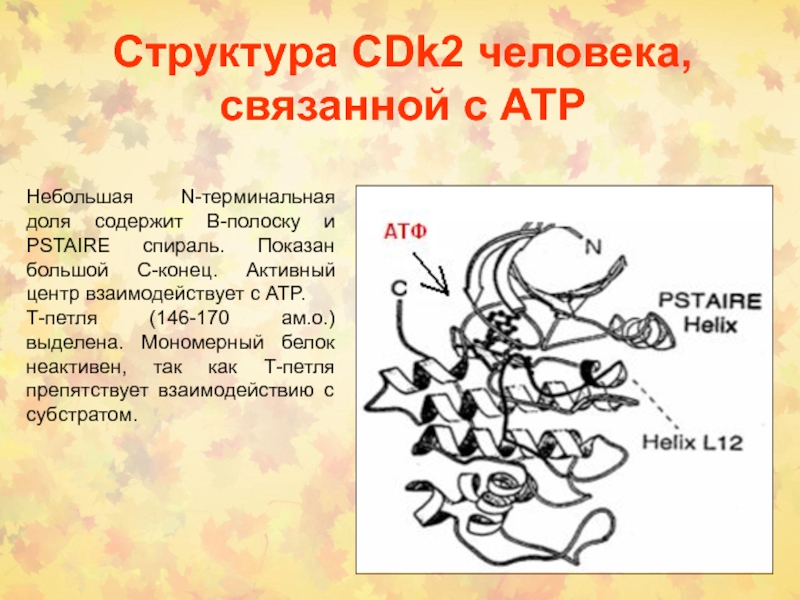
Слайд 22Структура CDk2 человека, связанной с АТP
Небольшая N-терминальная доля содержит В-полоску
и PSTAIRE спираль. Показан большой С-конец. Активный центр взаимодействует с
АТP.
Т-петля (146-170 ам.о.) выделена. Мономерный белок неактивен, так как Т-петля препятствует взаимодействию с субстратом.
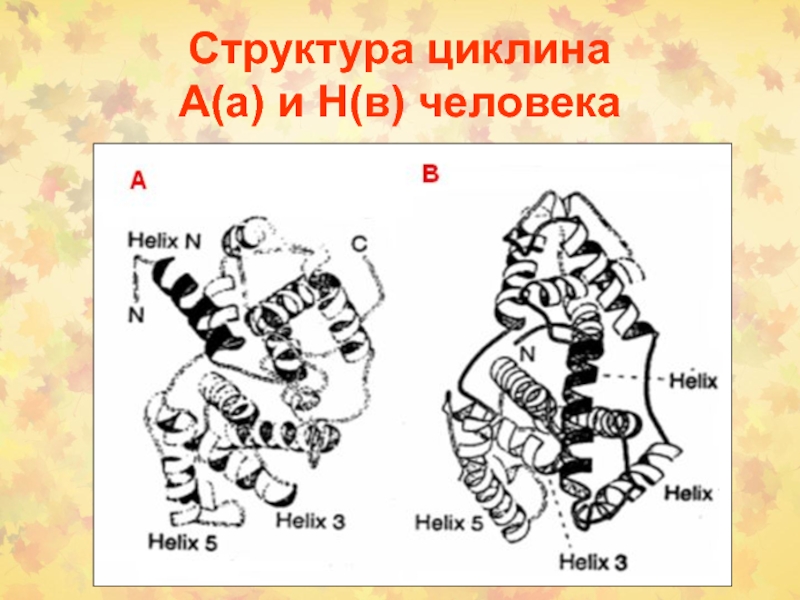
Слайд 23Структура циклина
А(а) и Н(в) человека
Слайд 24Структура Cdk2-циклин
А1-АТP комплекса человека
Cdk2 расположена слева. Циклин А
– справа. Т-петля обозначена черной стрелкой. Связывание Cdk2 и циклина
А включает взаимодействие между спиралью PSTAIRE Cdk-2 и спиралями 3 и 5 циклина А, а также между спиралью N циклина А и С-терминальной областью Cdk2. Связывание циклина вызывает значительные конформационные изменения в Cdk2. Спираль 1.12 Т-петли расположена в β-цепи, позволяя спирали PSTAIRE двигаться вовнутрь, чтобы корректировать расположение участка цепей, участвующих в ориентировке фосфата АТФ. Т-петля является уплощенной относительно ее позиции в мономере.
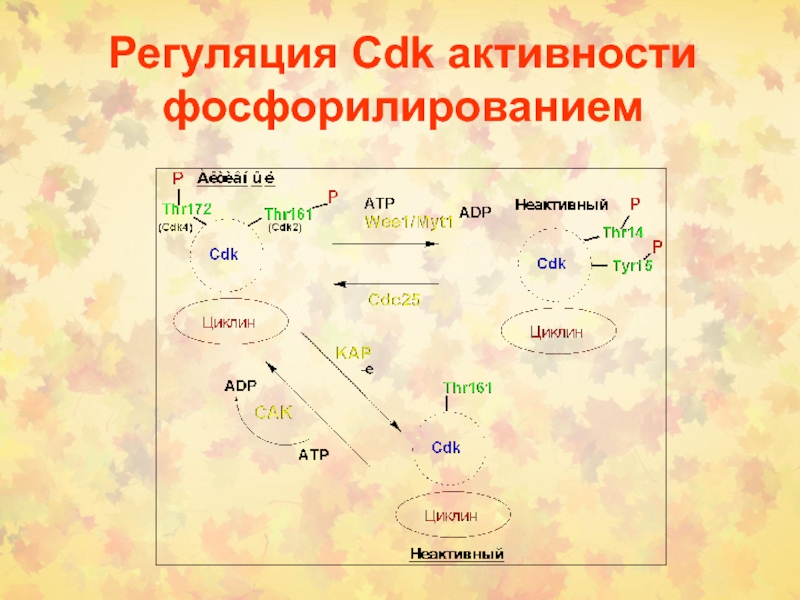
Слайд 25Регуляция Cdk активности фосфорилированием
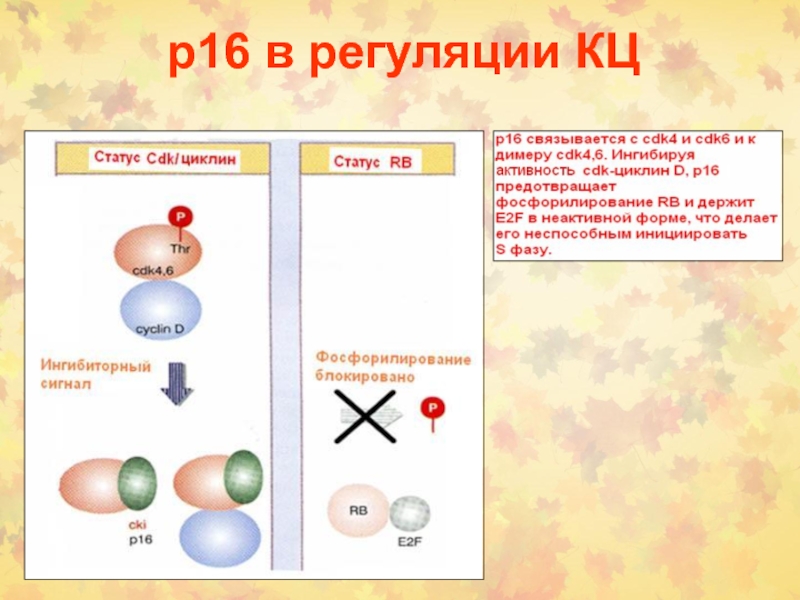
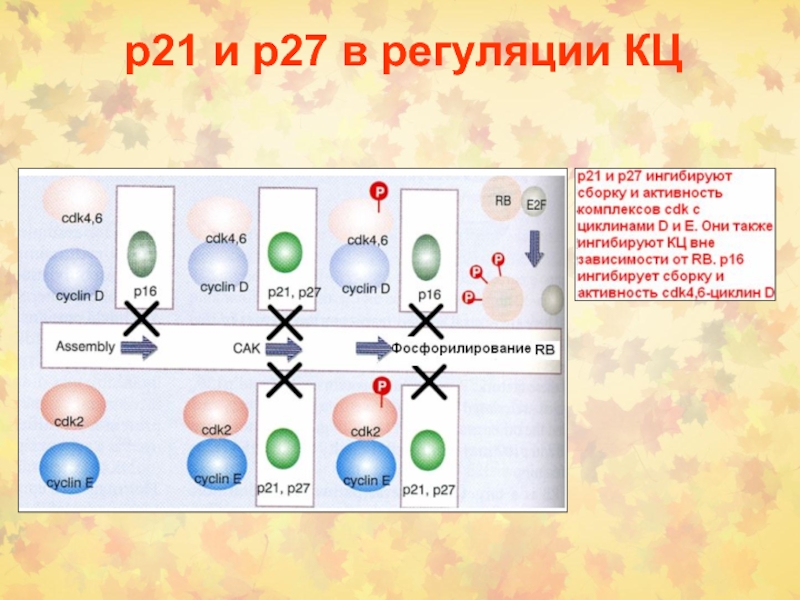
Слайд 26Ингибиторы Cdks
2 Семейства CKI:
Cip/Kip (Cdk ингибиторные белки) р21, р27,р57 –
ингибируют Cdk2 и Cdk4/6 (G1/S контроль)
INK4 (ингибиторы киназ) р15, р16,
р18 и р19 (узкоспецифичны для Cdk4/6)
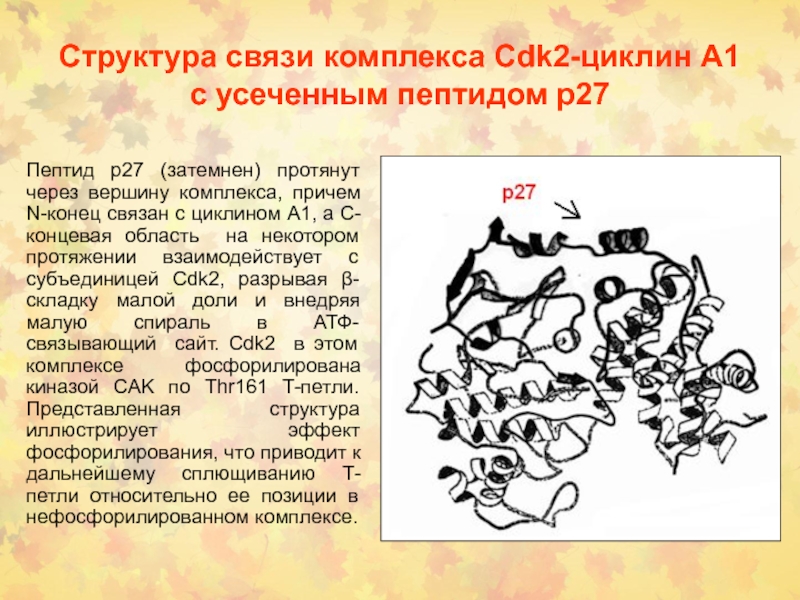
Слайд 27Структура связи комплекса Сdk2-циклин А1 с усеченным пептидом р27
Пептид
р27 (затемнен) протянут через вершину комплекса, причем N-конец связан с
циклином А1, а С-концевая область на некотором протяжении взаимодействует с субъединицей Сdk2, разрывая β-складку малой доли и внедряя малую спираль в АТФ-связывающий сайт. Сdk2 в этом комплексе фосфорилирована киназой CAK по Thr161 Т-петли. Представленная структура иллюстрирует эффект фосфорилирования, что приводит к дальнейшему сплющиванию Т-петли относительно ее позиции в нефосфорилированном комплексе.
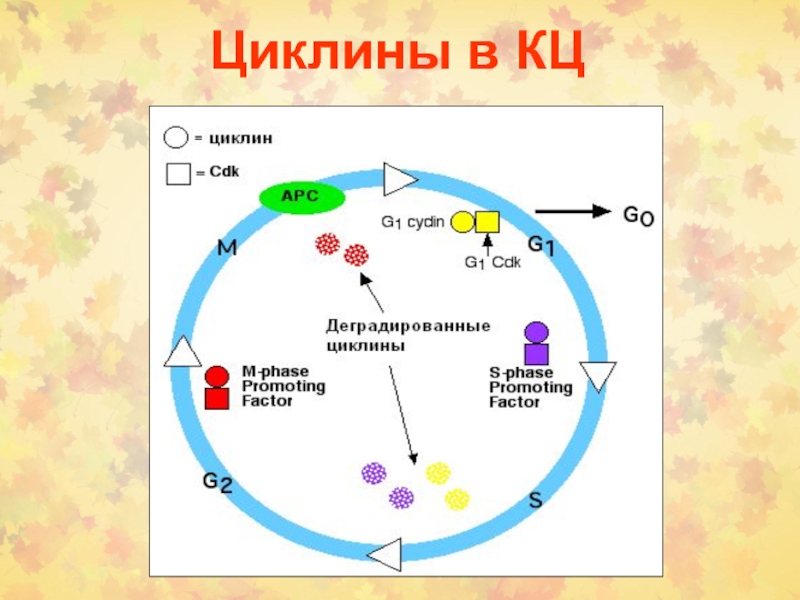
Слайд 30Регуляция циклинов
- Транскрипция (E2F стимулирует ЦА и Е в S
фазе) или ЦD RAS-RAF-MAP киназный каскад или сАМP.
- Деградация протеолизом
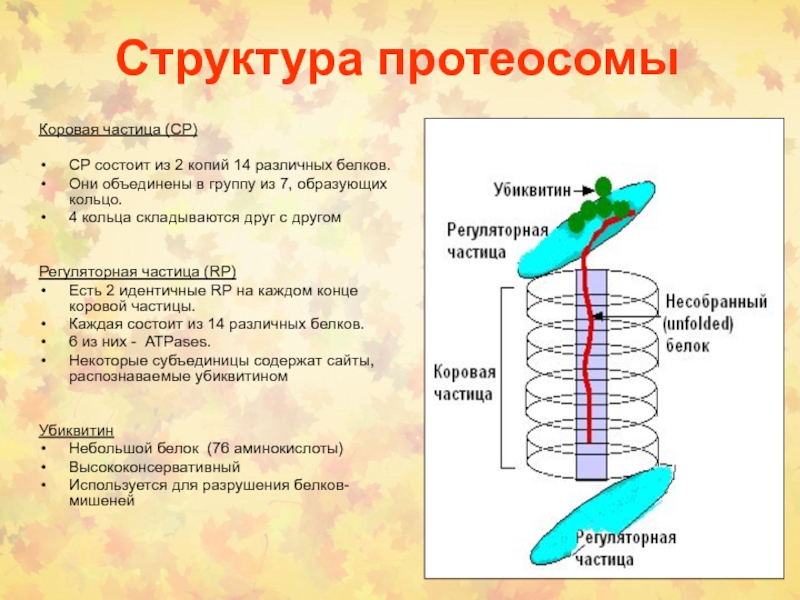
Слайд 31Структура протеосомы
Коровая частица (CP)
СР состоит из 2 копий 14 различных
белков.
Они объединены в группу из 7, образующих кольцо.
4 кольца складываются
друг с другом
Регуляторная частица (RP)
Есть 2 идентичные RP на каждом конце коровой частицы.
Каждая состоит из 14 различных белков.
6 из них - ATPases.
Некоторые субъединицы содержат сайты, распознаваемые убиквитином
Убиквитин
Небольшой белок (76 аминокислоты)
Высококонсервативный
Используется для разрушения белков-мишеней
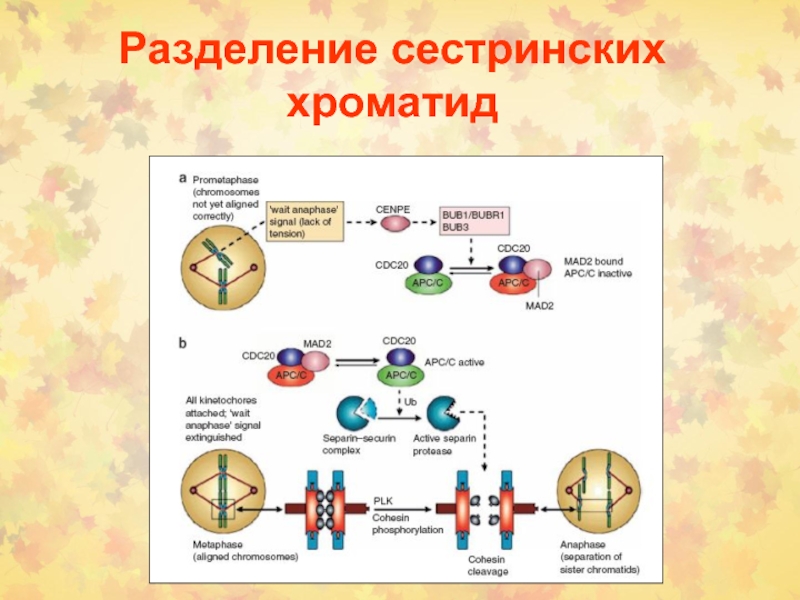
Слайд 34Деструкция митотических циклинов
Циклосома АРС (anaphase promoting complex) – метафаза-анафаза
(Cdc20) и выход из митоза (Hct1).
Субстрат для АРС-Cdc20 – белки
секурин и сепарин, удерживающие сестринские хроматиды. Для
АРС-Hct1осуществляет убиквитирование ЦВ.
APC инактивируется G1 циклинами
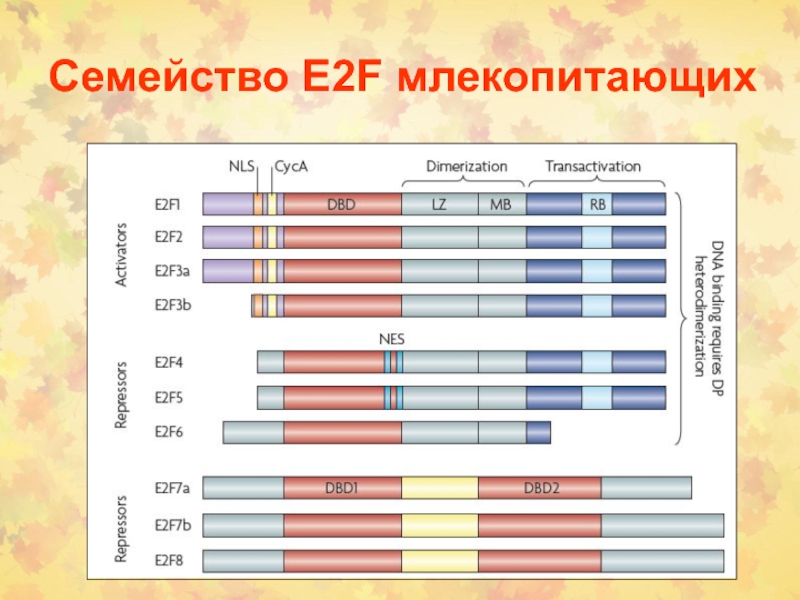
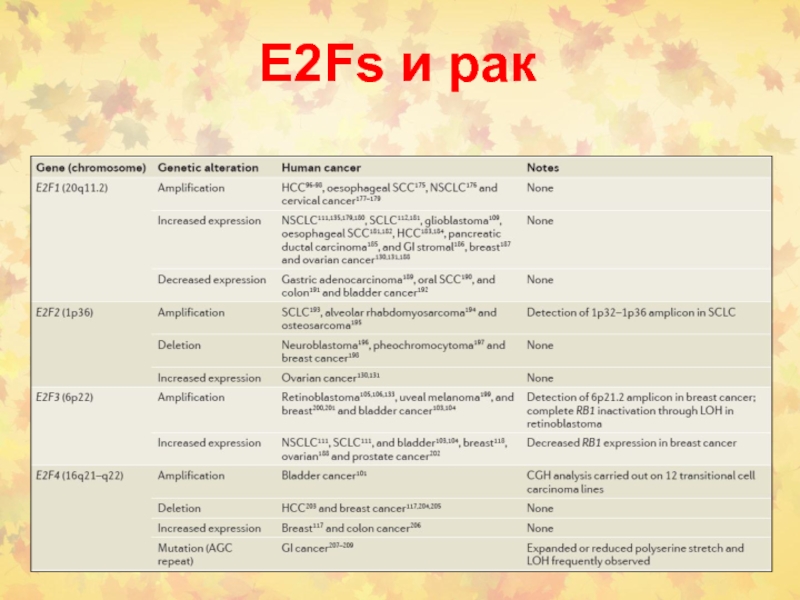
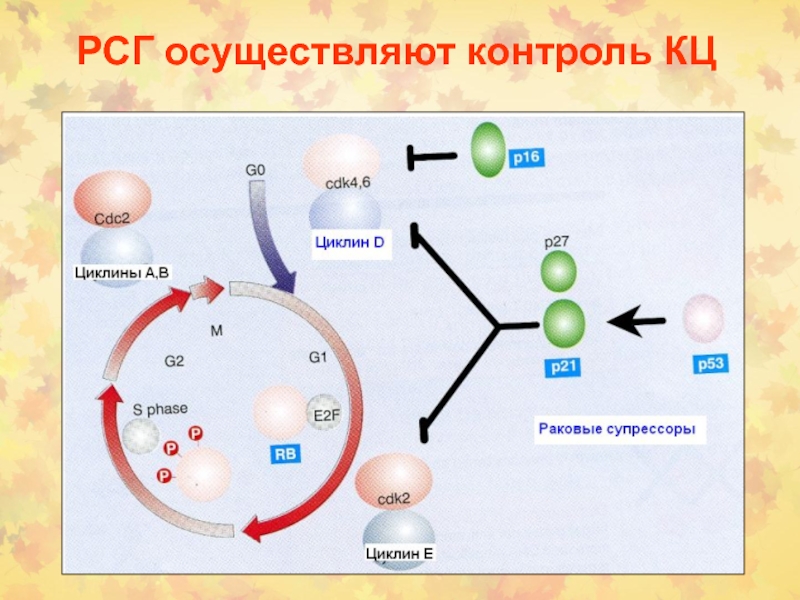
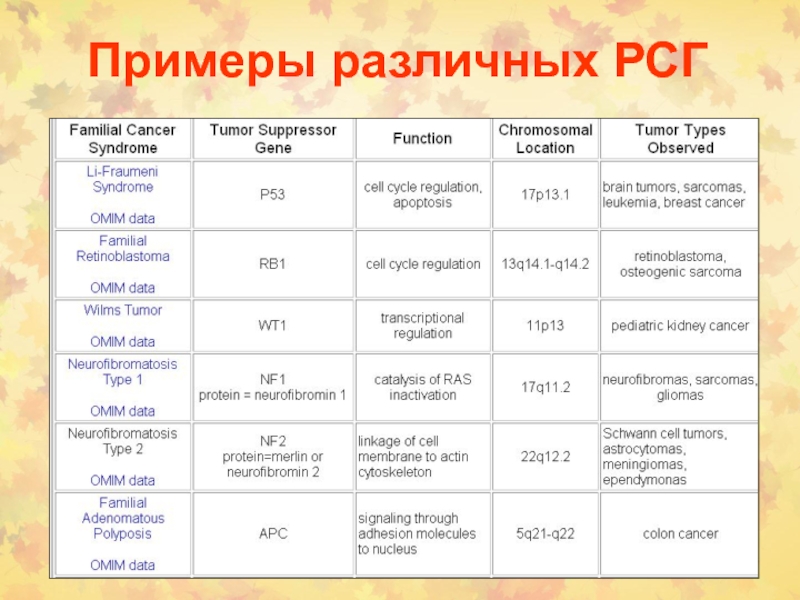
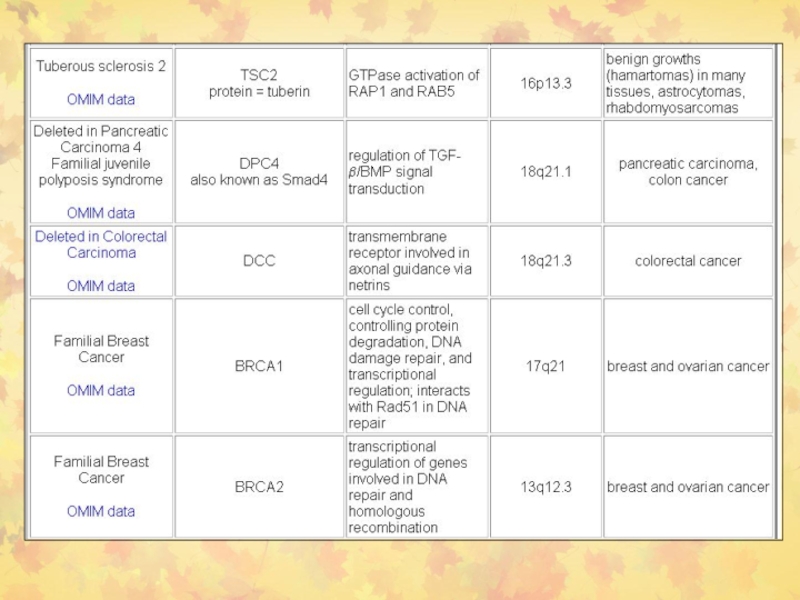
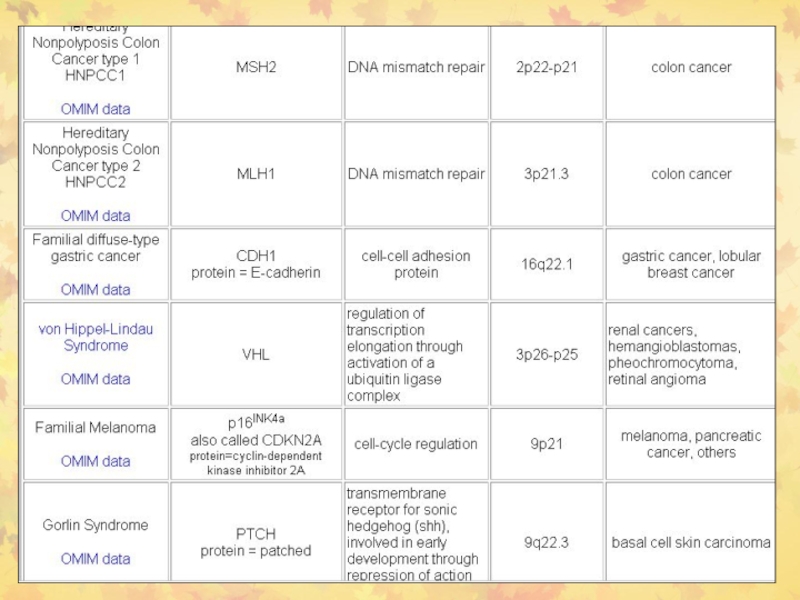
Слайд 382. Раковые супрессорные гены или онкосупрессоры
RB
р53 (ТР53)
Развитие
рака происходит из-за потери функции РСГ
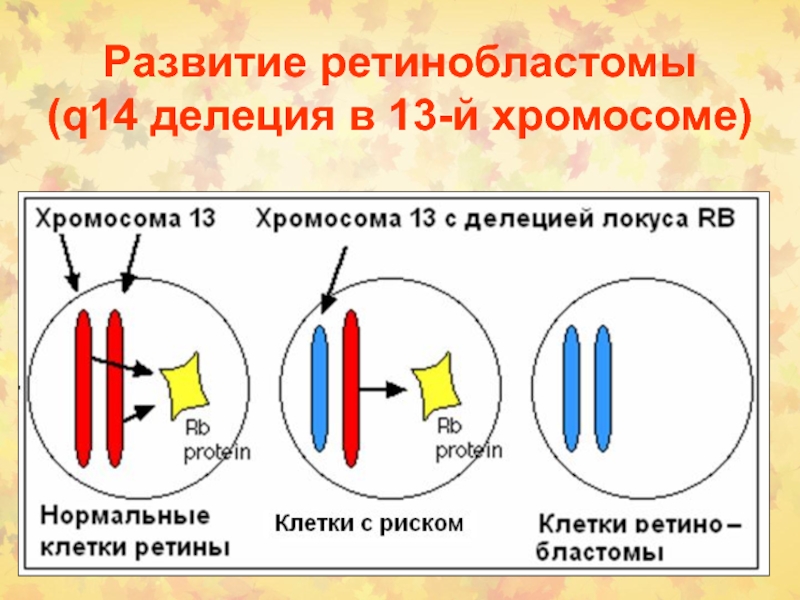
Слайд 39Развитие ретинобластомы
(q14 делеция в 13-й хромосоме)
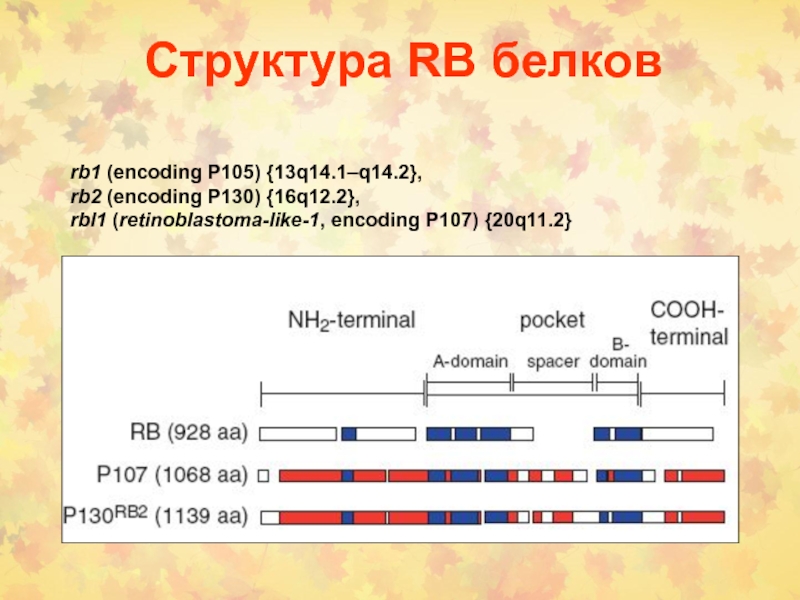
Слайд 42Структура RB белков
rb1 (encoding P105) {13q14.1–q14.2},
rb2 (encoding P130) {16q12.2},
rbl1 (retinoblastoma-like-1, encoding P107) {20q11.2}
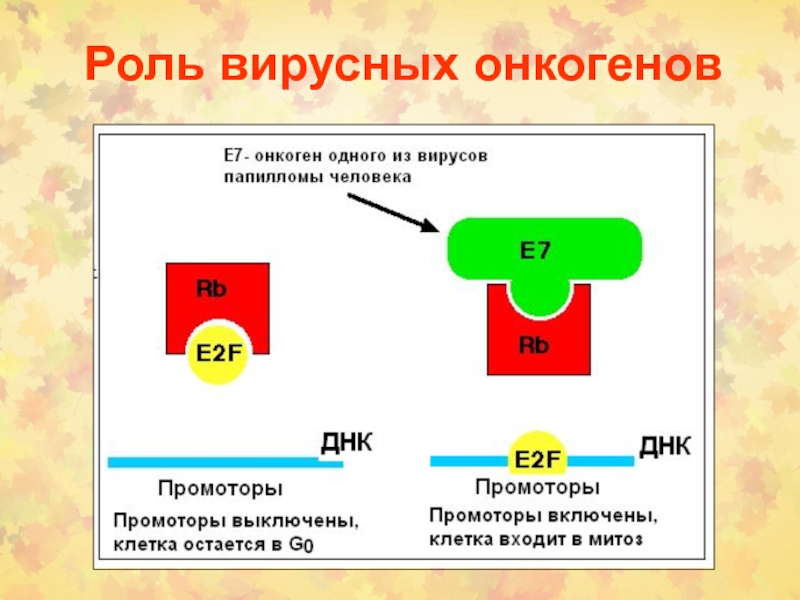
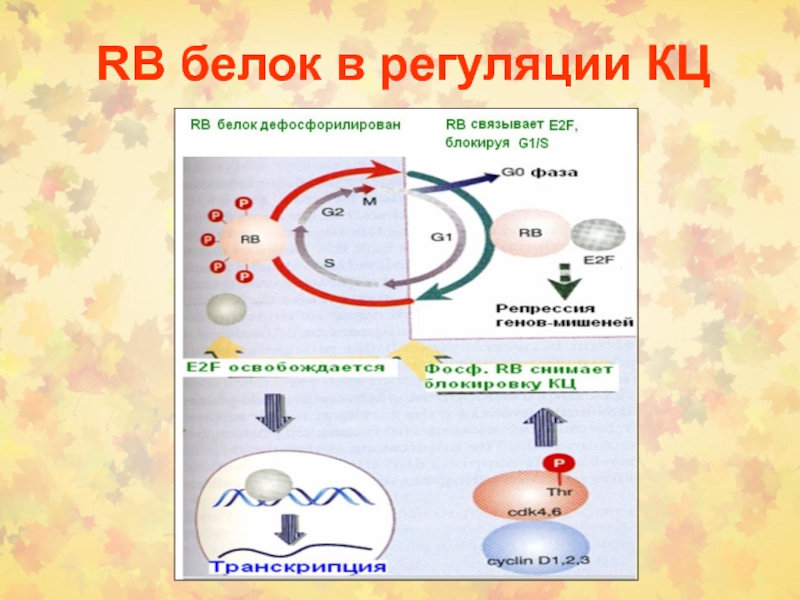
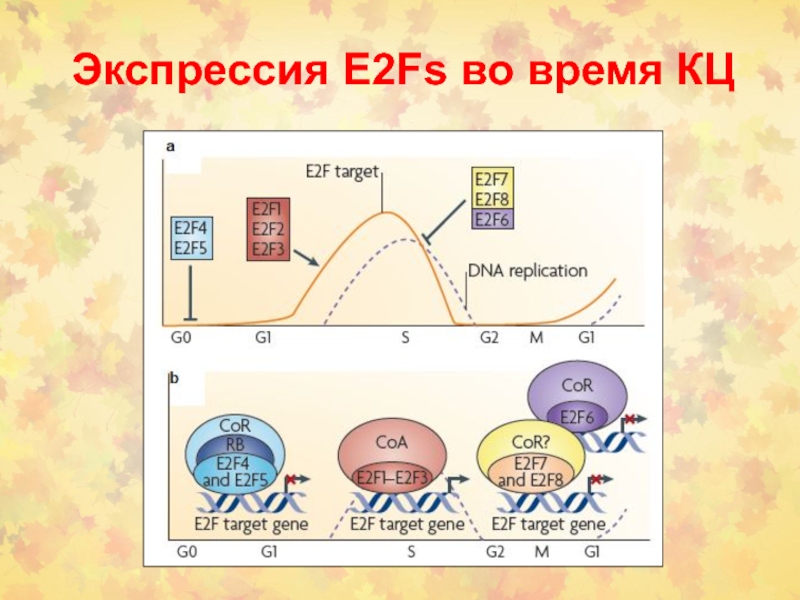
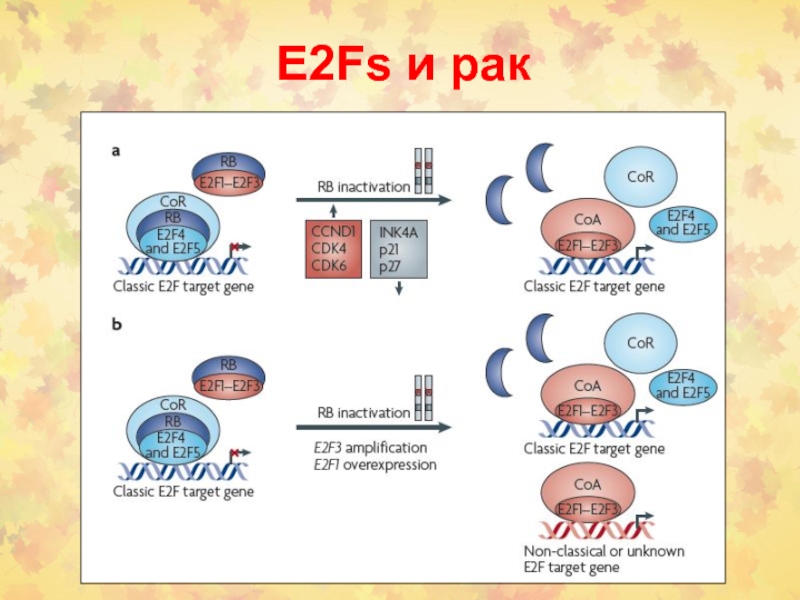
Слайд 45Фосфорилирование RB контролируется в КЦ
Блокирование КЦ прекращается, когда RB фосфорилируется
(в норме) или когда это секвестируется опухолевым онкогеном (в раковых
опухолях)
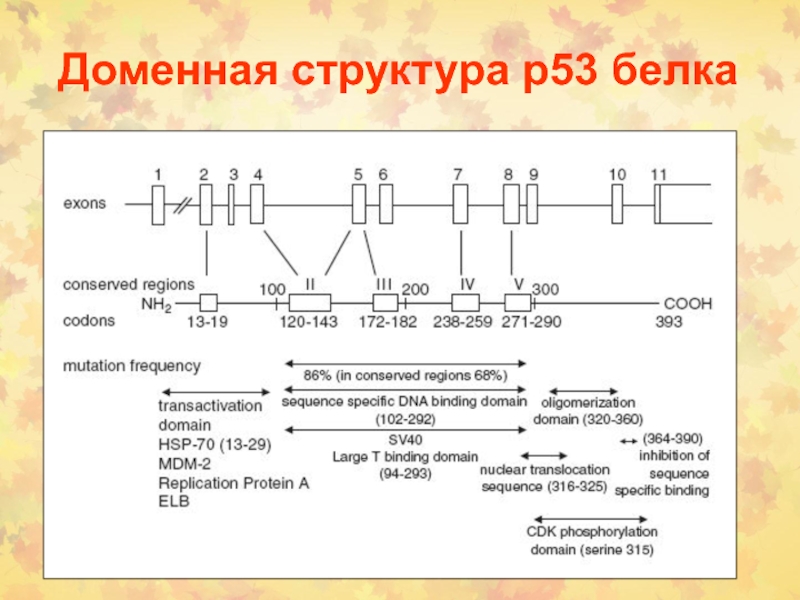
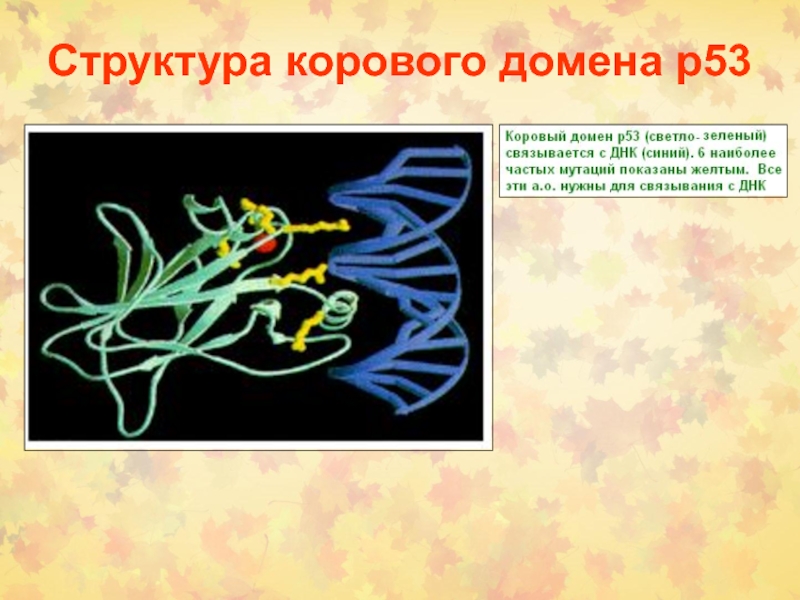
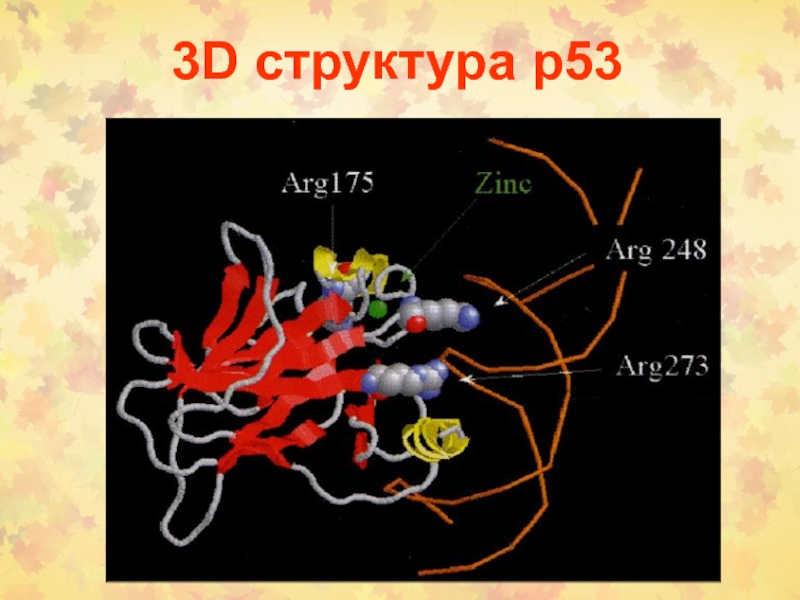
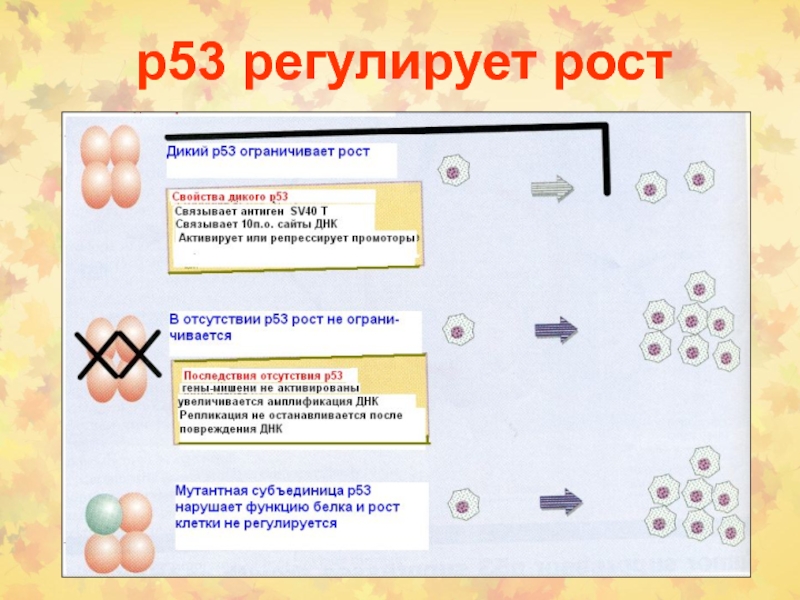
Слайд 52Структура и функции р53
- ДНК-связывающий белок (впервые описан в 1979
г.)
- Фактор транскрипции (активация, супрессия генов)
Страж генома
Локализация: 17 хромосома
Размер
- 20kb (11 экзонов)
Белок р53 – олигомерный ФТ (393 о.ак),
организован в 5 структурных и функциональных районов
Слайд 53Последовательности, узнаваемые р53
PuPuPuC(A/T)(T/A)GPyPyPy
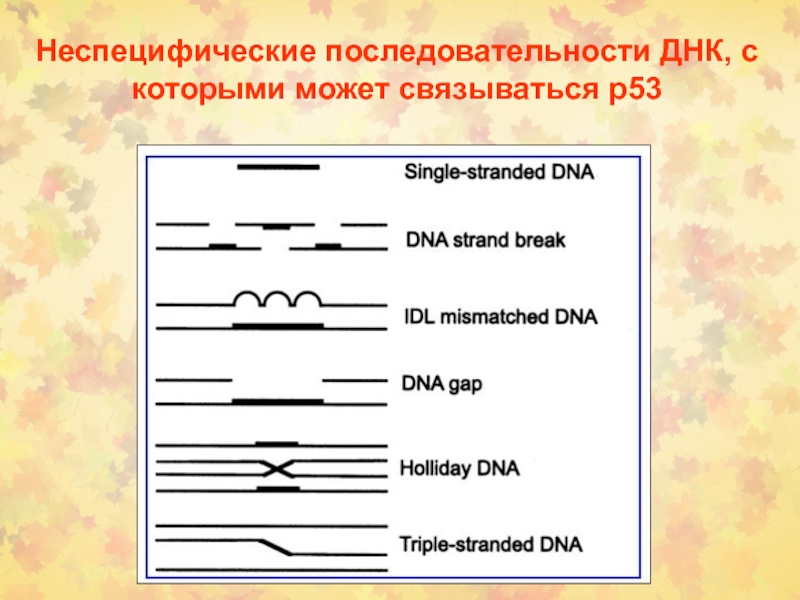
Слайд 60Неспецифические последовательности ДНК, с которыми может связываться р53
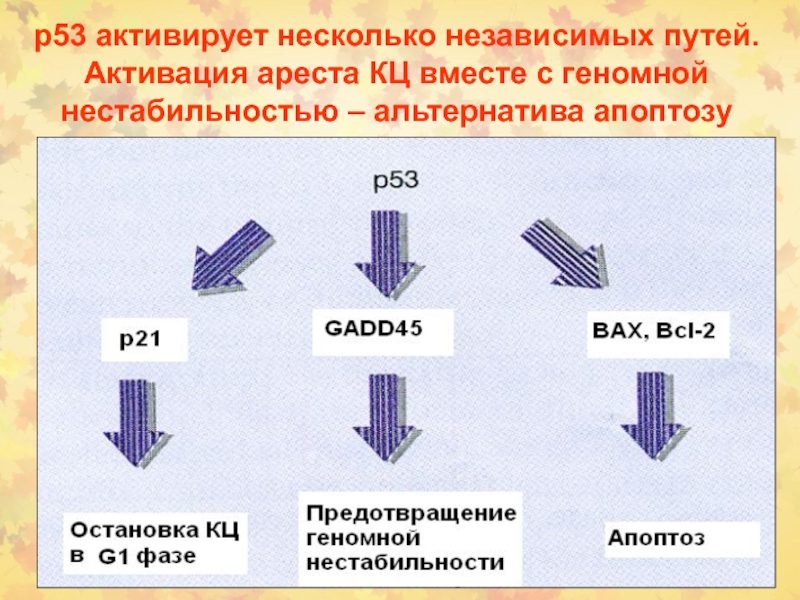
Слайд 62p53 активирует несколько независимых путей. Активация ареста КЦ вместе с
геномной нестабильностью – альтернатива апоптозу
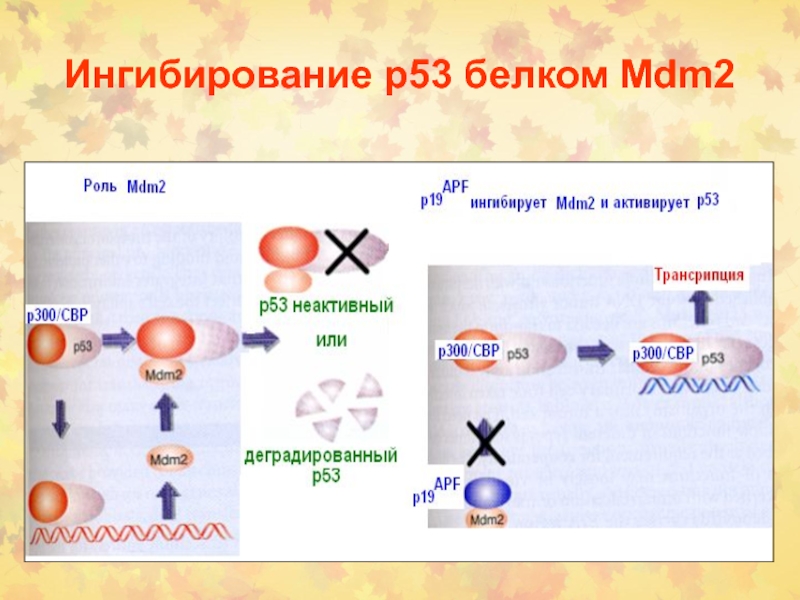
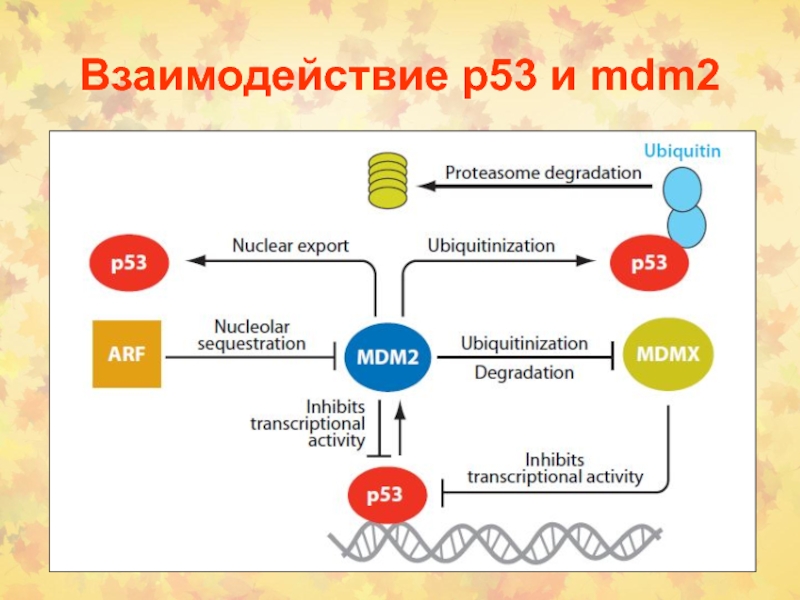
Слайд 63Регуляция активности р53
1. В норме его экспрессия невелика и контролируется
убиквинированием и протеосомной деградацией.
2. Индукция в ответ на стимулы (посттранскрипционная
модификация)
3. Деградация белка SUMO-1 + др. белки
4. Роль белка mdm2
5. Механизмы повреждения р53
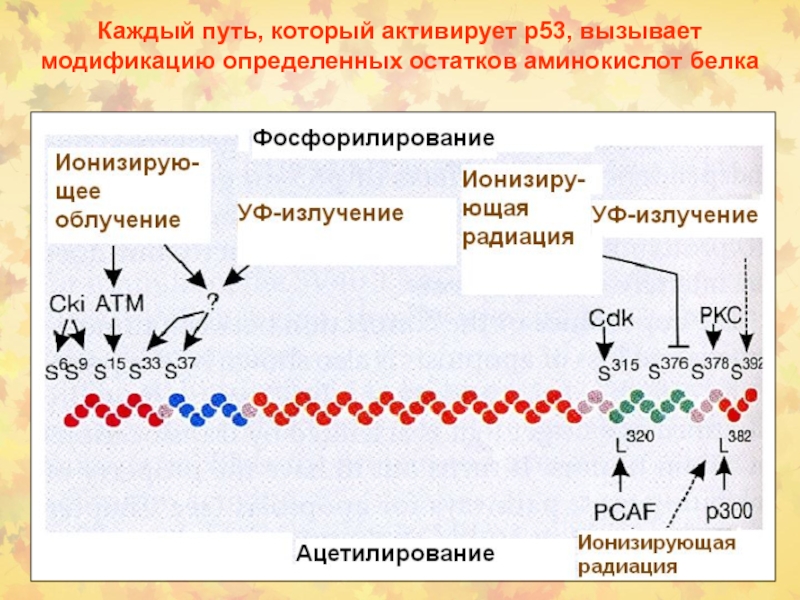
Слайд 64Каждый путь, который активирует р53, вызывает модификацию определенных остатков аминокислот
белка
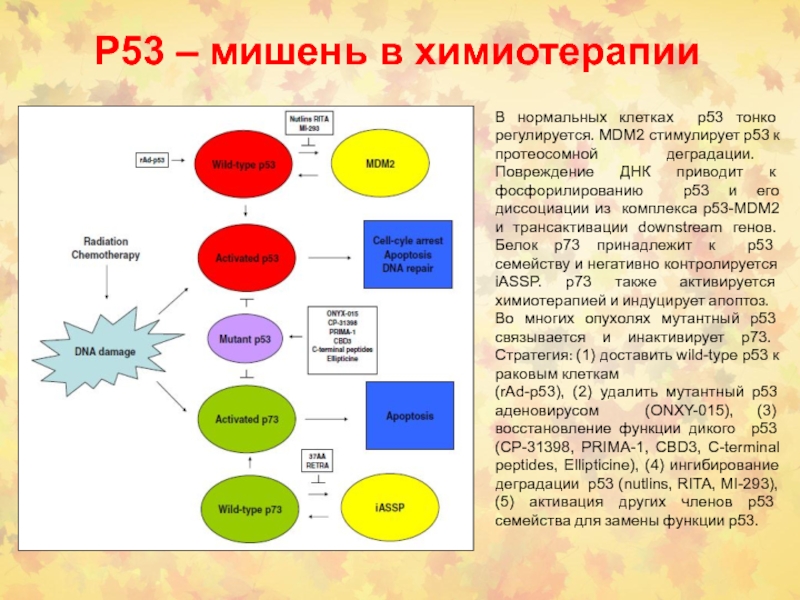
Слайд 68Р53 – мишень в химиотерапии
В нормальных клетках p53 тонко регулируется.
MDM2 стимулирует p53 к протеосомной деградации. Повреждение ДНК приводит к
фосфорилированию p53 и его диссоциации из комплекса p53-MDM2 и трансактивации downstream генов. Белок p73 принадлежит к p53 семейству и негативно контролируется iASSP. p73 также активируется химиотерапией и индуцирует апоптоз.
Во многих опухолях мутантный p53 связывается и инактивирует p73. Стратегия: (1) доставить wild-type p53 к раковым клеткам
(rAd-p53), (2) удалить мутантный p53 аденовирусом (ONXY-015), (3) восстановление функции дикого p53 (CP-31398, PRIMA-1, CBD3, C-terminal peptides, Ellipticine), (4) ингибирование деградации p53 (nutlins, RITA, MI-293), (5) активация других членов p53 семейства для замены функции p53.
Слайд 70Наиболее часто встречаемые мутации р53
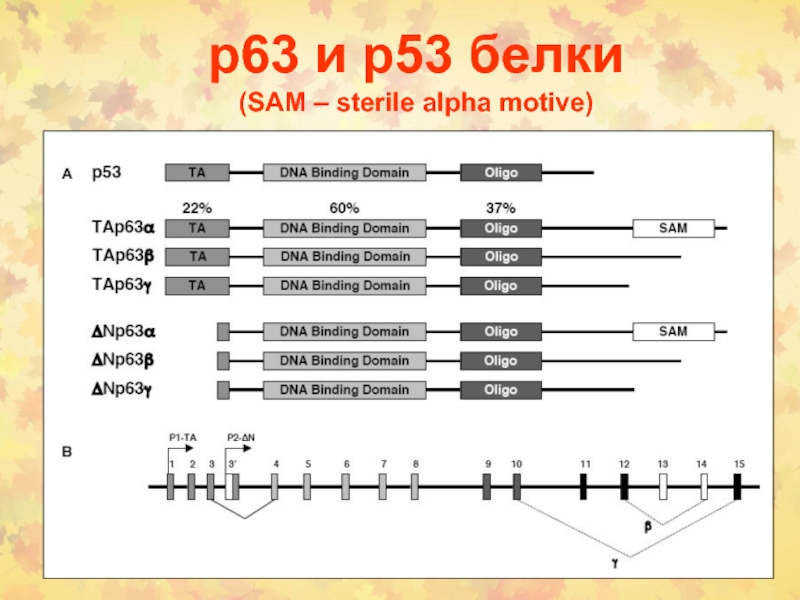
Слайд 71р63 и р53 белки
(SAM – sterile alpha motive)
Слайд 76Примеры нокаутных мышей с инактивированными РСГ или ПО
Слайд 77VHL онкосупрессор
Von Hippel-Lindau syndrome – наследственная мультисистемная болезнь, характеризующаяся ненормальным
ростом кровяных сосудов.
Часто сопровождается спорадической ренальной карциномой.
Локализация –
ядро и цитозоль.
Выполняет аналогичные р53 и RB функции