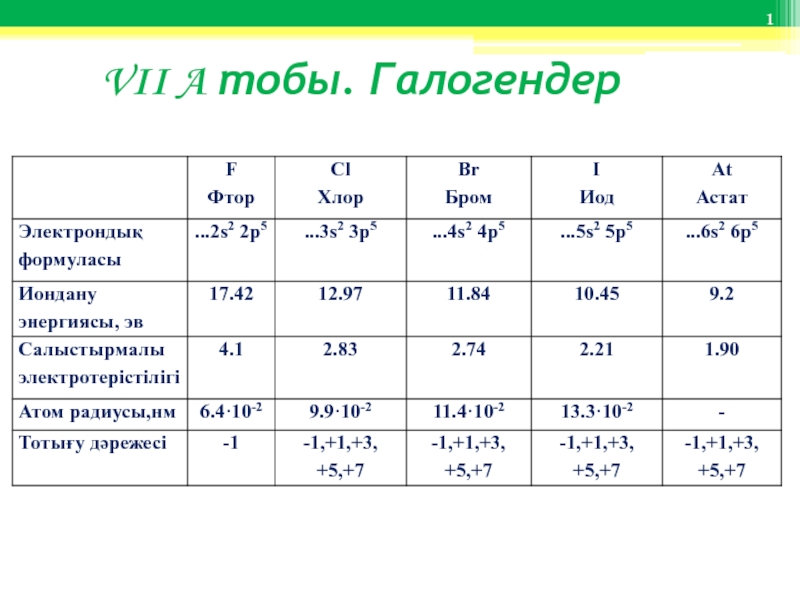
Слайд 2 Сыртқы деңгейінде ns2 np5 (7е) болады. Олар бір электрон
қосып алып, - 1-ге тең тотығу дәрежесін көрсетеді.
Фтор атомынан басқа
галогендердің атомдары оң тотығу
дәрежесін +1, +3, +5, +7 көрсетеді.
Фтор атомының электротерістілігі жоғары болғандықтан фтор 2р –деңгейшесіне тек қана бір электронды қабылдайды, бос квант ұяшықтары жоқ.
Хлор атомының 3р – қосымша деңгейшесінен
3d – деңгейшесінде 5 орбиталі бар.
Қыздырылған қалыпты хлор атомындағы 3р және
3s –деңгейшелердегі электрондар 3d – деңгейшеге ауысады.
Сондықтан Cl , Br , I атомдарының +1, +3, +5, +7
тотығу дәрежелері бар.
3р
3s
3d
Слайд 3Галогендердің сутекті қосылыстарының судағы
ерітінделері қышқылдар болады.
HF – фторсутек (балқытқыш қышқыл)
HCl
– хлорсутек (тұз қышқылы)
HBr – бромсутек
HI – иодты сутек
HF –HCl – HBr – HI
Қышқылдарының күші жоғарылайды.
Байланыс энергиясы төмендейді.
AgF – AgCl – AgBr – AgI
Ерігіштігі төмендейді (AgF суда жақсы ериді)
Слайд 4Сумен әрекеттесуі әртүрлі:
а) F2 + H2O = 2HF + O
б)
Хлордың сумен әрекеттесуі екі қышқыл : тұз қышқылы(күшті) және хлорлау
қышқылы(әлсіз) -түзе әрекеттеседі.
Cl2 + H2O = HCl + HClO (хлорлау қышқылы)
Cl2 + H2O = H + Cl + HClO
2HClO = 2HCl +O2
в) Br2 + H2O = HBr + HBrO бром суы
г) I2 + H2O = HI + HIO иод суы
-
+
Слайд 5Галогендердің реакцияға қатысу қабілеті F – Cl – Br –
I
қатарда төмендейді.
Активтілік : F2 > Cl2 >Br2 > I2 болады.
Галогендердің реттік нөмірі өскен сайын олардың
физикалық қасиеттері заңдылықпен өзгереді:
Фтор – қиын сұйытылатын газ,
Хлор – оңай сұйытылатын газ,
Бром – сұйықтық,
Иод – қатты кристалдық зат.
Табиғатта таралуы:
CaF2 – флюорит
Na3[ALF6] – криолит
Ca5 (PO4)3F – фтораппатит
NaCl – галит
KCl - сильвин
Br , I иондары – теңіз суында, мұнай суларында.
Слайд 6Физикалық қасиеттері:
Бос күйінде молекулалары екі атомды:
F2 – ақсары түсті газ.
Cl2
– жасылсары түсті газ.
Br2 – қызыл-қоңыр түсті сұйық .
I2 –
күлгін түсті кристалдар.
Галогендер улы заттар.
өткір иісті
Слайд 7Химиялық қасиеттері:
1) Металдармен
2Na + Cl2 = 2NaCl
(натрий хлориді)
2Al + 3I2 = 2AlI3
(алюминий иодиді)
2) Металеместермен
H2 + Cl2 = 2HCl
2P + 5Br2 = 2PBr5 (фосфордың пента бромиді)
Галогендердің сутекпен реакциясы радикалдық
механизммен жүреді:
а) радикалдың түзілуі: Cl2 2Cl'
б) тізбектің өсіу: Cl' + H2 HCl + H'
в) тізбектің үзілуі: H' + Cl' HCl
Слайд 83) Сумен әрекеттесуі:
а) F2 + H2O =
2HF + O
б) Cl2 + H2O =
HCl + HClO (хлорлау қышқылы)
в) Br2 + H2O = HBr + HBrO
4) Сілтілермен әрекеттесуі:
Cl2 + 2KOH = KCl + KClO + H2O
3Cl2 + 6KOH 5KCl + KClO3 + 3H2O
5) Тотықтырғыш қасиеттері:
Бос галогендер – күшті тотықтырғыштар.
F2 - Cl2 - Br2 - I2 тотықтырғыш қасиеттері төмендейді.
2KBr + Cl2 = Br2 + 2KCl
2KI + Cl2 = I2 + 2KCl
2KI + Br2 = I2 + 2KBr
Br2 + 5Cl2 + 12KOH = 2KBrO3 + 10KCl + 6H2O
t=100ºC
Слайд 9Алынуы:
1) Фторидтердің электролизі
CaF2 = Ca + F2
2KHF2 = 2K
+ H2 + 2F2
2) Хлорды NaCl электролизімен алады:
2NaCl = 2Na
+ Cl2
немесе сулы ерітіндісімен:
2NaCl + 2H2O = 2NaOH + H2 + Cl2
3) Лабораторияда:
4HCI + MnO2 = MnCI2 + CI2 + 2H2O
16HCI + 2KMnO4 = 2MnCI2 + 5CI2 + 2KCI + 8H2O
Бром мен иодты тұздарынан алады:
2KBr + CI2 = 2KCI = Br2
2KI + CI2 = 2KCI = I2
Слайд 10Галогенсутектер: HF – HCl – HBr – HI – HAt
Алынуы:
1. CaF2 + H2SO4 = CaSO4 + 2HF
2. H2 + CI2 = 2HCI(темпер,қысым)
3. H2 + Br2 = 2HBr (темпер,катализатор)
Лабораторияда: NaCI + H2SO4 = NaHSO4 +HCI
Қасиеттері: HF – түссіз сұйық, t балқу= 19,5°C
HCI, HBr, HI – түссіз газдар, суда жақсы ериді.
HF сутектік байланыс түзеді:
H – F …H – F …H – F …H – F
HF - әлсіз қышқыл, суда еріп балқытқыш қышқыл HF
ды түзеді. Бұл қышқыл шыныны жеп жібереді, оны
парафиннен, каучуктен, полиэтиленнен немесе
қорғасыннан жасалған ыдыстарда сақтайды.
Слайд 11HCI – түссіз сұйықтық, ω(HCI)= 40% (20°)
Типтік қышқыл: Mg
+ 2HCI = MgCI2 + H2
Na2O + 2HCI = 2NaCI
+ 2H2O
Cu(OH)2 + 2HCI = CuCI2 + 2H2O
Pb(NO3)2 + 2HCI = PbCI2 + 2HNO3
HBr және HI өте HCI –ға ұқсас.
Тұздары: фториттер, хлоридтер, бромидтер,
иодидтер. І А тобының фториттері және NH4F суда
жақсы ериді, қалған фторидтер суда ерімейді.
Хлоридтер, бромидтер, иодидтер суда жақсы ериді
суда(Ag, Pb) тұздары ерімейді.
Тотықсыздандырғыш қасиеттері HCI –дан HI дейін
өседі.
Слайд 124HI + MnO2 = I2 + MnI2 + 2H2O
10KBr+2KMnO4+8H2SO4 =
5Br2+2MnSO4+6K2SO4+8H2O
HF мен фторидтер тотықсыздандырғыш қасиет
көрсетпейді.
Галогенид иондарын ашу: CI- + Ag+
= AgCI (ақ)
Br- + Ag+ = AgBr (ақ сары) I- + Ag+ = AgI (сары)
Галогенидтер натрий тиосульфатында ериді:
2Na2S2O3 + AgBr = Na3[Ag(S2O3)2] + NaBr
Тұздарының қолданылуы:
NaCI – минерал галит, 0,9%-ты ерітіндісі физиологиялық
немесе изотондық ерітінді, тұз қышқылын, соданы алу
үшін, тамақ өнімдерін консервлеу үшін қолданылады.
KCI – жүрек соғуының жиілігін реттеуші, бұлшық етін
азып-тозудан сақтаушы.
Слайд 13NaBr, KBr – жүйкені тыныштандырады,
адреналинді активсіздендіреді.
NaІ, KІ – қалқанша безінің
ауруын емдеуге
қолданылады.
СаСІ2 – жүректің жұмысын реттеуші, қанды
тоқтаушы, аллергияға қарсы қабылданады,
магний
тұзымен уланғанда, уды кетіруші емдік шараларда
қолданылады.
NaOCI – натрий гипохлориті (Дакен сұйығы)
0,5% - дық ерітіндісімен жараланған жерді жуады.
HCI – тұз қышқылы- ас қорытады, асқазан сөлінің
қышқылдығы азайғанда ішеді.
Са(OCI)2 – хлорлы ізбес, суды залалсыздандырады, қоқыстарды хлорлылайды, жәшіктерді, ұраларды тазартуға хлорлы ізбес қолданылады.
Иодтың спирттегі 5% ерітіндісі I2 – антисептик, жараны,
ірінді тазалайды.
Слайд 14Галогендердің оттекті қосылыстары:
Фтор оксиді – түссіз газ, суда ерімейді.
Алынуы: 2F2
+ 2NaOH = F2O + 2NaF + H2O
F2O2 оттектің диофториді
– қызыл-сары түсті
қатты затты, тұрақсыз, қопарылыс береді.
Хлордың оттекті қосылыстары:
HCIO – хлорлылау қышқылы, тұздары–гипохлорит
HCIO H + CIO K=2,8·10-8 (әлсіз)
HCIO2 – хлорлы қышқыл, тұздары–хлорит
HCIO2 H + CIO2 K=1,1·10-2 (әлсіз)
HCIO3 – хлорлау қышқылы, тұздары–хлорат
HCIO3 H + CIO3 K=10 (күшті)
HCIO4– хлор қышқылы, тұздары перхлорат
HCIO4 H + CIO4 K=1010 (өте күшті)
Слайд 15HCIO –хлорлылау қышқылы
Т.Д.: + 1
Алынуы: 2Cl2 + 2HgO+H2O=2HCIO + HgO
· HgCl2
Қасиеттері:
1.Тотықтырғыш қасиеті: HCIO = HCI + O (hv)
HI
+ HCIO = I2 + HCI + H2O
2. Тұздар түзілуі:
2СІ2 + 2Ca(OH)2 = CaCI2 + Ca(OCI)2 + 2H2O
3. Диспропорциялану реакциясы:
2HHalO HHal + HHalO2
3HHalO 2HHal + HHalO3
Слайд 16HCIO2 -хлорлы қышкыл
Т.Д.: + 3
Алынуы:
1) Ba(CIO2)2 + H2SO4=BaSO4
+ 2HCIO2
2) 2CIO2 + H2O2 = 2HCIO2 + O2
HCIO2 тұрақсыз:
4HCIO2=2CIO2+HCIO3+HCI+H2O
HCIO3 -хлорлау қышқылы
Т.Д.: + 5
Алынуы: Ba(CIO3)2 + H2SO4=BaSO4 + 2HCIO3
Қасиеттері:
1.Tотықтырғыш қасиеті:5HCIO3 + 6P = 3P2O5 + 5HCI
2.Тұздарды түзуі: KOH + HCIO3 = KCIO3 + H2O
Слайд 17Бертолет тұзы - KCIO3
Алынуы: 3CI2 + 6KOH = KCI +
KCIO3 + 3H2O
Қасиеттері: KCIO3 – түссіз кристалдар, суда
жақсы ериді.
Тотықтырғыш қасиеті:
1. KCIO3 + C12H22O11 = 8KCI+12CO2+11H2O
2. Диспропорциялану реакциясы:
4KCIO3 = KCI + 3KCIO4
3. Ыдырау реакциясы:
2KCIO3 = 2KCI + 3O2 (катализатор MnO2)
4. Қышқылдармен ( T3 – қышқылдар)
KCIO3 + 6HCI = 3CI2 + 3H2O + KCI
Слайд 18HCIO4 - хлор қышқылы Т.Д.: + 5
Алынуы:
KCIO4 + H2SO4 = KHSO4 + HCIO4
Қасиеттері: HCIO4 –
түссіз,қопарылыс беретін сұйықтық.
1. Тотықтырғыш қасиеті:
4KI + 3HCIO4 = KIO3 + 3HСI
2. Ыдырау реакциясы:
HCIO4 = 4CIO2 + 3O2 + 2H2O
KCIO4 = KCI + 2O2
3. Қышқылдық қасиеті:
HCIO4 + KOH = KCIO4 + H2O
Слайд 19БРОМ мен ИОД -тың оттектік қосылыстары:
Алынуы:
I2 + 10HNO3(k)
2HIO3 + 10NO2 + 4H2O
I2 + 5CI2 +
6H2O 2HIO3 + 10HCI
3I2 + 10HNO3(C) 6HIO3 + 10NO + 2H2O
I2 + 2HCIO3 2HIO3 + CI2
Қасиеттері:
күшті тотықтырғыштар:2KBrO3 + I2 = 2KIO3 + Br2
Слайд 20Иодты қышқыл H5IO6 (HIO4 ·2H2O)
Алынуы:
5Ba(IO3)2 = Ba5(IO6)2 +
4I2 + 9O2
Ba5(IO6)2 + 5H2SO4 = 2H5IO6 + 5BaSO4
Қасиеттері: түссіз,
кристалдар, суда жақсы ериді.
Иодты қышқыл және иодаттар(тұздары) күшті тотықтырғыштар:
К5IO6 + 7KI + 6H2SO4 = 4I2 + 6 K2SO4 +6H2O