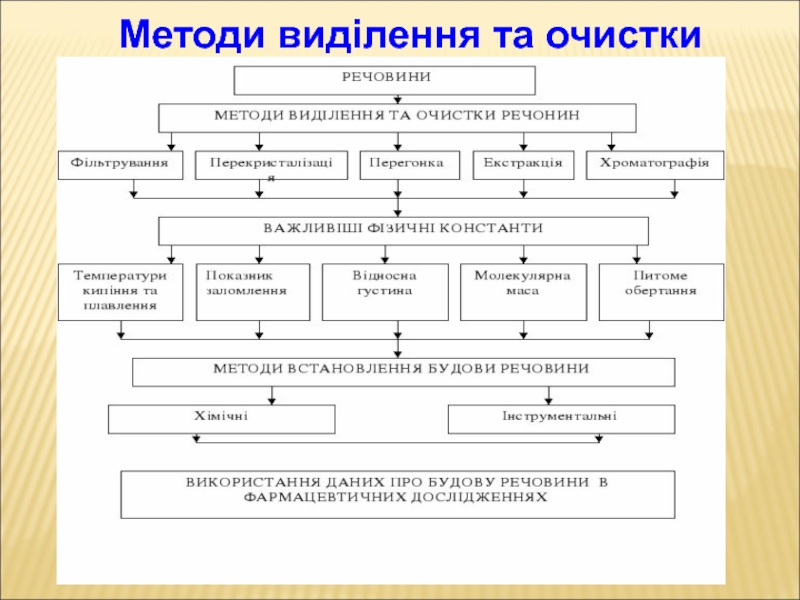
Слайд 1Vita brevis, ars longa –
життя коротке, наука обширна
Слайд 2Класифікація органічних сполук за будовою вуглецевого скелету та природою функціональних
груп.
Основні принципи будови назв органічних сполук за номенклатурою ІЮПАК.
Електронна будова хімічних зв’язків. Типи хімічних зв’язків в органічних сполуках. Види гібридизації атомних орбіталей вуглецю. Важливі характеристики σ- та π - зв’язків (довжина, енергія, помірність, здатність до поляризації).
Взаємний вплив атомів в органічних сполуках. Індуктивний ефект. Супряжені системи з відкритими та замкненими ланцюгами, види супряжень
Електронодонорні і електроноакцепторні замісники.
Загальна характеристика реакцій органічних сполук.
План
Слайд 3Предмет органічної хімії
Органічна хімія — це хімія сполук атома Карбону
та інших елементів ПС
Елементи Н, О, N, S, галогени –
називають органогенами.
Органічна хімія — це хімія вуглеводнів і їх похідних
Слайд 4Основні положення теорії будови органічних сполук (1861)
БУТЛЕРОВ
Олександр Михайлович
3(15) вересня 1828
р. –
5(17) серпня 1886 р.
Слайд 5Основні положення теорії будови органічних сполук (1861)
Атоми, що входять до
складу молекули органічних сполук, зв’язані між собою в суворо визначеному
порядку, згідно з їх валентністю. Послідовність зв’язування атомів у молекулі називається хімічною будовою.
Властивості речовини залежать не тільки від того, які атоми і в якій кількості входять до складу її молекули, але й від того, в якій послідовності вони зв’язані між собою, тобто від хімічної будови молекули.
Слайд 63. Атоми або групи атомів, які утворюють молекулу, як зв’язані
безпосередньо, так і зв’язані через інші атоми, взаємно впливають одні
на других, від чого залежить реакційна здатність молекули.
4. Вивчаючи реакційну здатність речовини, можна встановити її будову, і навпаки, за будовою речовини можна судити про її властивості.
Основні положення теорії будови органічних сполук (1861)
Слайд 7СКЛАД – БУДОВА – ВЛАСТИВОСТІ
Сучасне трактування:
Властивості складних речовин залежать від
якісного і кількісного складу і від хімічної будови, а також
від взаємного впливу атомів в молекулі.
Значення теорії будови органічних сполук
Зв’язок між будовою і властивостями стверджує пізнаваність органічних речовин і відкриває широку дорогу до вивчення синтезу і структури речовин. Дійсно, з основного положення теорії випливає, що вивчення властивостей речовин дає можливість знати будову і навпаки.
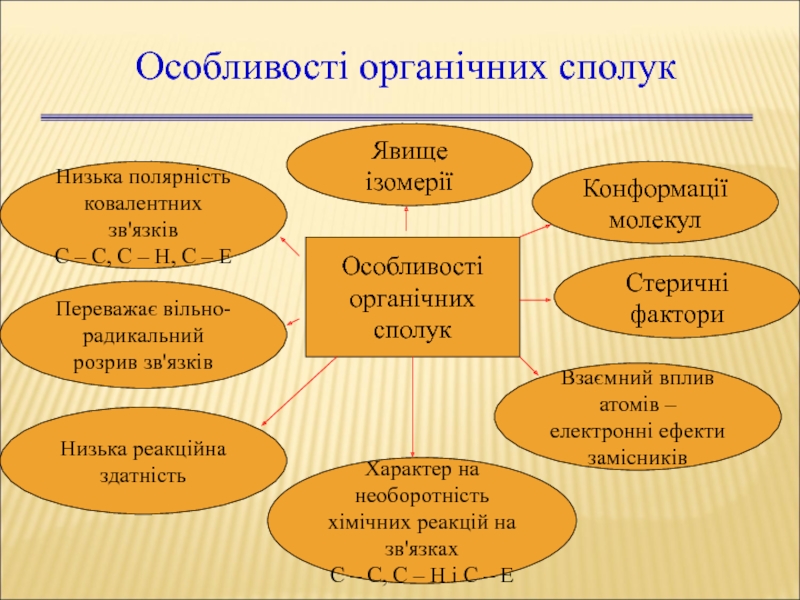
Слайд 8Особливості органічних сполук
Особливості
органічних сполук
Явище ізомерії
Конформації
молекул
Низька полярність
ковалентних зв'язків
С – С, С – Н, С – Е
Переважає вільно-
радикальний
розрив зв'язків
Низька реакційна
здатність
Стеричні фактори
Характер на необоротність
хімічних реакцій на зв'язках
С – С, С – Н і С – Е
Взаємний вплив атомів –
електронні ефекти
замісників
Слайд 9Основні положення теорії будови органічних сполук (1861)
Структурна формула — це
зображення послідовності зв'язування атомів в молекулі.
Брутто-формула – СН4О або
CH3OH
Структурна формула
Спрощені формули будови іноді називають раціональними
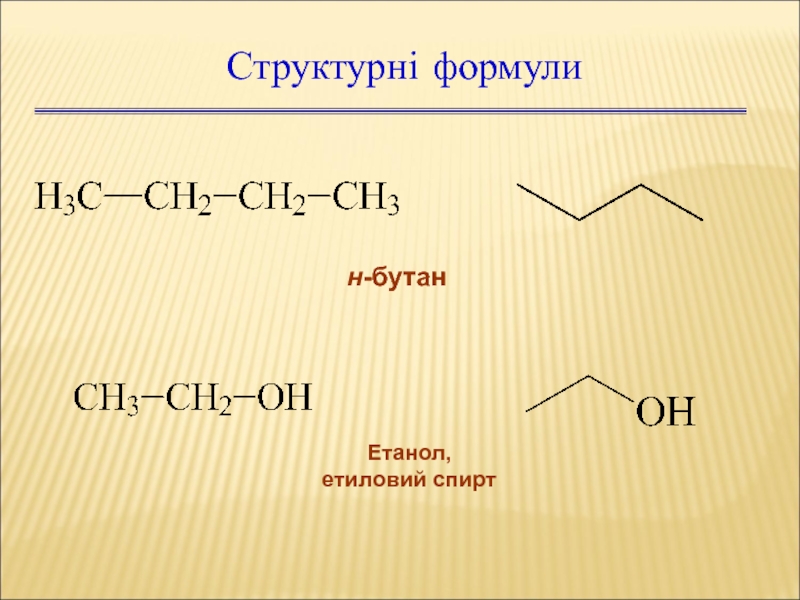
Слайд 10Структурні формули
н-бутан
Етанол,
етиловий спирт
Слайд 12Классификация органических соединений
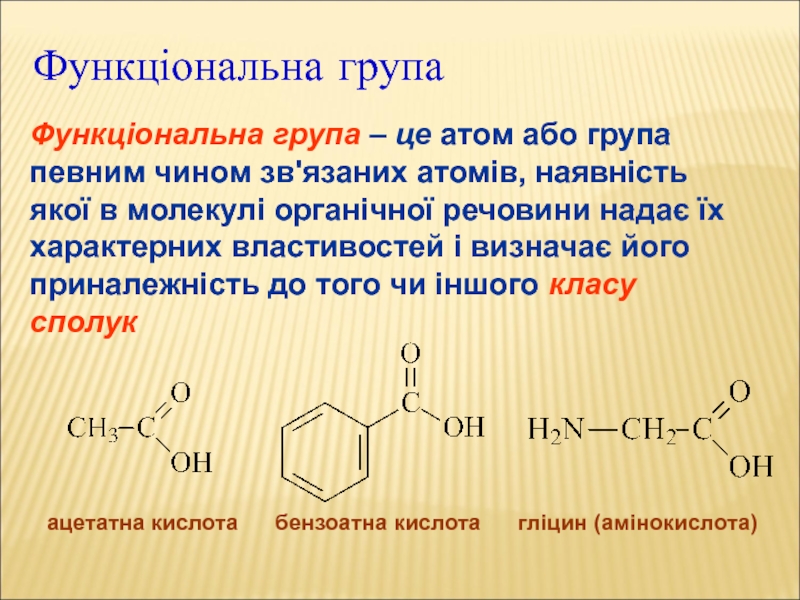
Слайд 13Функціональна група
Функціональна група – це атом або група певним чином
зв'язаних атомів, наявність якої в молекулі органічної речовини надає їх
характерних властивостей і визначає його приналежність до того чи іншого класу сполук
ацетатна кислота бензоатна кислота гліцин (амінокислота)
Слайд 14Классификация органических соединений
Слайд 15Классификация органических соединений
Слайд 16Класифікація органічних сполук
Сполуки можуть містити не одну, а декілька функціональних
груп. Якщо ці групи однакові, то такі сполуки називаються поліфункціональними.
хлороформ
гліцерин
Слайд 17Сполуки, що містять різні функціональні групи, називаються гетерофункціональними.
молочна кислота
коламін
Класифікація органічних сполук
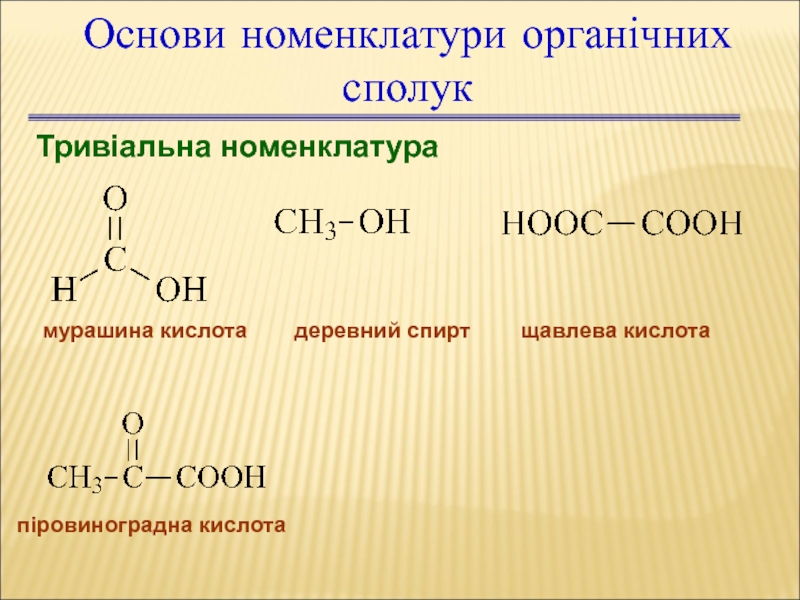
Слайд 18Основи номенклатури органічних сполук
Тривіальна номенклатура
мурашина кислота
деревний спирт
щавлева кислота
піровиноградна кислота
Слайд 19Барбітурова кислота
Іоганн Фрідріх Вільгельм Адольф фон Байєр
31.10.1835 – 20.08.1917
Основи номенклатури
органічних сполук
Тривіальна номенклатура
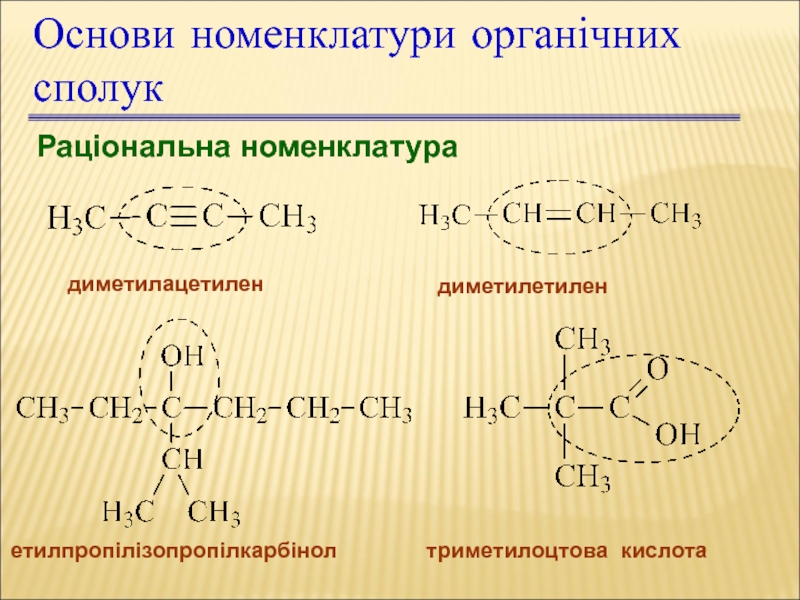
Слайд 20Раціональна номенклатура
диметилацетилен
диметилетилен
етилпропілізопропілкарбінол
триметилоцтова кислота
Основи номенклатури органічних сполук
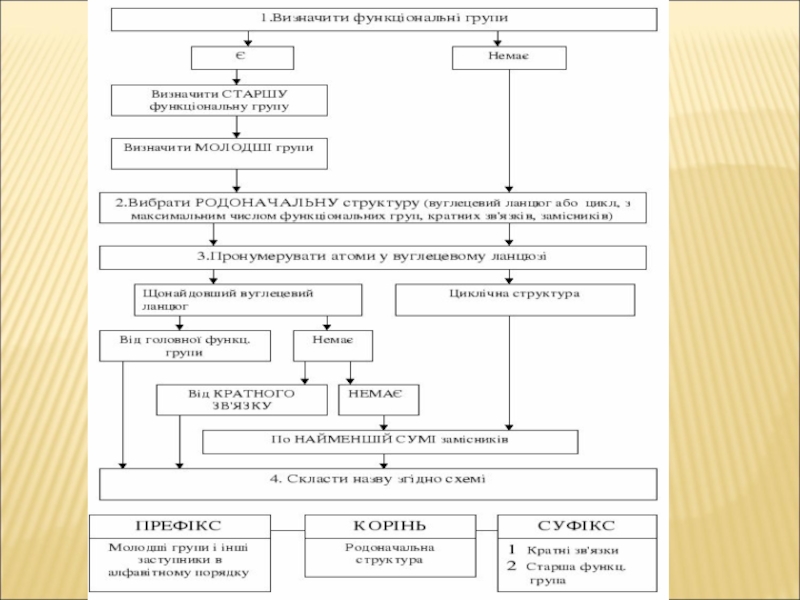
Слайд 21Систематична номенклатура ІЮПАК
ІЮПАК [від англійської назви Міжнародного союзу чистої і
прикладної хімії — International Union of Pure and Applied Chemistry
(IUPAC)]
Систематичні назви складені
зі слів, спеціально створених або вибраних для опису структурних особливостей сполук.
замісникова та радикально-функціональна
Основи номенклатури органічних сполук
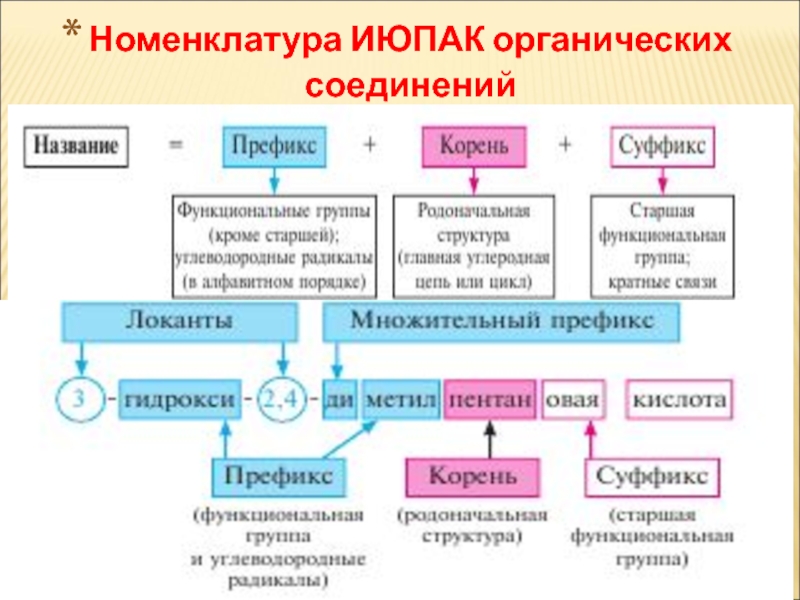
Слайд 23Номенклатура ИЮПАК органических соединений
Слайд 24Систематична номенклатура ІЮПАК
Основи номенклатури органічних сполук
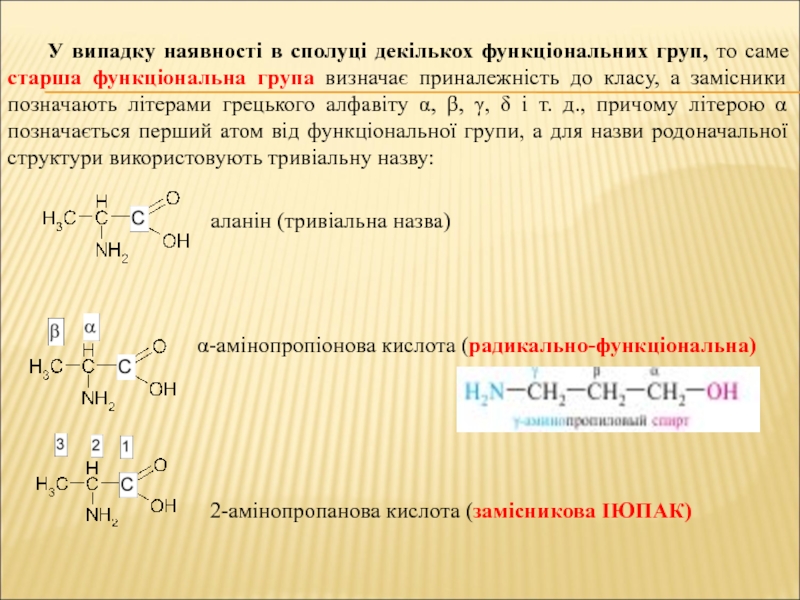
Слайд 25У випадку наявності в сполуці декількох функціональних груп, то саме
старша функціональна група визначає приналежність до класу, а замісники позначають
літерами грецького алфавіту , , , і т. д., причому літерою позначається перший атом від функціональної групи, а для назви родоначальної структури використовують тривіальну назву:
аланін (тривіальна назва)
-амінопропіонова кислота (радикально-функціональна)
2-амінопропанова кислота (замісникова ІЮПАК)
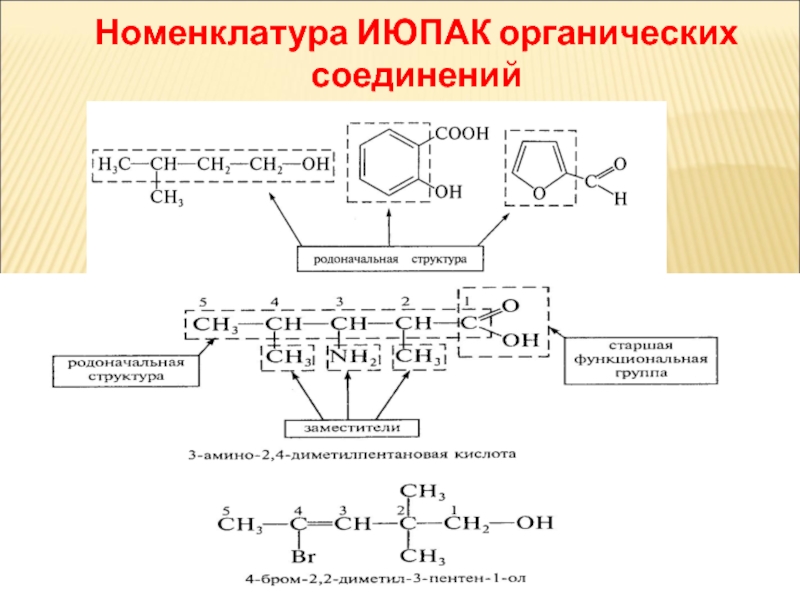
Слайд 26Номенклатура ИЮПАК органических соединений
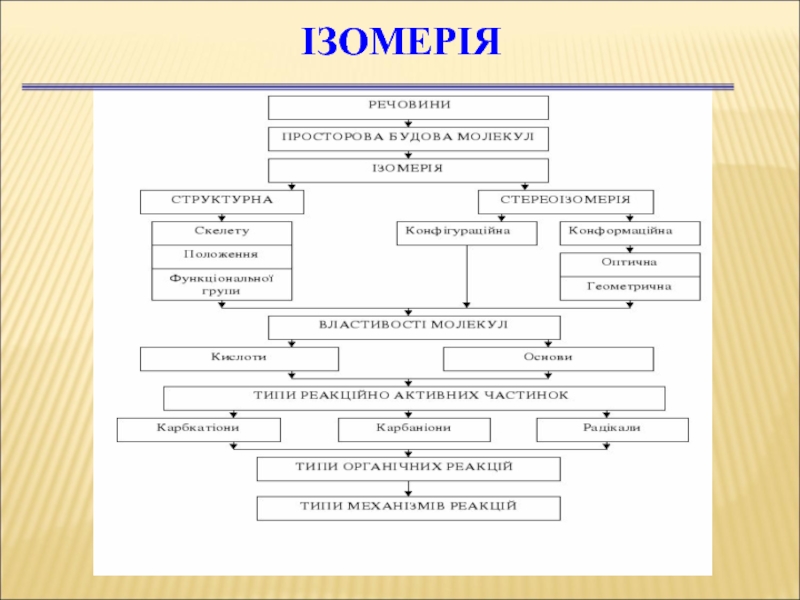
Слайд 27Ізомерія ОС
Ізомери — це речовини, які мають однаковий якісний і
кількісний склад (молекулярну формулу), але різну хімічну будову і, тому,
володіють різними властивостями.
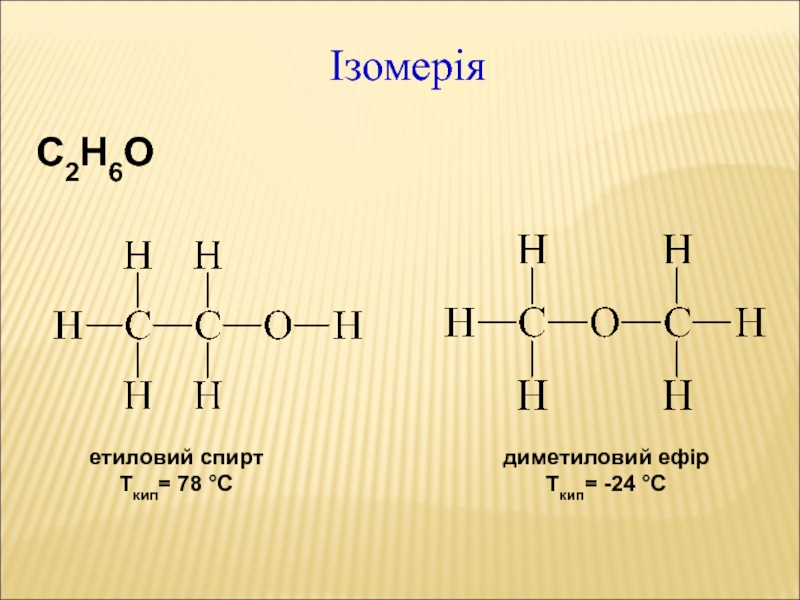
Слайд 30Ізомерія
С2Н6О
етиловий спирт
Ткип= 78 С
диметиловий ефір
Ткип= -24 С
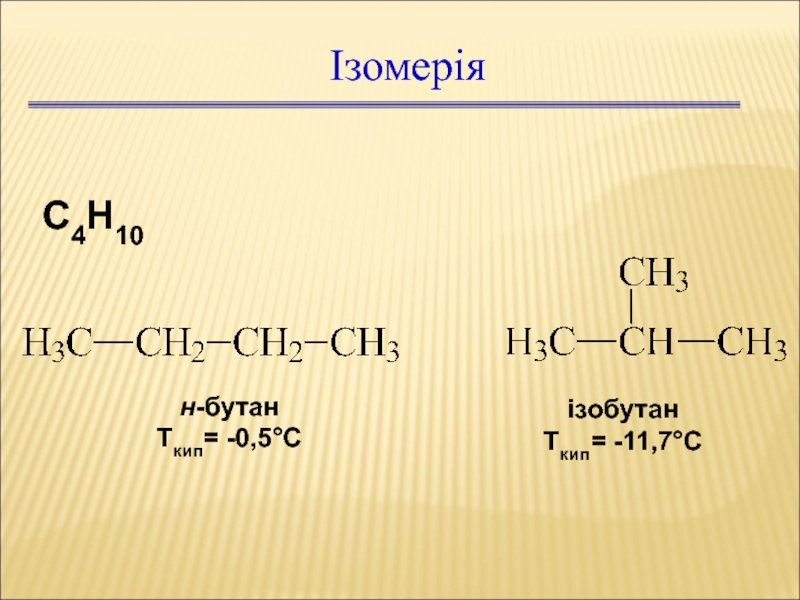
Слайд 31Ізомерія
С4Н10
н-бутан
Ткип= -0,5С
ізобутан
Ткип= -11,7С
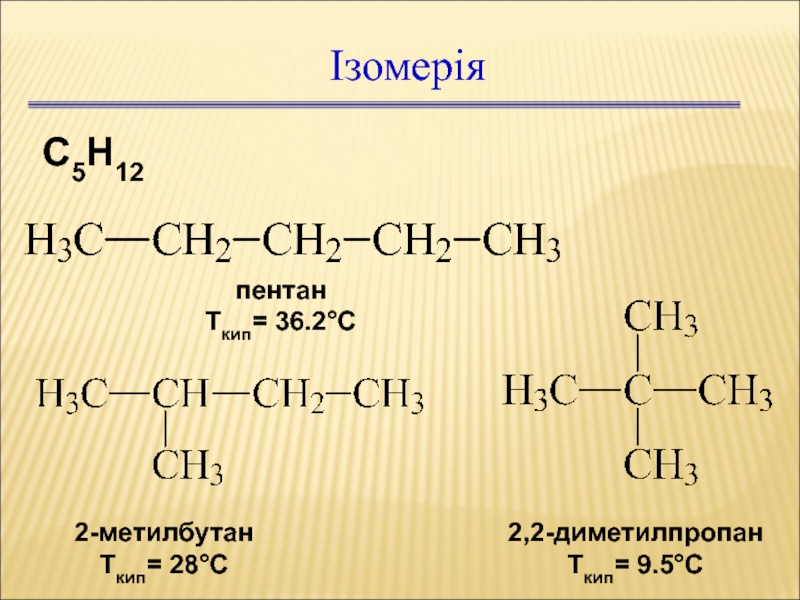
Слайд 32Ізомерія
С5Н12
пентан
Ткип= 36.2С
2-метилбутан
Ткип= 28С
2,2-диметилпропан
Ткип= 9.5С
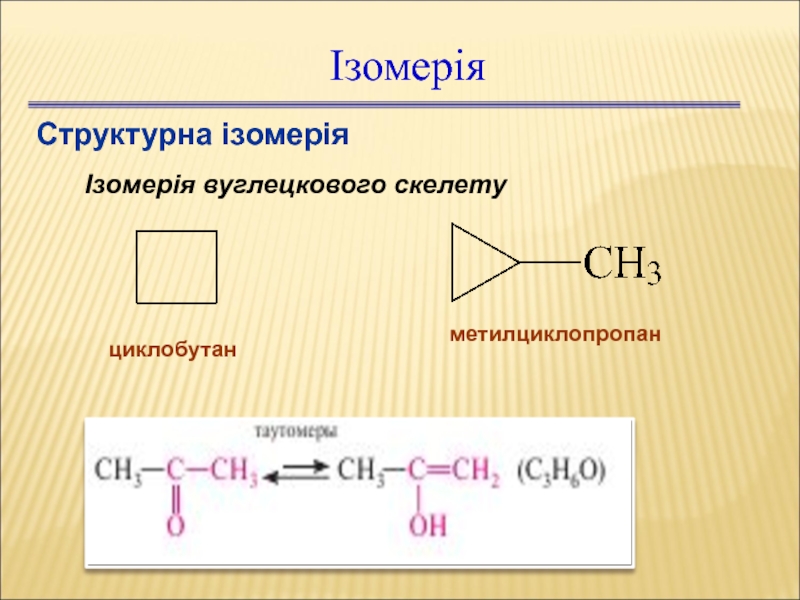
Слайд 33Ізомерія
Структурна ізомерія
Ізомерія вуглецкового скелету
циклобутан
метилциклопропан
Слайд 34Ізомерія
Структурна ізомерія
Ізомерія положення функціональної групи
бутанол-1
бутанол-2
бутен-1
бутен-2
Слайд 35Ізомерія
Структурна ізомерія
Ізомерія положення функціональної групи
дивінілацетилен
бензен
-амінопропіонова кислота
-амінопропіонова кислота
Слайд 36Гомологи
Групи органічних сполук однотипної структури з однаковими функціональними групами, що
відрізняються один від одного на одну або декілька груп CH2
у вуглецевому ланцюгу, складають гомологічний ряд.
Гомологічний ряд метана
Слайд 37Гомологи
Гомологічний ряд ізобутану
Гомологічний ряд метанолу
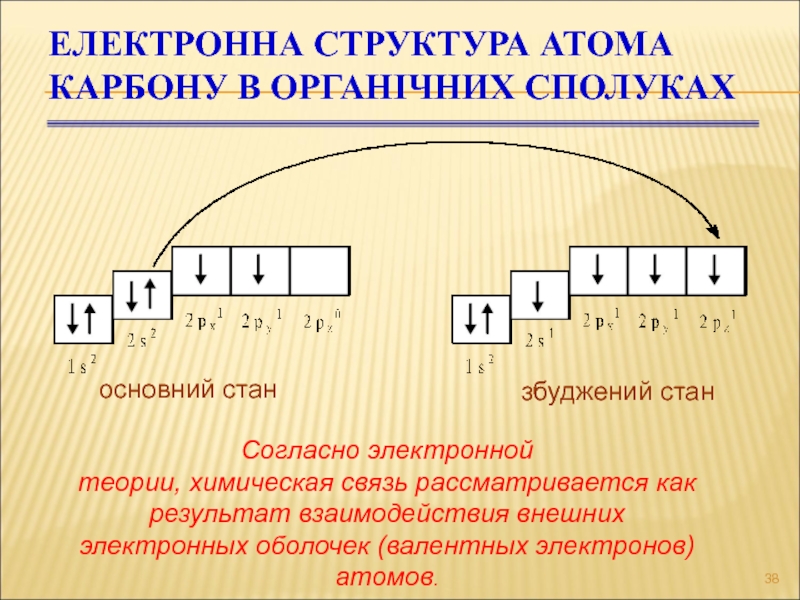
Слайд 38Електронна структура атома Карбону в органічних сполуках
основний стан
збуджений стан
Согласно
электронной
теории, химическая связь рассматривается как результат взаимодействия внешних
электронных
оболочек (валентных электронов) атомов.
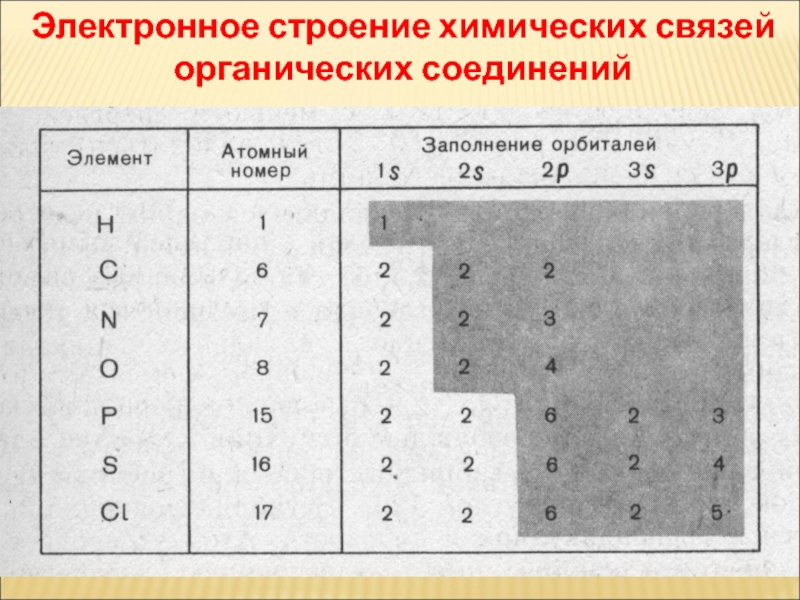
Слайд 40Электронное строение химических связей органических соединений
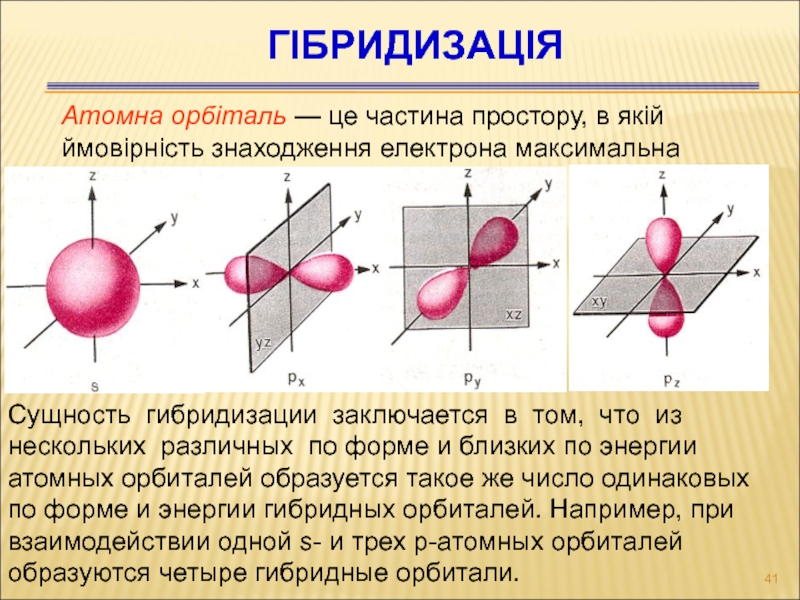
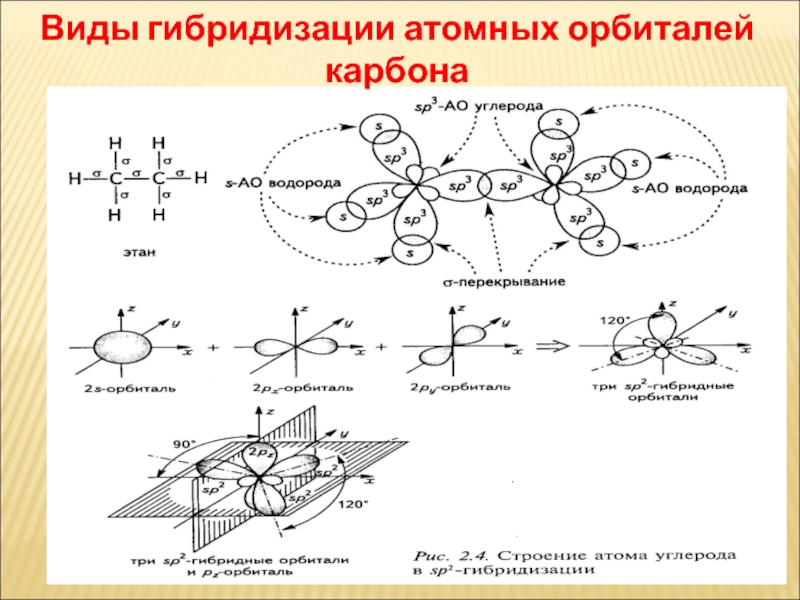
Слайд 41Гібридизація
Атомна орбіталь — це частина простору, в якій ймовірність
знаходження електрона максимальна
Сущность гибридизации заключается в том, что из нескольких
различных по форме и близких по энергии атомных орбиталей образуется такое же число одинаковых по форме и энергии гибридных орбиталей. Например, при взаимодействии одной s- и трех р-атомных орбиталей образуются четыре гибридные орбитали.
Слайд 42Виды гибридизации атомных орбиталей карбона
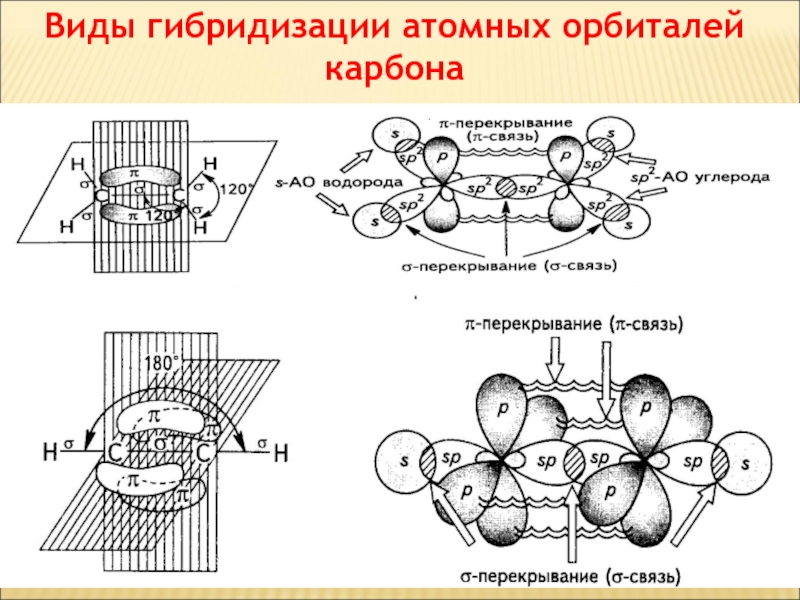
Слайд 43Виды гибридизации атомных орбиталей карбона
Слайд 44Гібридизація
Гібридні орбіталі і характер атомів Карбону
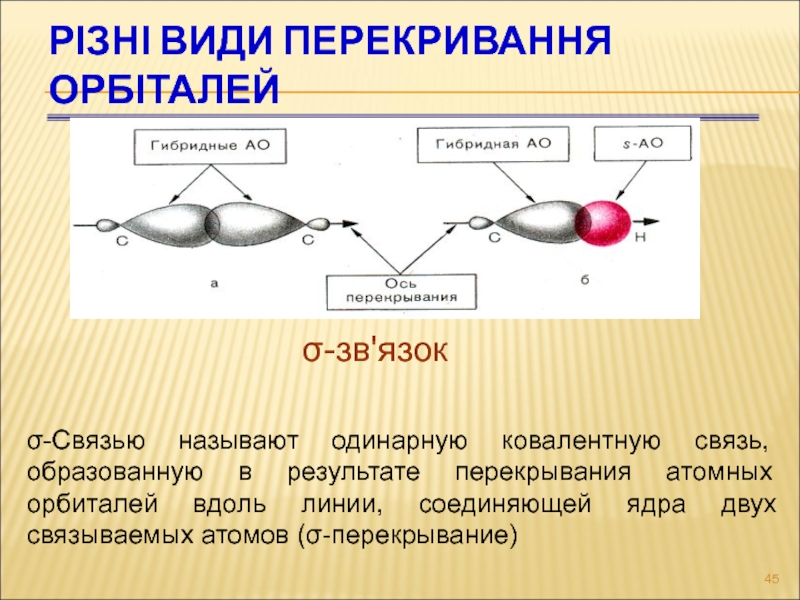
Слайд 45Різні види перекривання орбіталей
-зв'язок
σ-Связью называют одинарную ковалентную связь, образованную
в результате перекрывания атомных орбиталей вдоль линии, соединяющей ядра двух
связываемых атомов (σ-перекрывание)
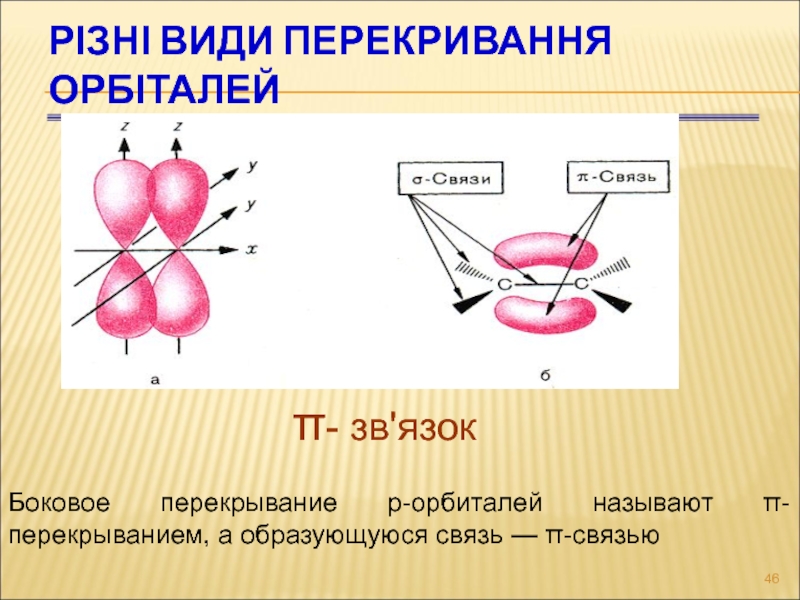
Слайд 46Різні види перекривання орбіталей
- зв'язок
Боковое перекрывание р-орбиталей называют π-перекрыванием,
а образующуюся связь — π-связью
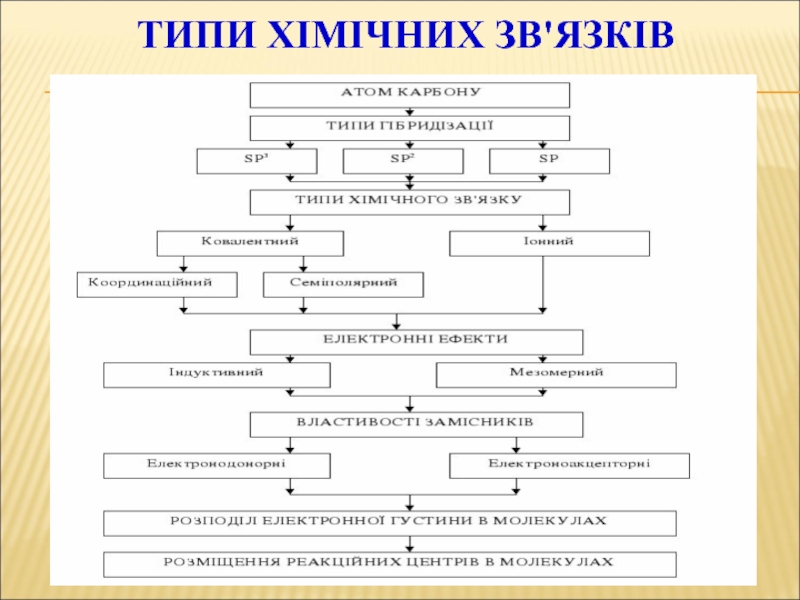
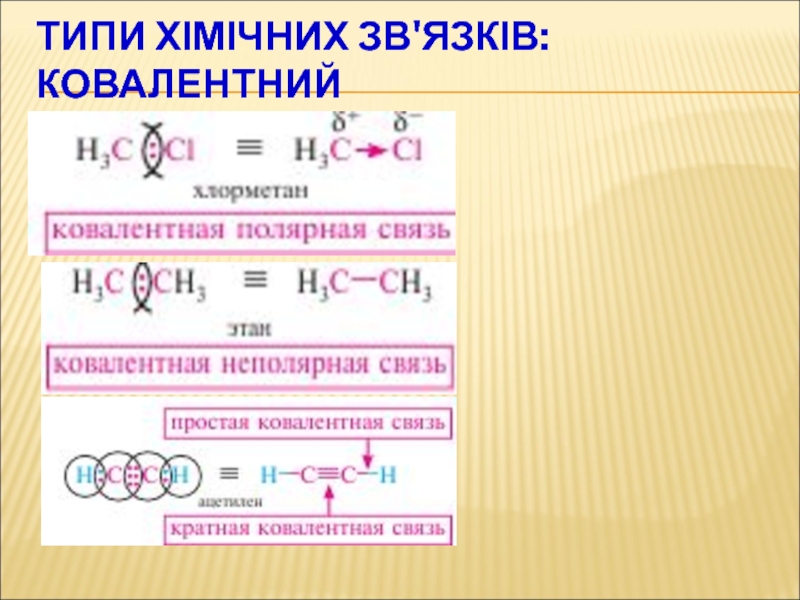
Слайд 47Типи хімічних зв'язків:КОВАЛЕНТНИЙ
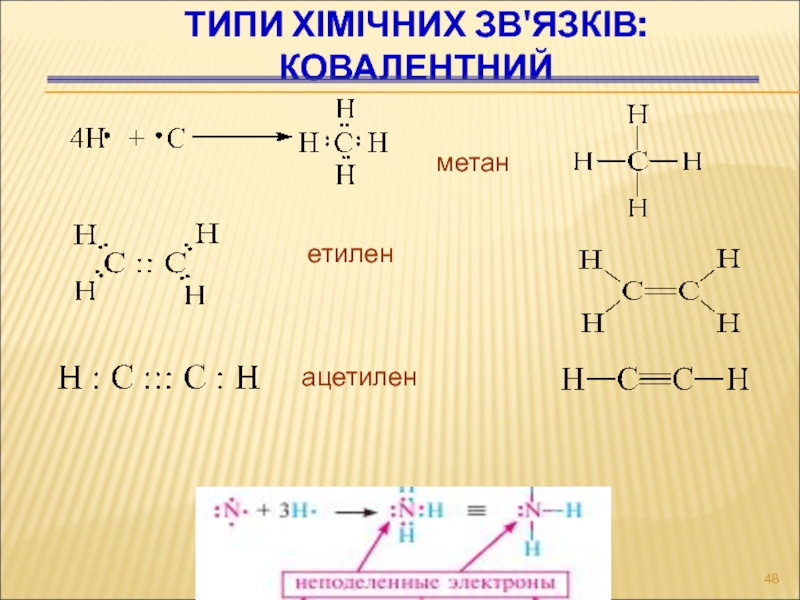
Слайд 48Типи хімічних зв'язків:
КОВАЛЕНТНИЙ
метан
етилен
ацетилен
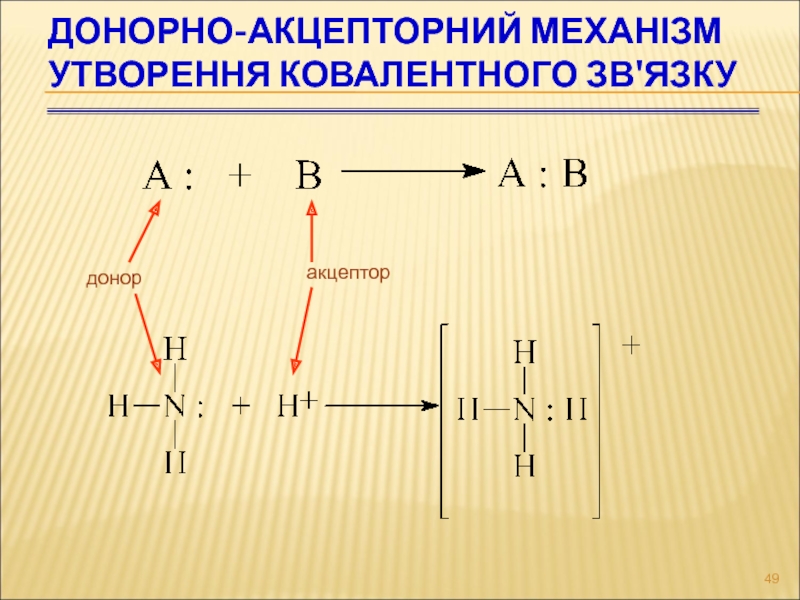
Слайд 49Донорно-акцепторний механізм утворення ковалентного зв'язку
донор
акцептор
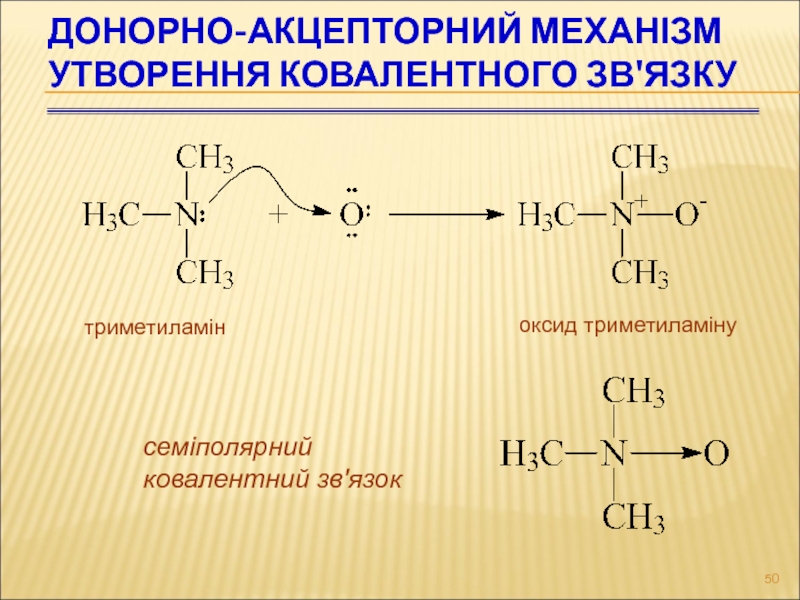
Слайд 50Донорно-акцепторний механізм утворення ковалентного зв'язку
триметиламін
оксид триметиламіну
семіполярний
ковалентний зв'язок
Слайд 51Властивості ковалентного зв'язку
Ковалентний зв'язок характеризується такими параметрами: насиченістю, полярністю, поляризованістю,
довжиною, енергією і направленістю в просторі (кутами між зв'язками).
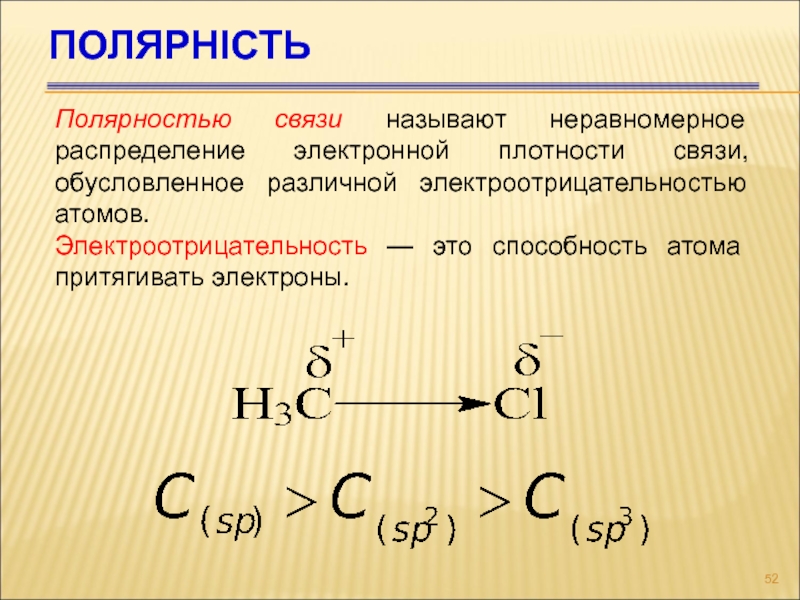
Слайд 52Полярність
Полярностью связи называют неравномерное распределение электронной плотности связи, обусловленное различной
электроотрицательностью атомов.
Электроотрицательность — это способность атома притягивать электроны.
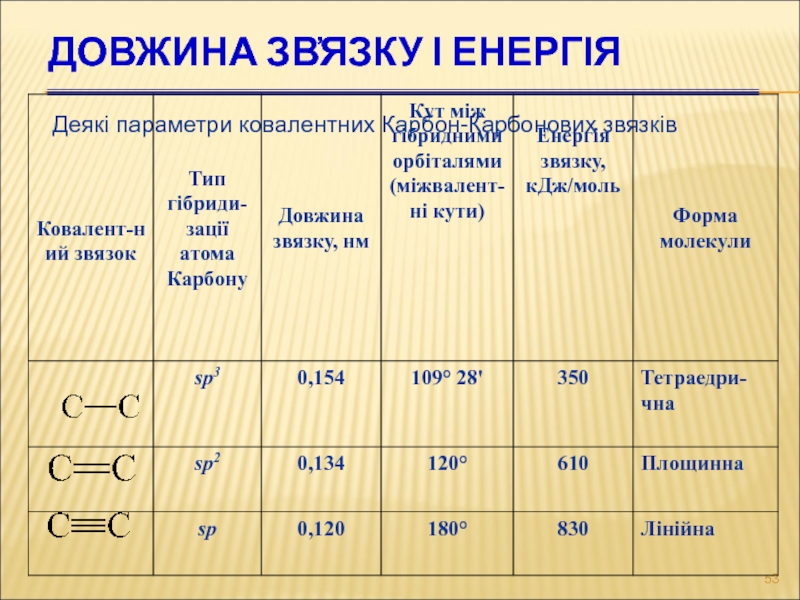
Слайд 53Довжина зв҆язку і енергія
Деякі параметри ковалентних Карбон-Карбонових звязків
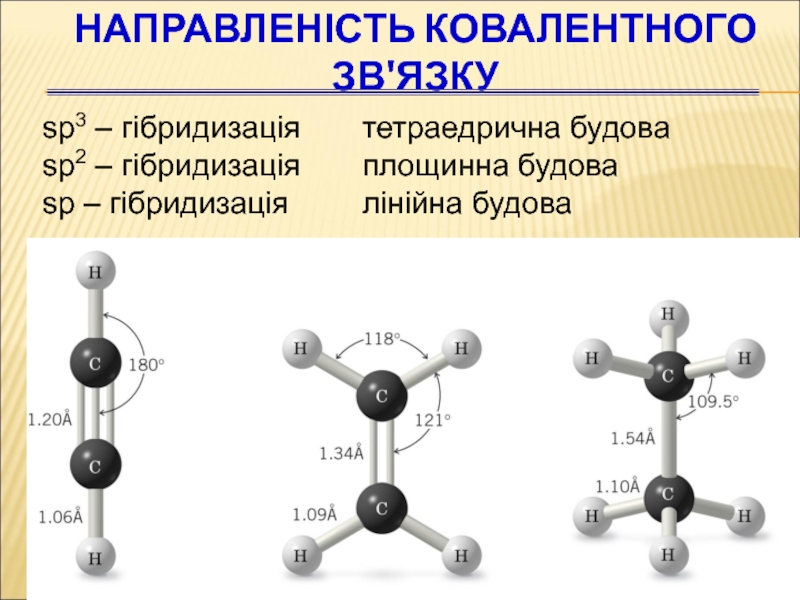
Слайд 54Направленість ковалентного зв'язку
sp3 – гібридизація тетраедрична будова
sp2 – гібридизація
площинна будова
sp – гібридизація
лінійна будова
Слайд 55Типи хімічних зв'язків:
Водневий зв'язок
12,5—20 кДж/моль
Водородная связь образуется в результате
электростатического взаимодействия между активными атомами водорода в молекуле и атомами
с неподеленной электронной парой (—O—, —N—, —F , реже —S—, —Cl ) в этой же или в другой молекуле.
Активными называют атомы водорода, связанные в молекуле сильно полярной ковалентной связью,
Слайд 56Вчення про взаємний вплив атомів у молекулі
Бутлеров Олександр Михайлович
1828–1886
В органических
соединениях различают два вида электронных смещений:
смещение электронной плотности по
цепи σ-связей — индуктивный эффект;
смещение по системе π-связей — мезомерный эффект.
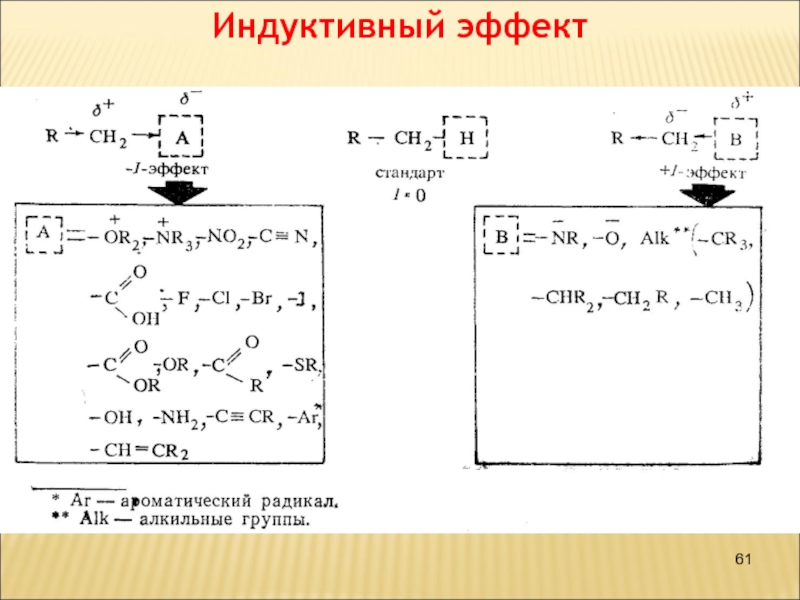
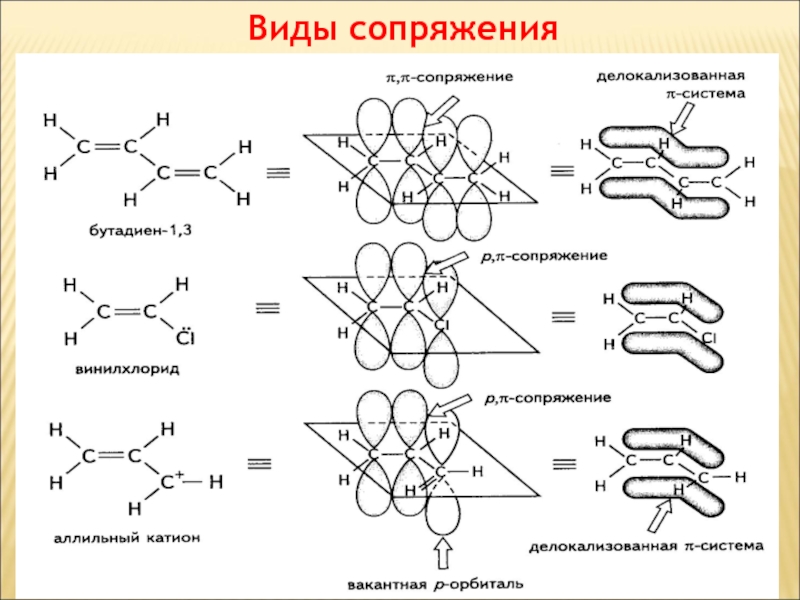
Слайд 57Взаємний вплив атомів в молекулі
Індуктивний ефект
Зміщення електронної густини
по лінії - зв'язків називається індуктивним ефектом і позначається буквою
I.
Слайд 58Взаємний вплив атомів в молекулі
Індуктивний ефект
Електроноакцепторні замісники – це атом
або група атомів, що зміщують електронну густину -звязку від атома
Карбону, проявляють негативний індуктивний ефект (-I-ефект).
Електронодонорні замісники – це атом або група атомів, що зміщують електронну густину -звязку до атома Карбону, проявляють позитивний індуктивний ефект (+I-ефект).
Слайд 59Взаємний вплив атомів в молекулі
Індуктивний ефект
1. Индуктивный эффект проявляется всегда
при наличии в молекуле атомов
с различной электроотрицательностью.
2. Индуктивный эффект
распространяется только через σ-связи и всегда
в одном направлении.
3. Индуктивный эффект затухает в цепи через 3—4 σ-связи.
Слайд 60Взаємний вплив атомів в молекулі
Індуктивний ефект
+I-Ефект проявляють аліфатичні вуглеводневі
радикали, наприклад, алкільні радикали (–CH3, –C2H5 і т. д.).
Більшість функціональних
груп проявляють -I-ефект: –Hal, –NH2, –OH, >С=O, –COOH.
пропен
Слайд 62Взаємний вплив атомів в молекулі
Мезомерний ефект (ефект спряження)
Делокалізований зв'язок
Сопряженной называют систему, состоящую из чередующихся простых и кратных связей,
или же когда рядом с углеродным атомом, образующим кратную связь, находится атом, р-АО которого заполнена одним электроном, двумя или вакантна.
Сопряжение связей обусловливает образование единого делокализованного электронного облака.
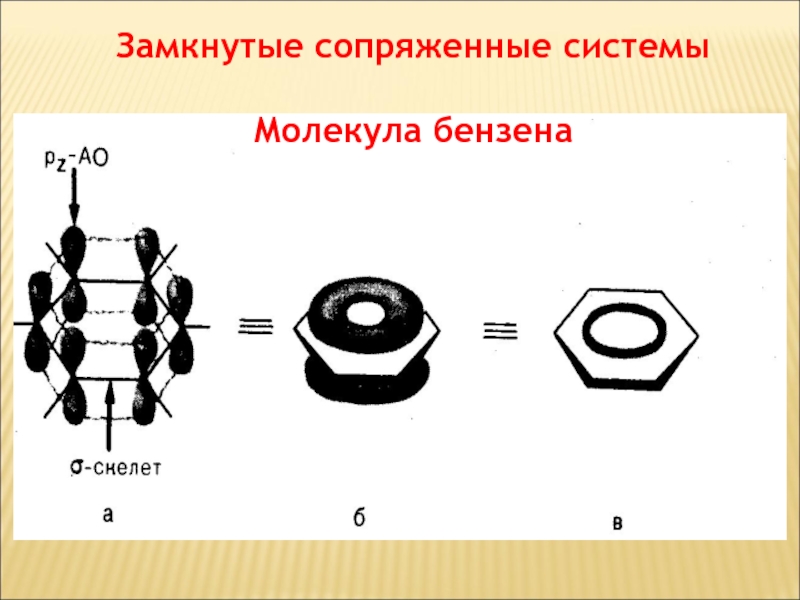
Слайд 64Замкнутые сопряженные системы
Молекула бензена
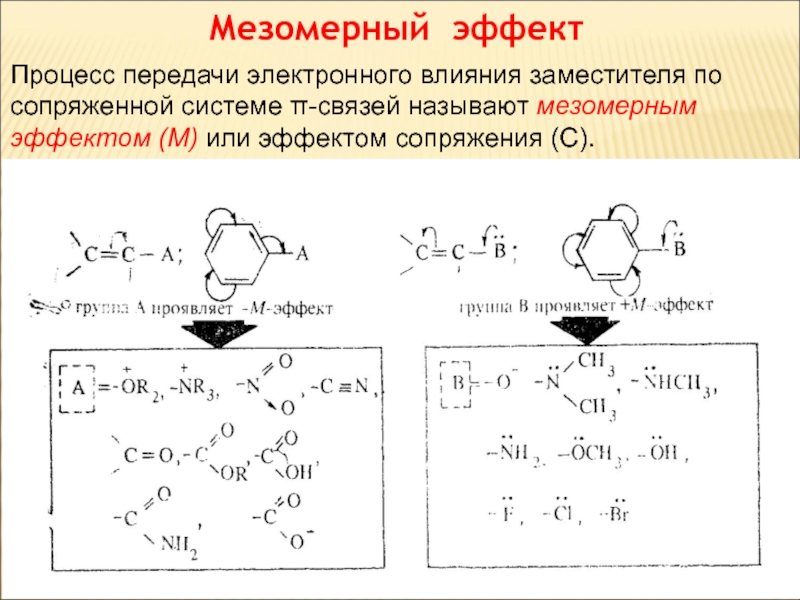
Слайд 65Мезомерный эффект
Процесс передачи электронного влияния заместителя по сопряженной системе π-связей
называют мезомерным эффектом (М) или эффектом сопряжения (С).
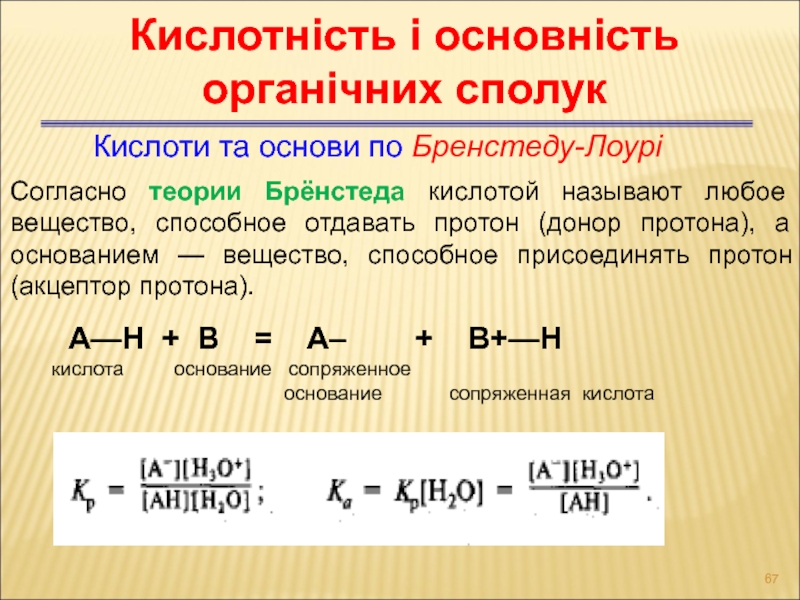
Слайд 67Кислоти та основи по Бренстеду-Лоурі
Кислотність і основність органічних сполук
Согласно теории
Брёнстеда кислотой называют любое вещество, способное отдавать протон (донор протона),
а основанием — вещество, способное присоединять протон (акцептор протона).
А—Н + B = А– + В+—Н
кислота основание cопряженное
основание сопряженная кислота
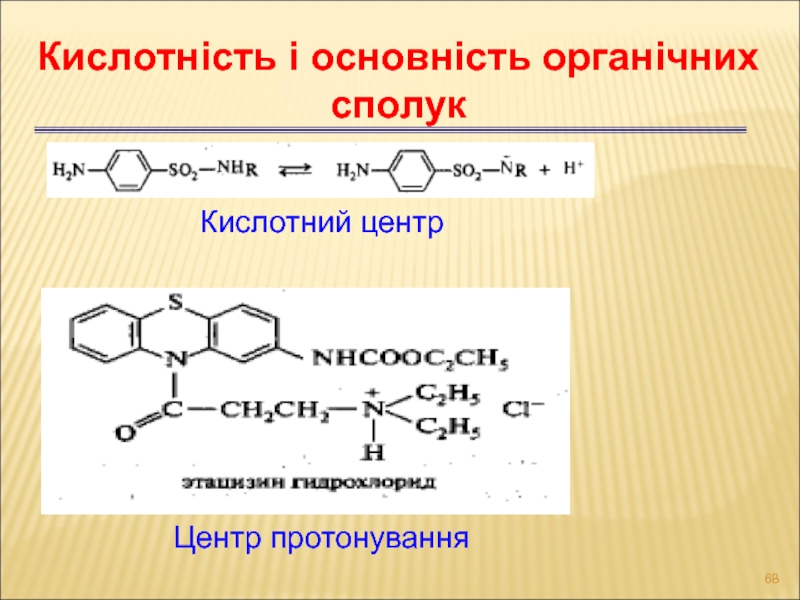
Слайд 68Центр протонування
Кислотність і основність органічних сполук
Кислотний центр
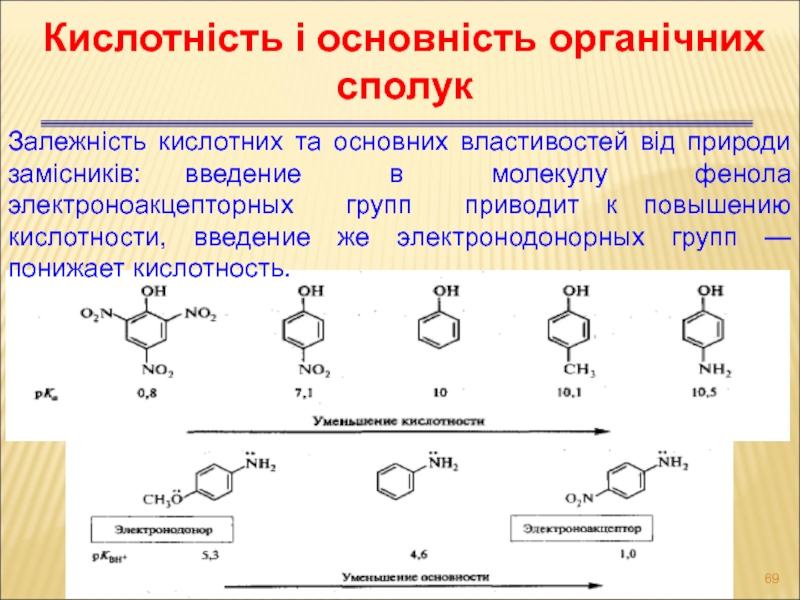
Слайд 69Кислотність і основність органічних сполук
Залежність кислотних та основних властивостей від
природи замісників: введение в молекулу фенола электроноакцепторных групп приводит к
повышению кислотности, введение же электронодонорных групп — понижает кислотность.
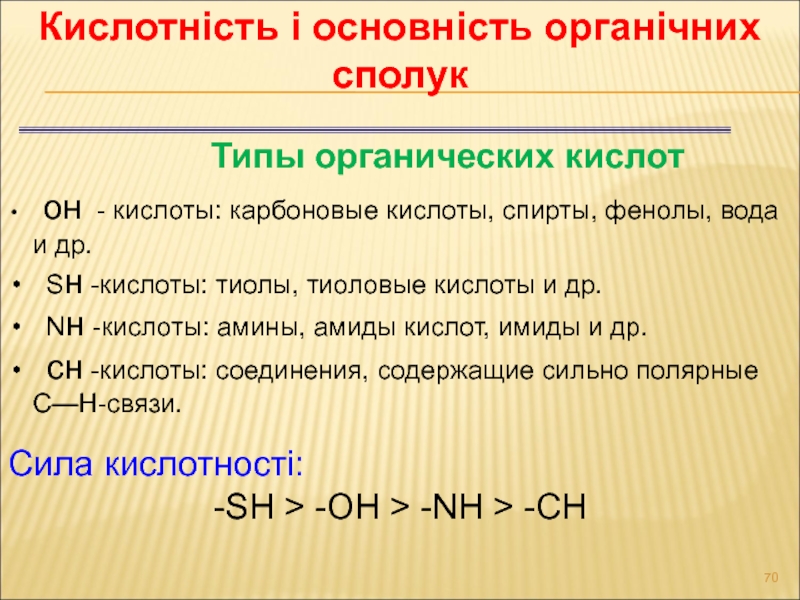
Слайд 70Кислотність і основність органічних сполук
Сила кислотності:
-SH > -OH >
-NH > -CH
Типы органических кислот
он - кислоты: карбоновые кислоты,
спирты, фенолы, вода и др.
Sн -кислоты: тиолы, тиоловые кислоты и др.
Nн -кислоты: амины, амиды кислот, имиды и др.
сн -кислоты: соединения, содержащие сильно полярные С—Н-связи.
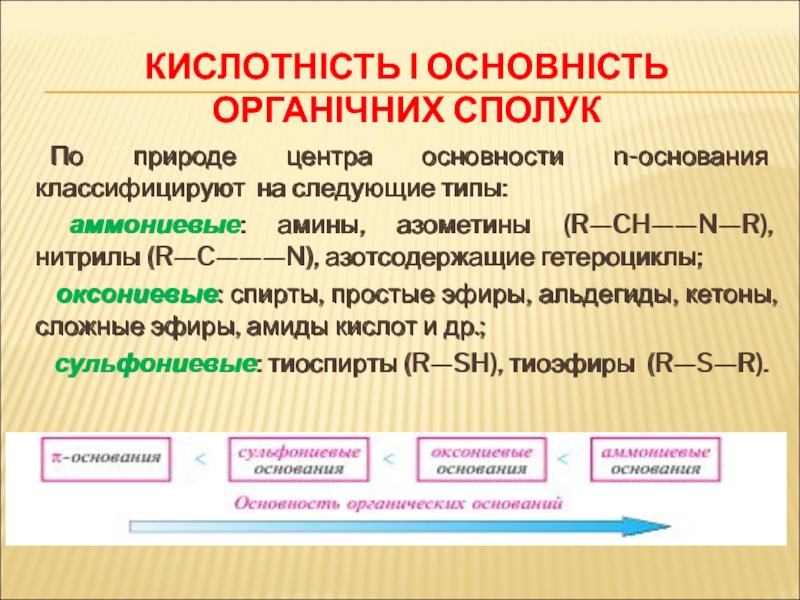
Слайд 71Кислотність і основність органічних сполук
По природе центра основности n-основания
классифицируют на следующие типы:
аммониевые: амины, азометины (R—CH——N—R), нитрилы (R—C———N),
азотсодержащие гетероциклы;
оксониевые: спирты, простые эфиры, альдегиды, кетоны, сложные эфиры, амиды кислот и др.;
сульфониевые: тиоспирты (R—SH), тиоэфиры (R—S—R).
По природе центра основности n-основания классифицируют на следующие типы:
аммониевые: амины, азометины (R—CH——N—R), нитрилы (R—C———N), азотсодержащие гетероциклы;
оксониевые: спирты, простые эфиры, альдегиды, кетоны, сложные эфиры, амиды кислот и др.;
сульфониевые: тиоспирты (R—SH), тиоэфиры (R—S—R).
Слайд 72Кислотність і основність органічних сполук
Кислоти та основи Льюїса
основание
— любая частица (атом, молекула или анион), способная отдавать электронную
пару для образования ковалентной связи, а кислота — любая частица (атом, молекула, катион), способная принимать пару электронов с образованием ковалентной связи
Слайд 73Основание по теории Льюиса является донором, а кислота — акцептором
пары электронов
Слайд 74Кислотність і основність органічних сполук
Легкость протекания кислотно-основной реакции определяется силой
кислоты и основания, а также жесткостью или мягкостью кислоты и
основания. Представление о жестких и мягких кислотах и основаниях (ЖМКО), введено Р. Пирсоном
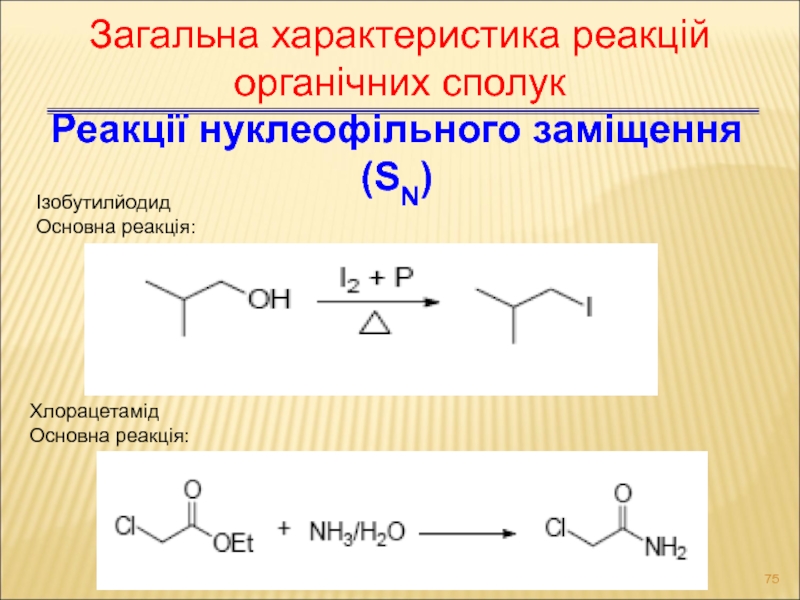
Слайд 75Реакції нуклеофільного заміщення (SN)
Ізобутилйодид
Основна реакція:
Хлорацетамід
Основна реакція:
Загальна характеристика реакцій
органічних сполук
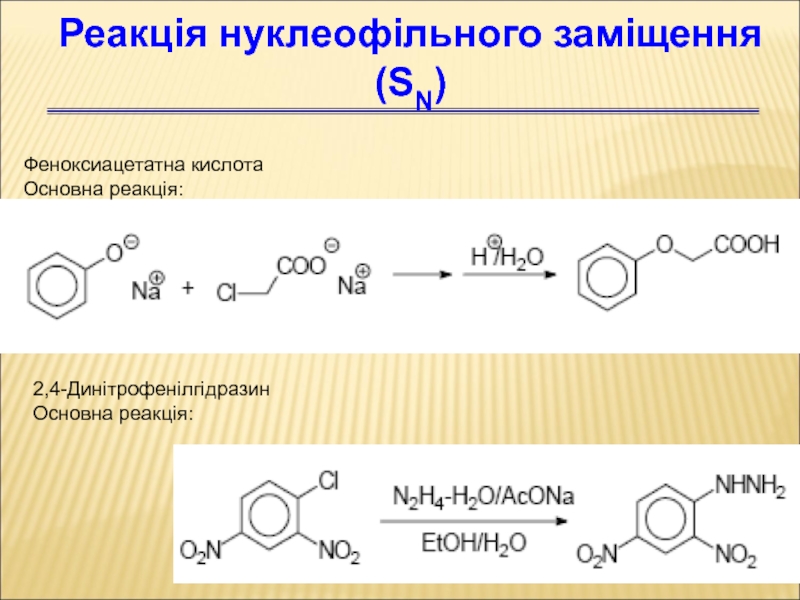
Слайд 76Феноксиацетатна кислота
Основна реакція:
Реакція нуклеофільного заміщення (SN)
2,4-Динітрофенілгідразин
Основна реакція:
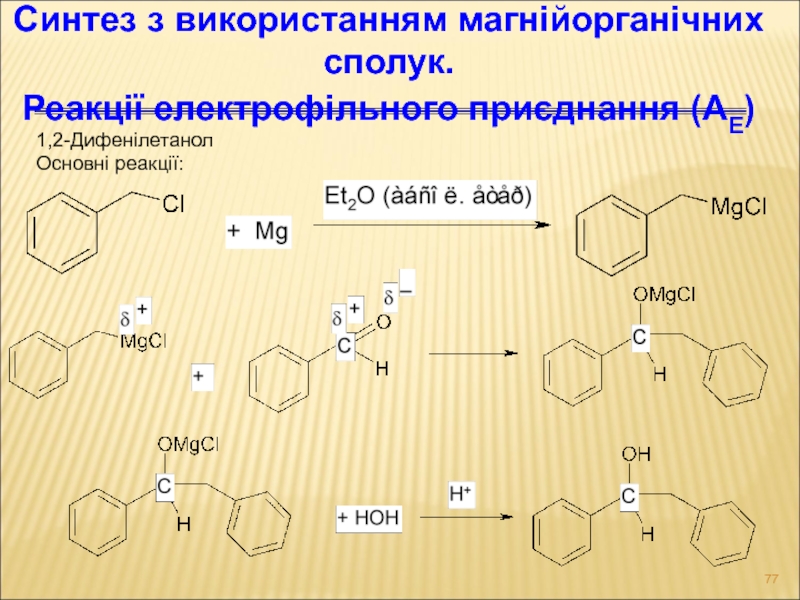
Слайд 771,2-Дифенілетанол
Основні реакції:
Синтез з використанням магнійорганічних сполук.
Реакції електрофільного приєднання (АЕ)
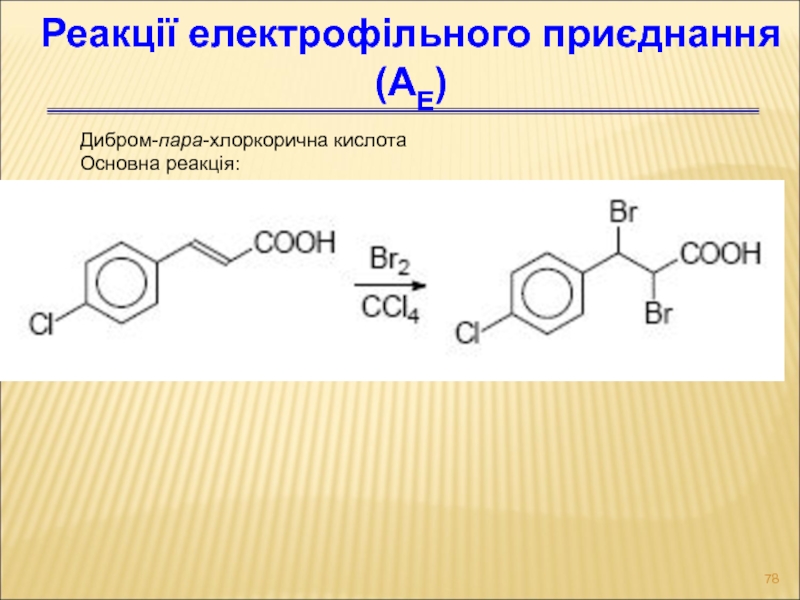
Слайд 78Дибром-пара-хлоркорична кислота
Основна реакція:
Реакції електрофільного приєднання (АЕ)
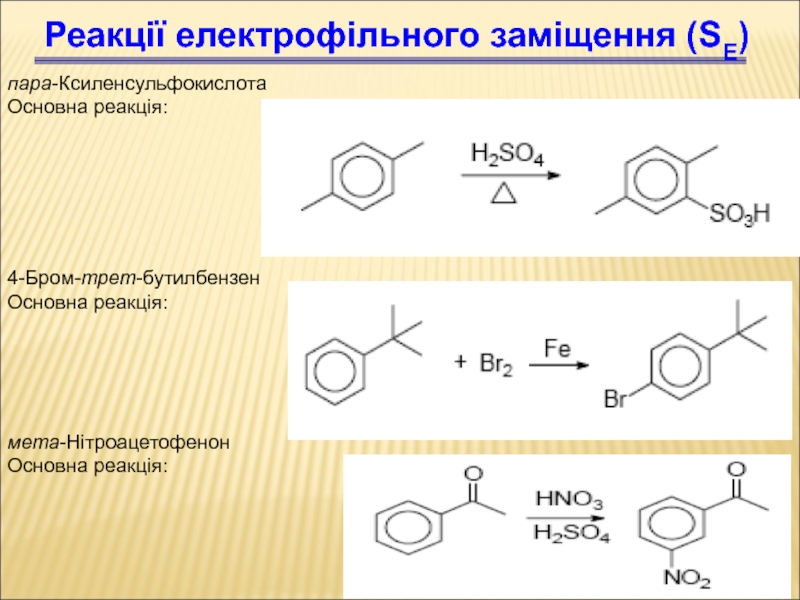
Слайд 79пара-Ксиленсульфокислота
Основна реакція:
Реакції електрофільного заміщення (SЕ)
4-Бром-трет-бутилбензен
Основна реакція:
мета-Нітроацетофенон
Основна реакція:
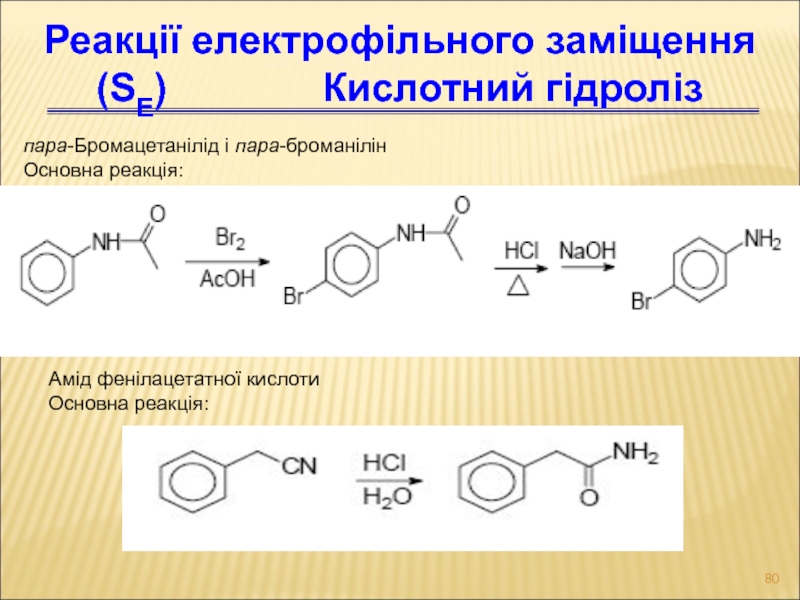
Слайд 80пара-Бромацетанілід і пара-броманілін
Основна реакція:
Реакції електрофільного заміщення (SЕ)
Кислотний гідроліз
Амід фенілацетатної кислоти
Основна реакція:
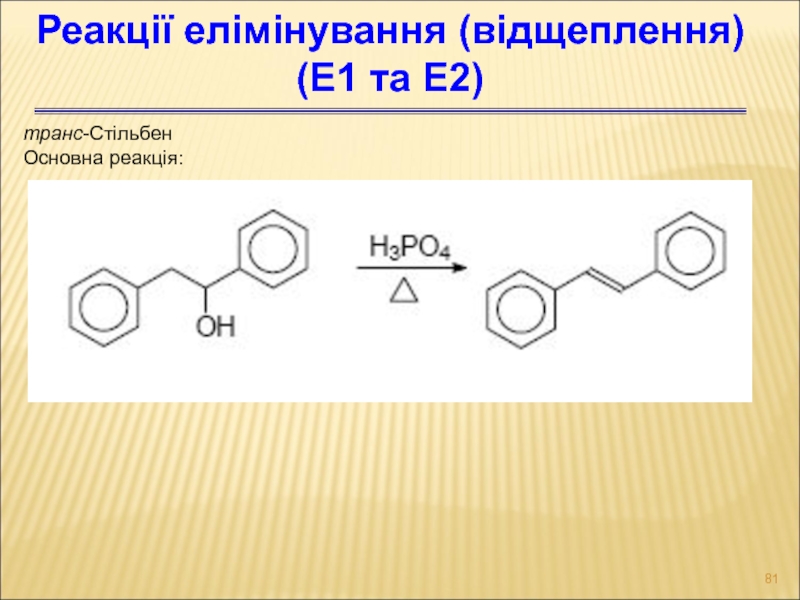
Слайд 81транс-Стільбен
Основна реакція:
Реакції елімінування (відщеплення)
(Е1 та Е2)
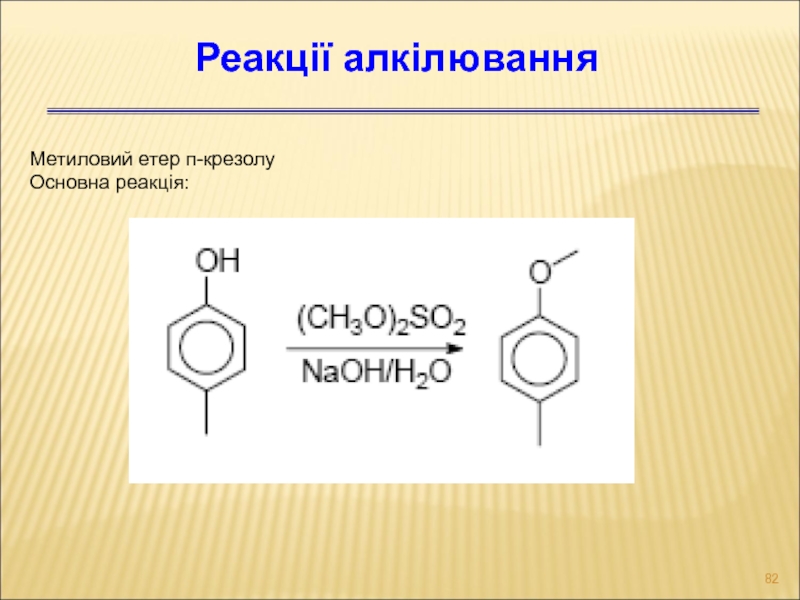
Слайд 82Метиловий етер п-крезолу
Основна реакція:
Реакції алкілювання
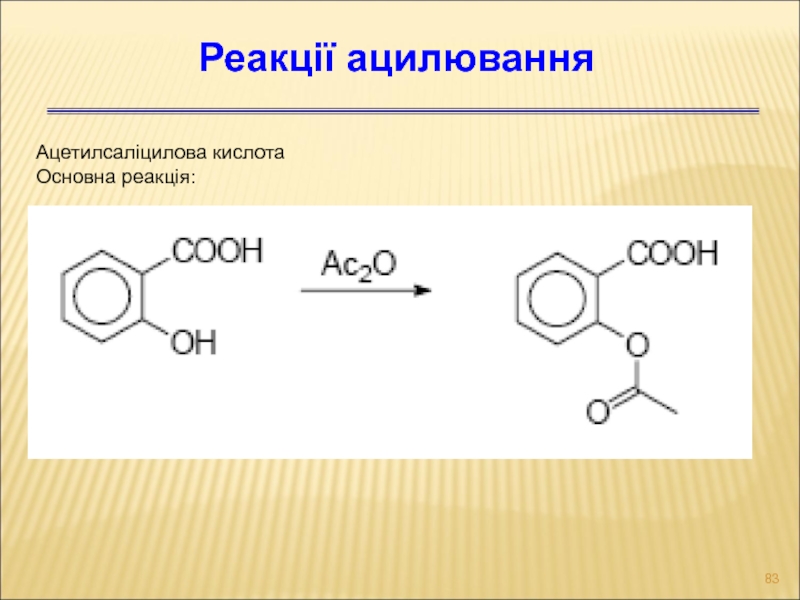
Слайд 83Ацетилсаліцилова кислота
Основна реакція:
Реакції ацилювання
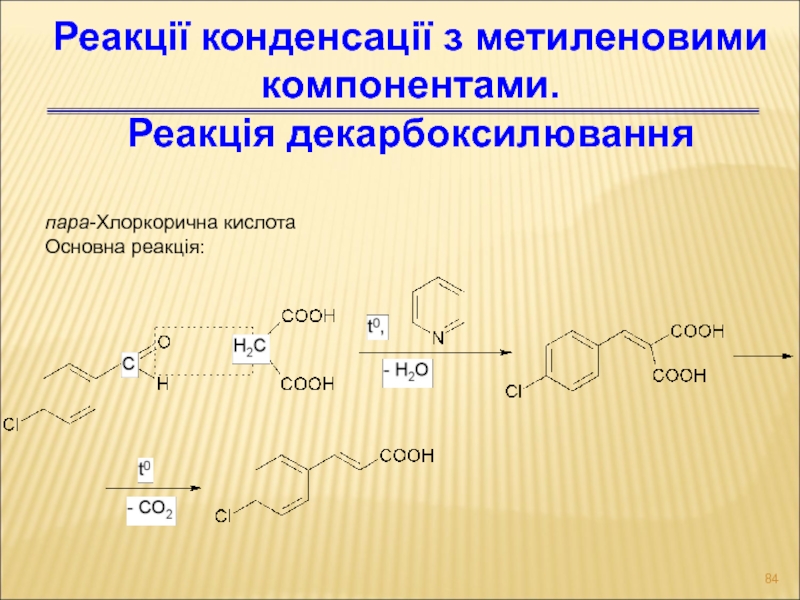
Слайд 84пара-Хлоркорична кислота
Основна реакція:
Реакції конденсації з метиленовими компонентами.
Реакція декарбоксилювання
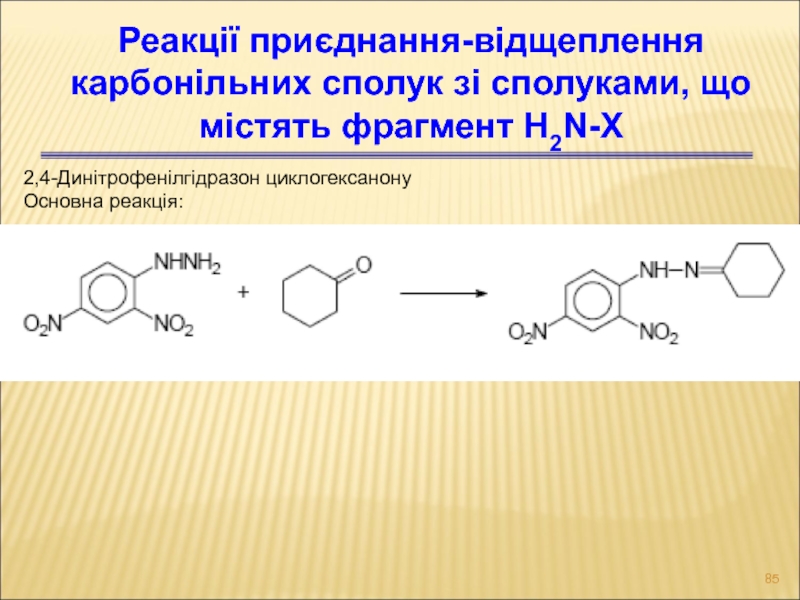
Слайд 852,4-Динітрофенілгідразон циклогексанону
Основна реакція:
Реакції приєднання-відщеплення карбонільних сполук зі сполуками, що містять
фрагмент H2N-X
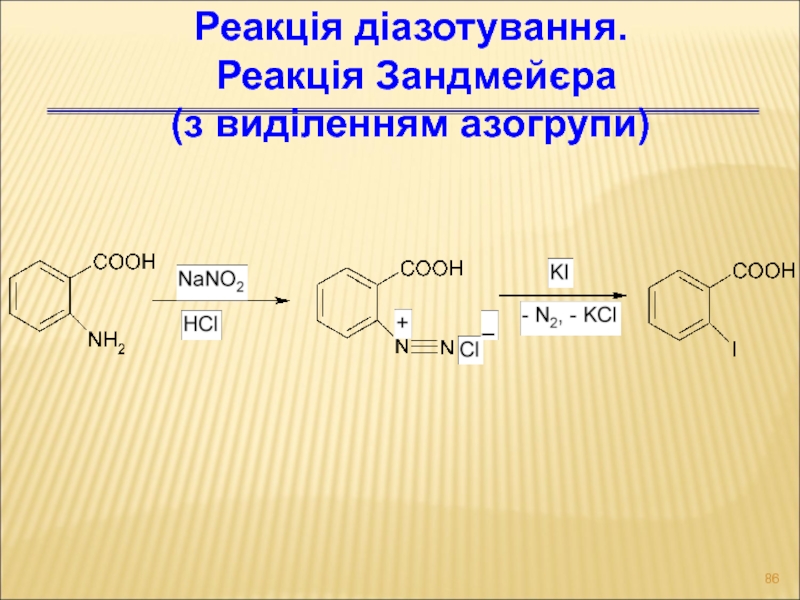
Слайд 86Реакція діазотування.
Реакція Зандмейєра
(з виділенням азогрупи)
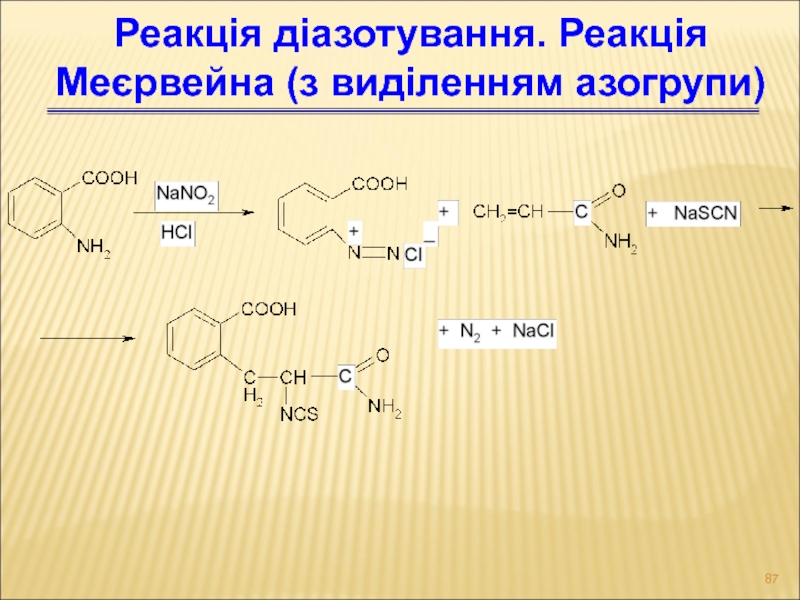
Слайд 87Реакція діазотування. Реакція Меєрвейна (з виділенням азогрупи)
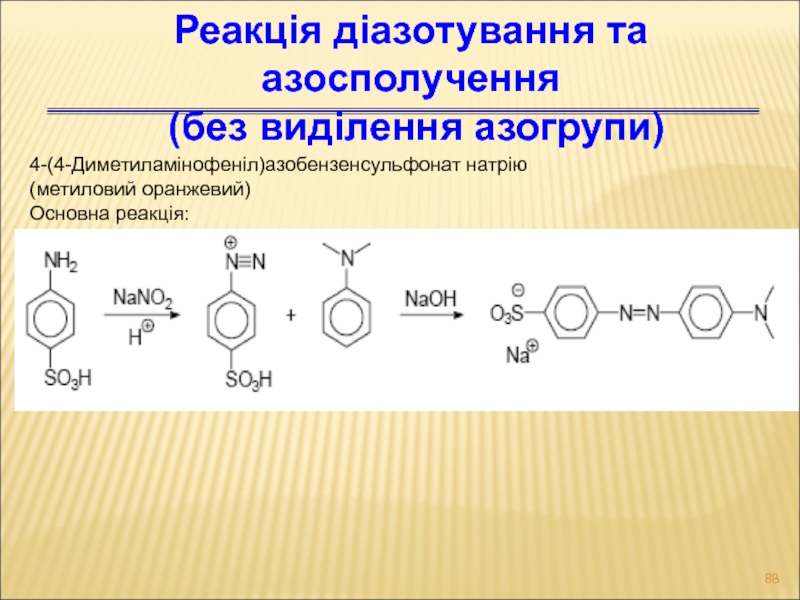
Слайд 884-(4-Диметиламінофеніл)азобензенсульфонат натрію
(метиловий оранжевий)
Основна реакція:
Реакція діазотування та азосполучення
(без виділення азогрупи)
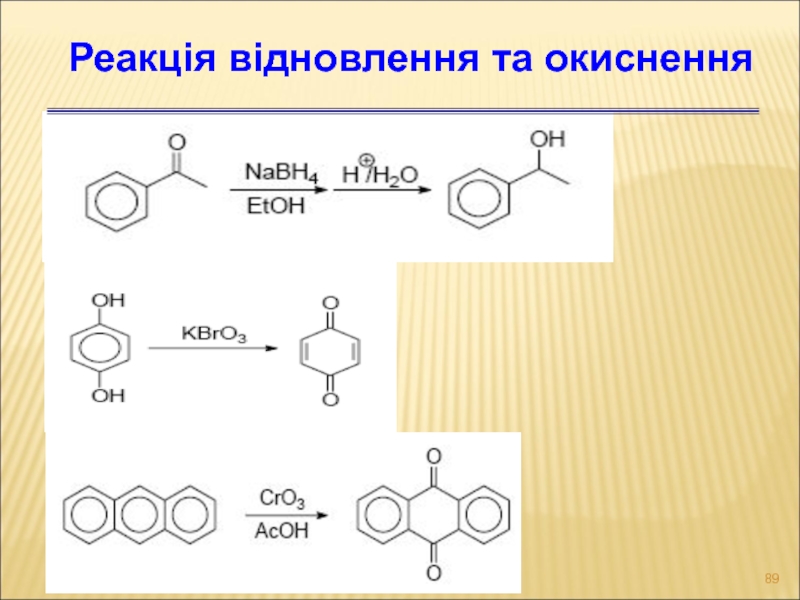
Слайд 89Реакція відновлення та окиснення
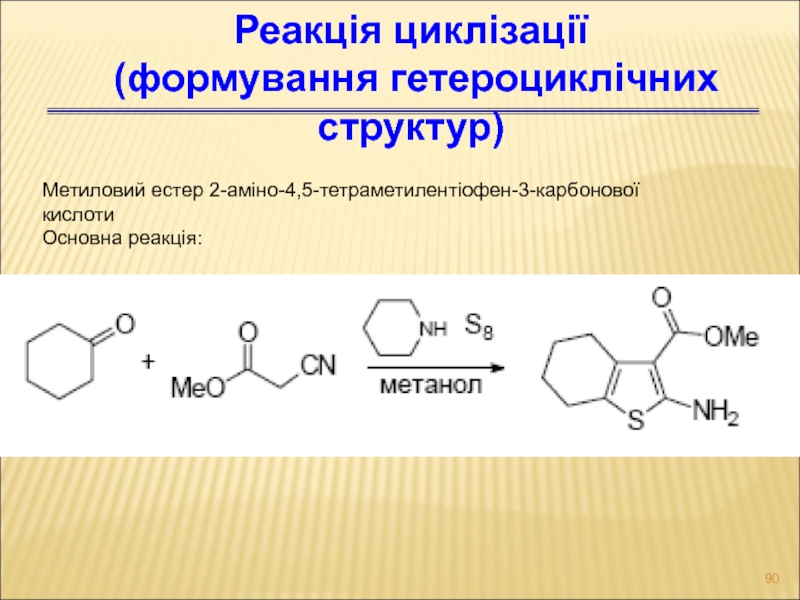
Слайд 90Реакція циклізації
(формування гетероциклічних структур)
Метиловий естер 2-аміно-4,5-тетраметилентіофен-3-карбонової
кислоти
Основна реакція: