Слайд 1Водяной пар. Процесс парообразования.
МИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ РОСТОВСКОЙ ОБЛАСТИ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ РОСТОВСКОЙ ОБЛАСТИ «РОСТОВСКИЙ-НА-ДОНУ СТРОИТЕЛЬНЫЙ КОЛЛЕДЖ»
Специальность 08.02.08 «Монтаж и эксплуатация оборудования и систем газоснабжения»
Выполнила: студентка гр. ДГ -11
Соловьёва Д.А.
Учитель: Данко И.В.
2020 год.
Слайд 2Основные разделы:
Основные понятия и определения.
р-v-диаграмма водяного пара.
Определение параметров воды и пара.
Определение параметров воды
и пара.
Т - s-диаграмма водяного пара.
h- s-диаграмма водяного пара.
Уравнение состояния реальных газов.
Слайд 3Основные понятия и определения.
Рассмотрим процесс получения пара. Для этого 1 кг
воды при температуре 0 °С поместим в цилиндр с подвижным
поршнем. Приложим к поршню извне некоторую постоянную силу Р. Тогда при площади поршня F давление будет постоянным и равным p=P/F. Изобразим процесс парообразования, т. е. превращения вещества из жидкого состояния в газообразное, в р,v-диаграмме.
Слайд 4Начальное состояние воды, находящейся под давлением р и имеющей температуру 0°С, изобразится
на диаграмме точкой a0. При подводе теплоты к воде ее температура постепенно повышается до
тех пор, пока не достигнет температуры кипения ts, соответствующей данному давлению. При этом удельный объем жидкости сначала уменьшается, достигает минимального значения при t=4°С, а затем начинает возрастать. (Такой аномалией — увеличением плотности при нагревании в некотором диапазоне температур — обладают немногие жидкости. У большинства жидкостей удельный объем при нагревании увеличивается монотонно). Состояние жидкости, доведенной до температуры кипения, изображается на диаграмме точкой а'.
Слайд 5При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением
объема. В цилиндре теперь находится двухфазная среда — смесь воды
и пара, называемая влажным насыщенным паром. По мере подвода теплоты количество жидкой фазы уменьшается, а паровой — растет. Температура смеси при этом остается неизменной и равной ts, так как вся теплота расходуется на испарение жидкой фазы. Следовательно — процесс парообразования на этой стадии является изобарно-изотермическим. Наконец, последняя капля воды превращается в пар, и цилиндр оказывается заполненным только паром, который называется сухим насыщенным. Состояние его изображается точкой а".
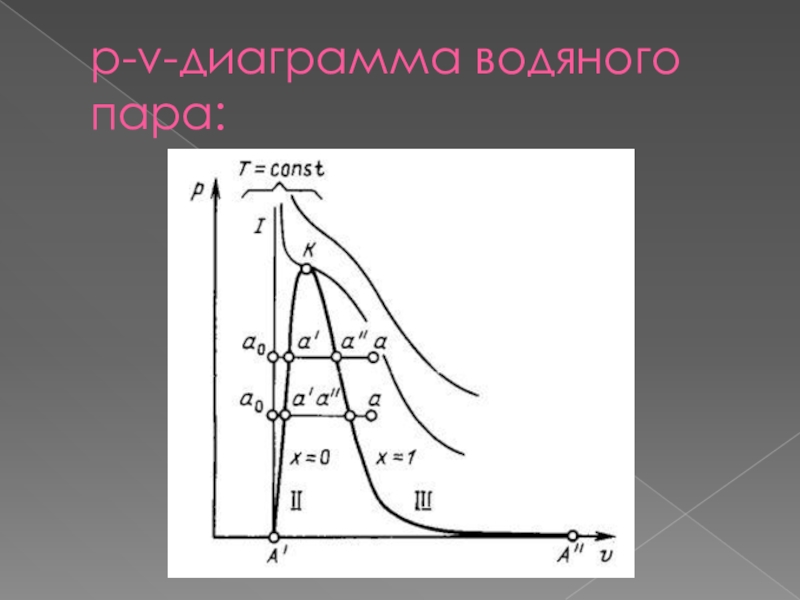
Слайд 6р-v-диаграмма водяного пара:
Слайд 7Насыщенным называется пар, находящийся в термическом и динамическим равновесии с жидкостью,
из которой он образуется.
Динамическое равновесие заключается в том, что количество
молекул, вылетающих из воды в паровое пространство, равно количеству молекул, конденсирующихся на ее поверхности. В паровом пространстве при этом равновесном состоянии находится максимально возможное при данной температуре число молекул.
Давление насыщенного пара является монотонно возрастающей функцией его температуры, или, что то же самое, температура насыщенного пара есть монотонно возрастающая функция его давления.
Слайд 8Насыщенный пар, в котором отсутствуют взвешенные частицы жидкой фазы, называется сухим
насыщенным паром. Его удельный объем и температура являются функциями давления.
Поэтому состояние сухого пара можно задать любым из параметров — давлением, удельным объемом или температурой.
Двухфазная смесь, представляющая собой пар со взвешенными в нем капельками жидкости, называется влажным насыщенным паром. Массовая доля сухого насыщенного пара во влажном называется степенью сухости пара и обозначается буквой х.
Слайд 9 Для кипящей жидкости х=0, а для сухого насыщенного пара х=1. Состояние влажного пара
характеризуется двумя параметрами: давлением (или температурой насыщения ts, определяющей это давление) и
степенью сухости пара.
Перегретым называется пар, температура которого превышает температуру насыщенного пара того же давления. Состояние перегретого пара, как и любого газа, определяется двумя любыми независимыми параметрами.
Слайд 10Поскольку удельный объем жидкости растет, а пара падает, то при
постоянном увеличении давления мы достигнем такой точки, в которой удельные
объемы жидкости и пара сравняются. Эта точка называется критической. В критической точке различия между жидкостью и паром исчезают. Для воды параметры критической точки К составляют: ркр=221,29·105 Па; tкр = 374,15 °С; vкр = 0,00326 м3/кг.
Критическая температура — это максимально возможная температура сосуществования двух фаз: жидкости и насыщенного пара. При температурах, больших критической, возможно существование только одной фазы. Название этой фазы (жидкость или перегретый пар) в какой-то степени условно и определяется обычно ее температурой.
Слайд 11Наименьшим давлением, при котором еще возможно равновесие воды и насыщенного
пара, является давление, соответствующее тройной точке. Под последней понимается то единственное
состояние, в котором могут одновременно находиться в равновесии пар, вода и лед (точка А' на рисунке). Параметры тройной точки для воды: р0 = 611 Па; t0 = 0,01 °С; v0=0,00100 м3/кг.
Процесс парообразования, происходящий при абсолютном давлении р0=611 Па, показан на диаграмме изобарой А'А", которая практически совпадает с осью абсцисс. При более низких давлениях пар может сосуществовать лишь в равновесии со льдом. Процесс образования пара непосредственно из льда называется сублимацией.
Слайд 12Если теперь соединить одноименные точки плавными кривыми, то получим нулевую изотерму I, каждая
точка которой соответствует состоянию 1 кг воды при 0°С и
давлении р, нижнюю пограничную кривую II, представляющую зависимость от давления удельного объема жидкости при температуре кипения, и верхнюю пограничную кривую III, дающую зависимость удельного объема сухого насыщенного пара от давления.
Все точки горизонталей между кривыми II и III соответствуют состояниям влажного насыщенного пара, точки кривой II определяют состояние кипящей воды, точки кривой III — состояния сухого насыщенного пара.
Слайд 13Определение параметров воды и пара.
Термодинамические параметры кипящей воды и сухого насыщенного
пара берутся из таблиц теплофизических свойств воды и водяного пара.
В этих таблицах термодинамические величины со штрихом относятся к воде, нагретой до температуры кипения, а величины с двумя штрихами — к сухому насыщенному пару.
Поскольку для изобарного процесса подведенная к жидкости теплота q=h1 – h2, то, применив это соотношение к процессу а'а", получим g=r=h’’- h’),
Величина r называется теплотой парообразования и определяет количество теплоты, необходимое для превращения одного килограмма воды в сухой насыщенный пар той же температуры.
Слайд 14Приращение энтропии в процессе парообразования определяется формулой
За нулевое состояние, от
которого отсчитываются величины s', принято состояние воды в тройной точке. Так как
состояние кипящей воды и сухого насыщенного пара определяется только одним параметром, то по известному давлению или температуре из таблиц воды и водяного пара берутся значения v', v" , h', h" ,s', s", r.
Слайд 15Удельный объем vx, энтропия sx и энтальпия hx влажного насыщенного пара определяются по правилу аддитивности.
Поскольку в 1 кг влажного пара содержится x кг сухого и
кг кипящей воды, то , аналогично
Непосредственно из таблиц взять параметры влажного пара нельзя. Их определяют по приведенным выше формулам по заданному давлению (или температуре) и степени сухости.
Однофазные состояния некипящей воды и перегретого пара задаются двумя параметрами. По заданным давлению и температуре из таблиц воды и перегретого пара находят значения v, h, s.
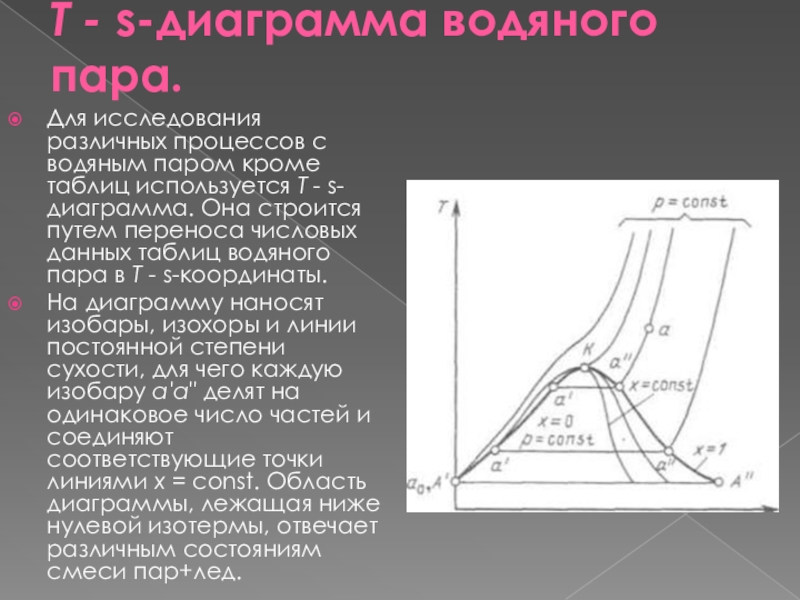
Слайд 16Т - s-диаграмма водяного пара.
Для исследования различных процессов с водяным паром
кроме таблиц используется Т - s-диаграмма. Она строится путем переноса числовых данных
таблиц водяного пара в Т - s-координаты.
На диаграмму наносят изобары, изохоры и линии постоянной степени сухости, для чего каждую изобару а'а" делят на одинаковое число частей и соединяют соответствующие точки линиями x = const. Область диаграммы, лежащая ниже нулевой изотермы, отвечает различным состояниям смеси пар+лед.
Слайд 17h- s-диаграмма водяного пара.
Если за независимые параметры, определяющие состояние рабочего тела,
принять энтропию s и энтальпию h, то каждое состояние можно изобразить точкой на
h-s-диаграмме.
h, s-диаграмма для водяного пара, строится путем переноса числовых данных таблиц водяного пара в h-s-координаты.
За начало координат принято состояние воды в тройной точке. Откладывая на диаграмме для различных давлений значения s' и h'' для воды при температуре, кипения, а также s" и h" для сухого насыщенного пара, получаем нижнюю и верхнюю пограничные кривые.
Слайд 18Изобары в двухфазной области влажного пара представляют собой пучок расходящихся
прямых. Действительно, в процессе р=const
или .
Слайд 19Уравнение состояния реальных газов
свободный для движения молекул объем будет равен
где b — тот наименьший объем, до которого
можно сжать газ.
из данного выражения
получаем уравнение Ван-дер-Ваальса
или
По мере повышения температуры концентрация комплексов с большим числом молекул быстро уменьшается, а доля одиночных молекул растет. Большую склонность к ассоциации проявляют полярные молекулы водяного пара.
Слайд 20Используемые ресурсы:
https://pandia.ru/text/78/082/79822.php
https://studopedia.ru/3_1651_protsess-paroobrazovaniya-v-pv-koordinatah.html