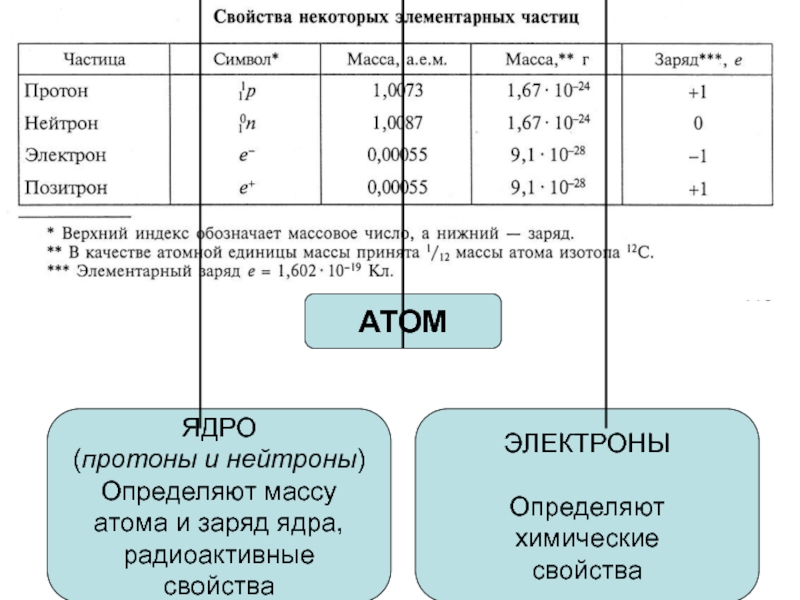
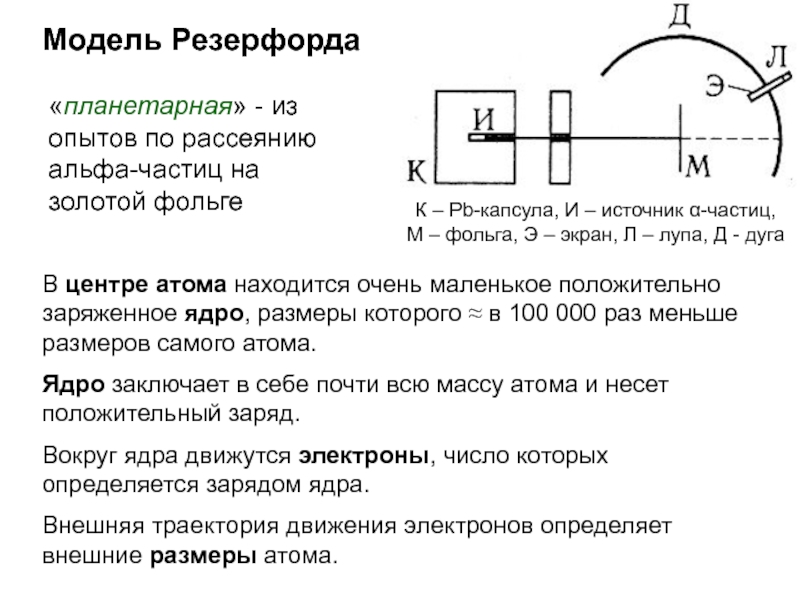
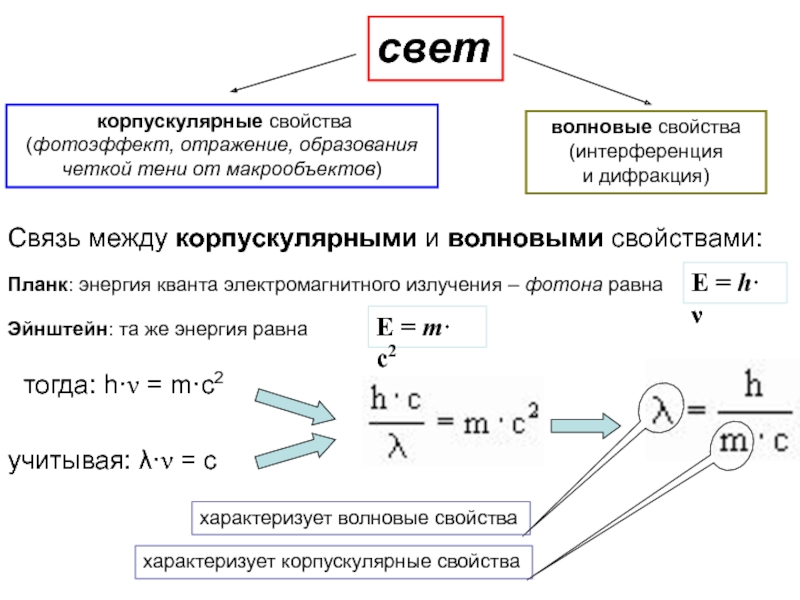
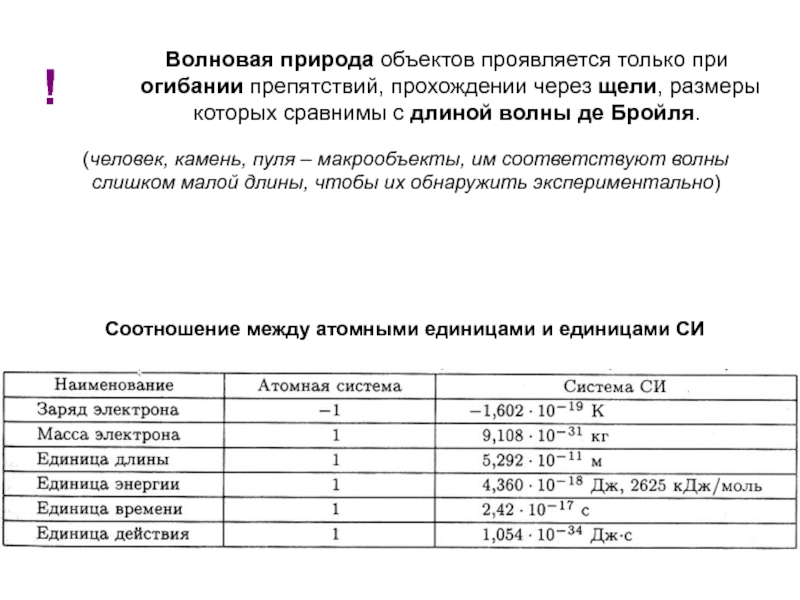
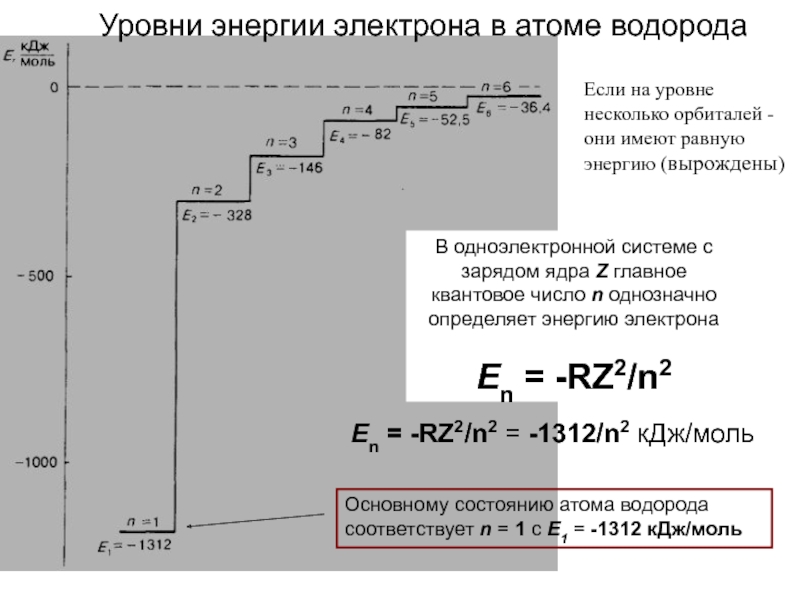
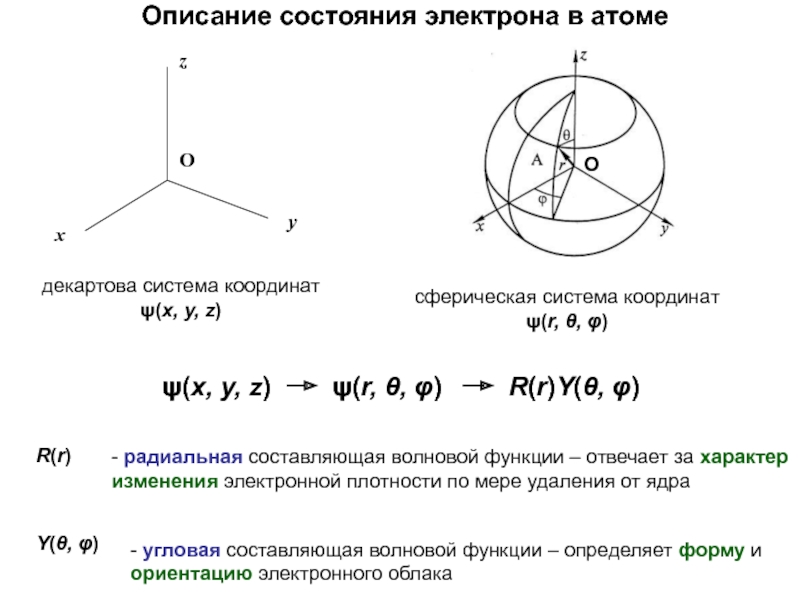
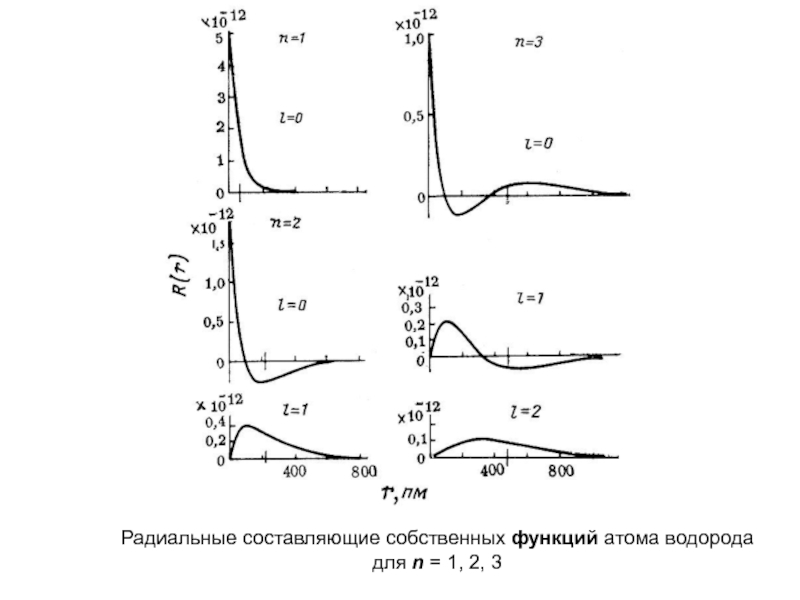
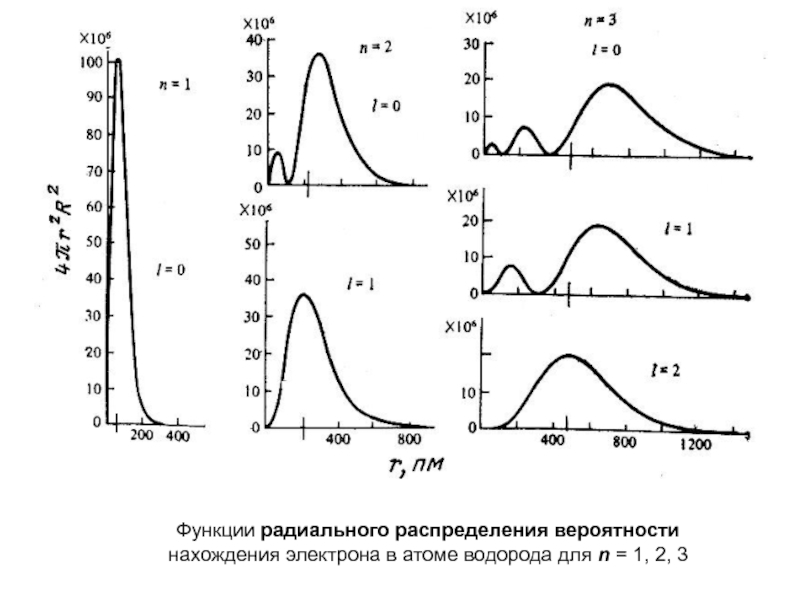
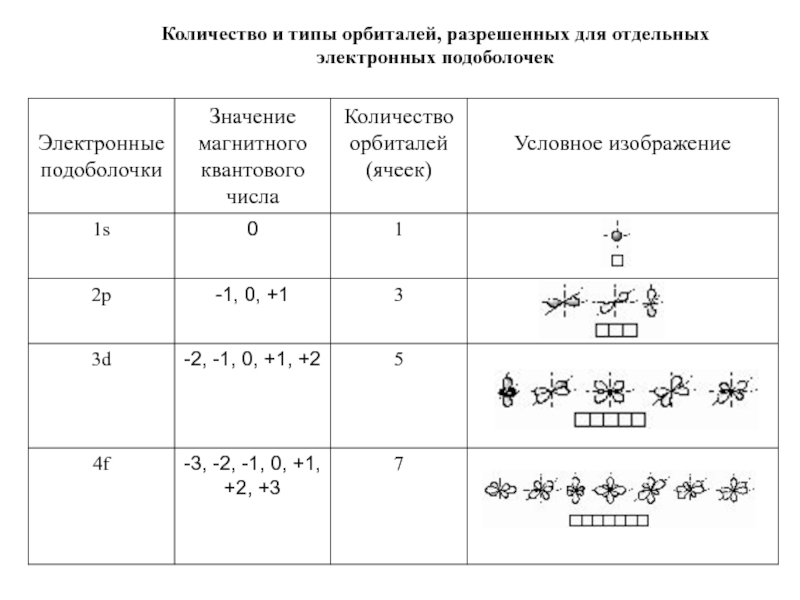
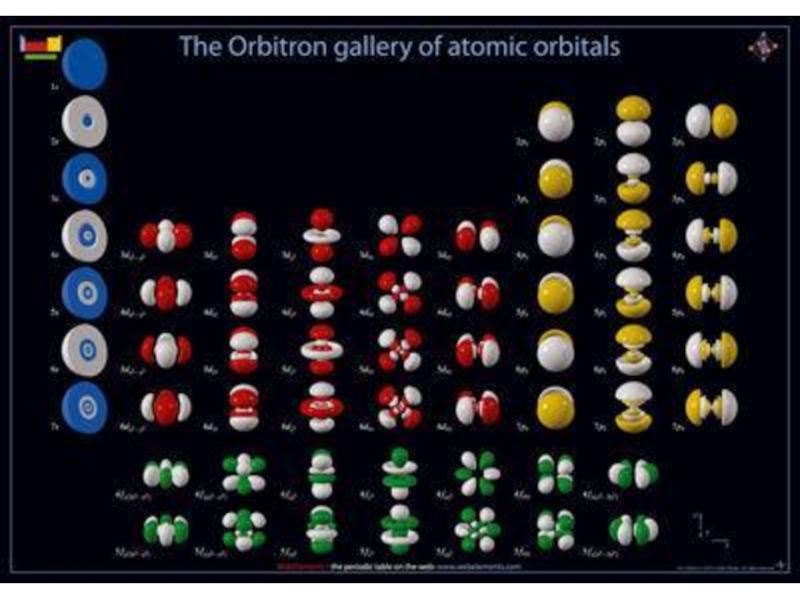
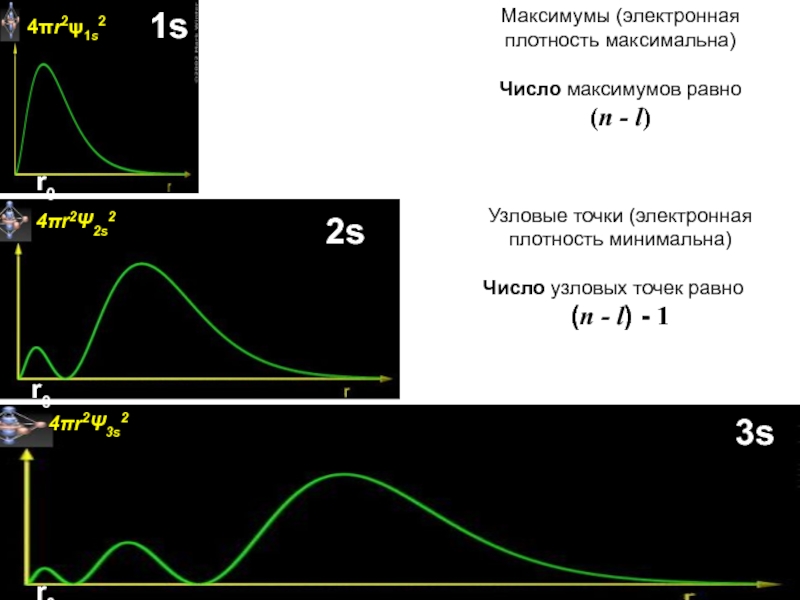
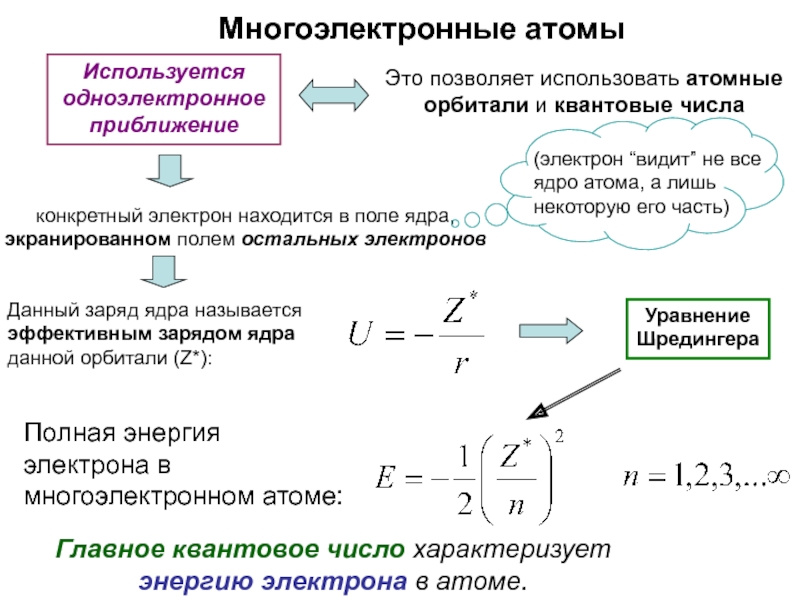
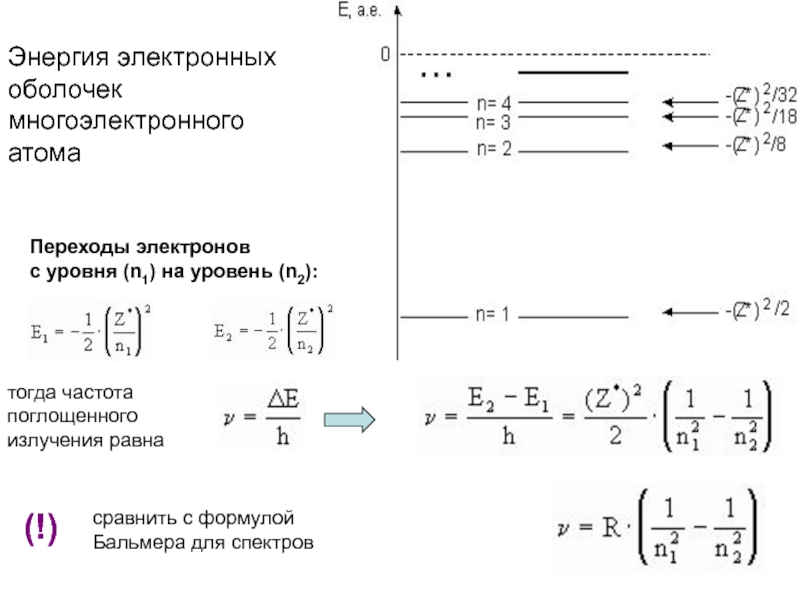
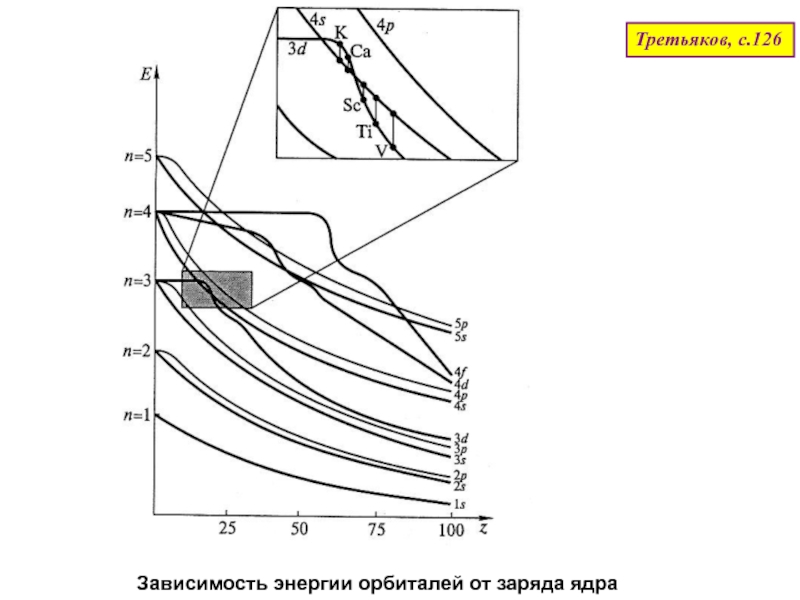
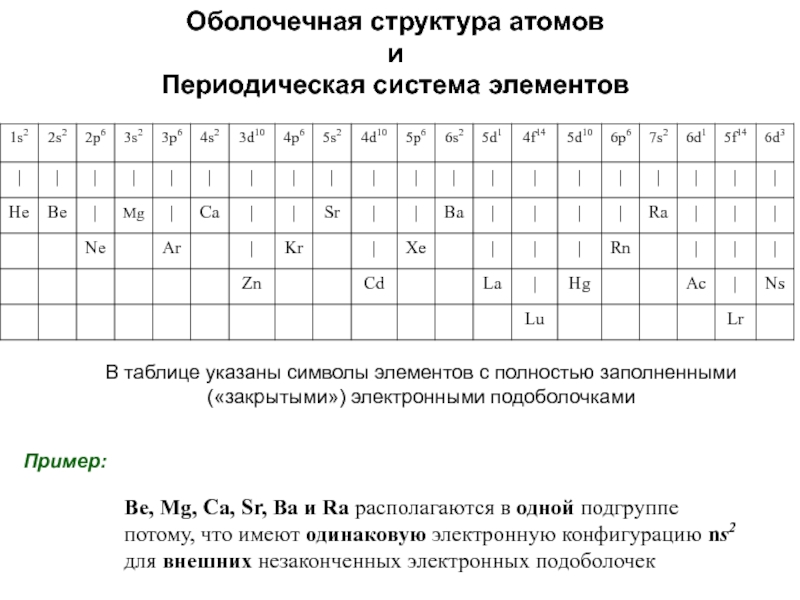
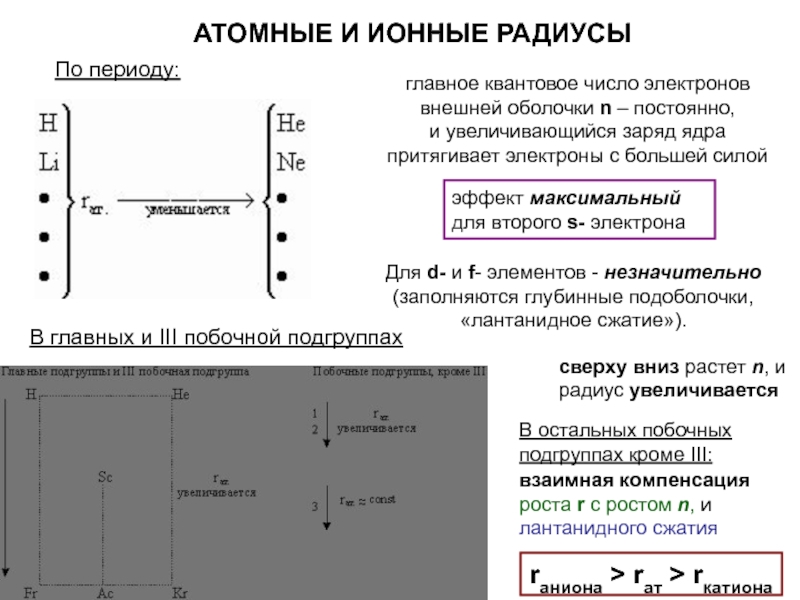
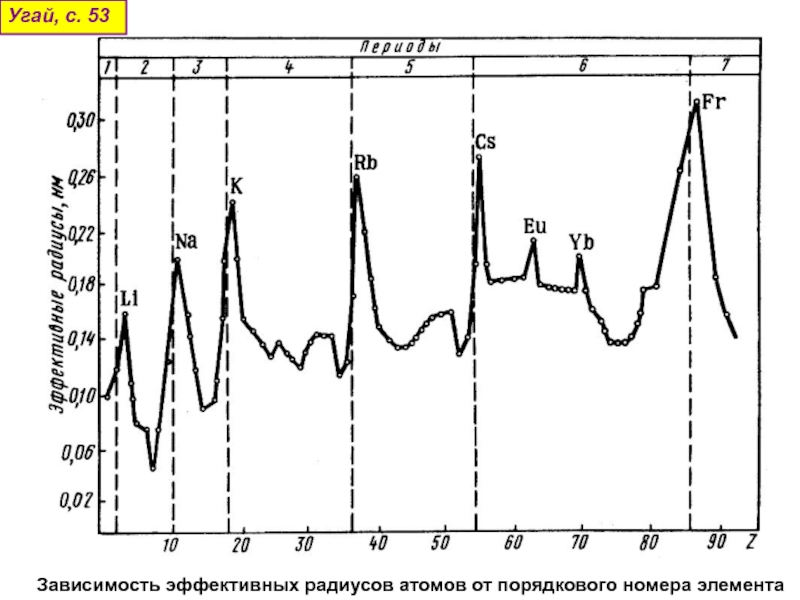
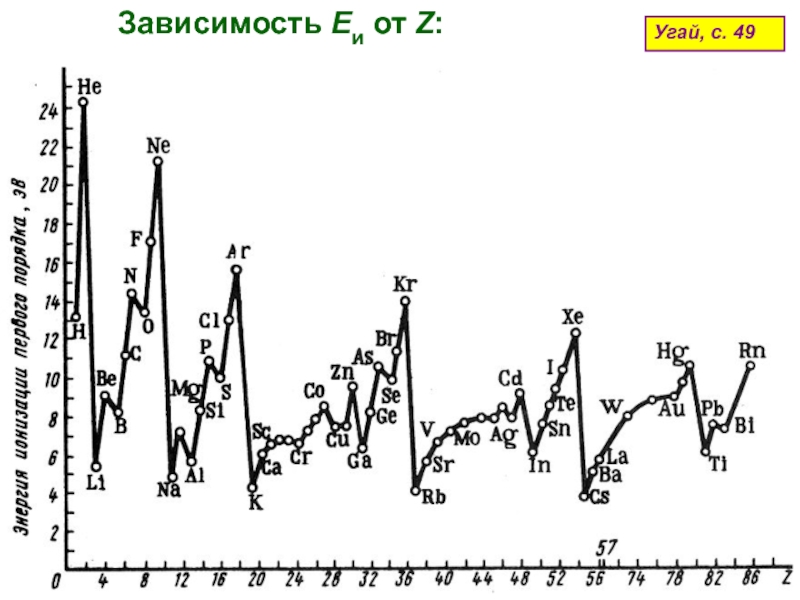
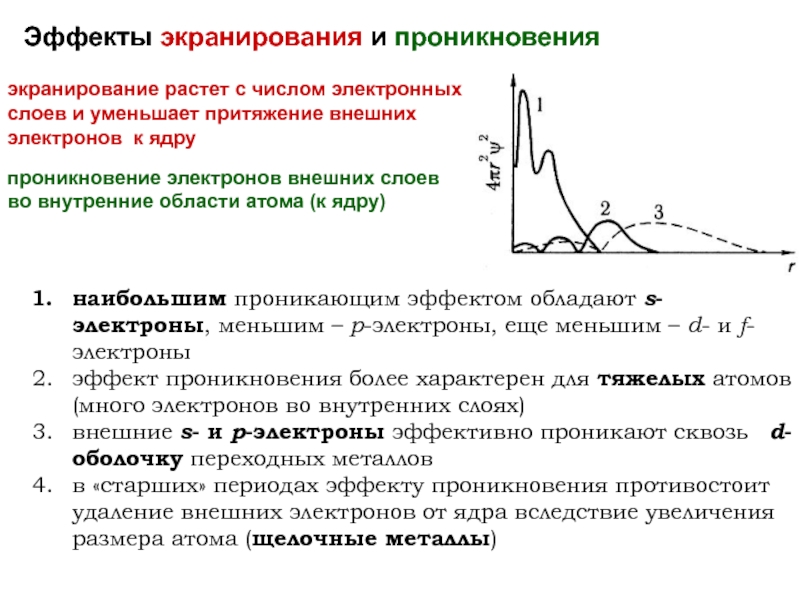
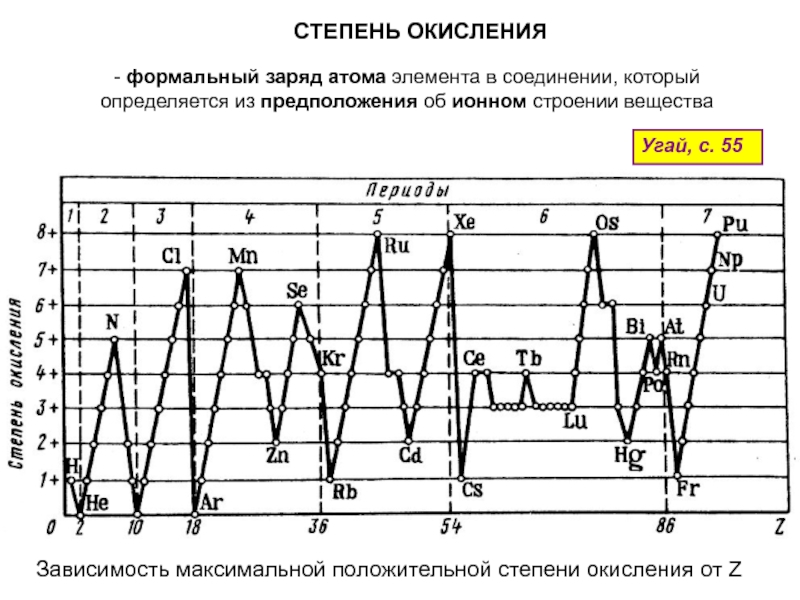
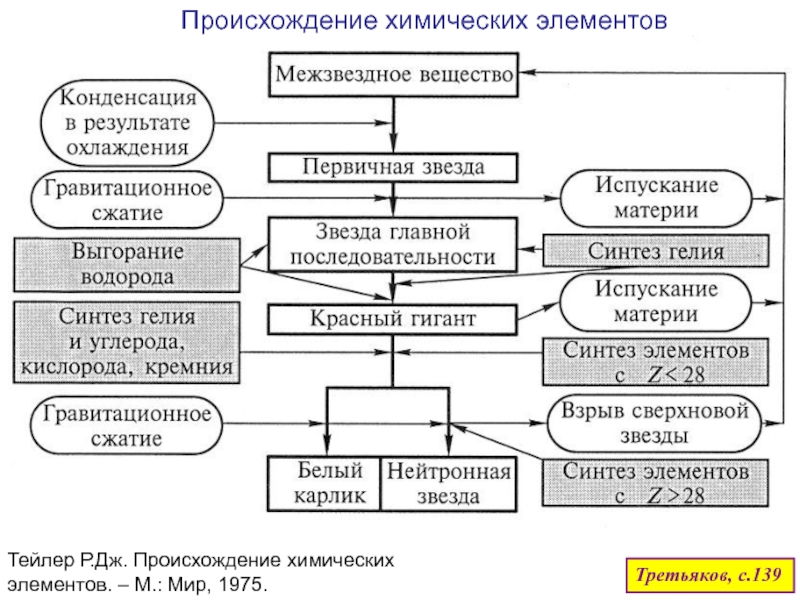
оболочек атома;
главным квантовым числом внешней (заполняющейся электронами)
оболочки;
главным квантовым числом заполняющейся s- подоболочки;
главным квантовым числом заполняющейся p- подоболочки;
главным квантовым числом +1 заполняющейся d- подоболочки;
главным квантовым числом +2 заполняющейся f- подоболочки.
2. Каждый период начинается двумя s- элементами.
3. Каждый период, кроме 1-го, заканчивается шестью p- элементами. В 7 периоде p-элементов нет, т.к. период не достроен.
4. В больших периодах между s- и p- элементами размещаются десять d- элементов.
5. В 6 и 7 периодах за первыми d- элементами (La и Ac) находятся 14 f- элементов.
6. У атомов элементов главных подгрупп на внешней электронной оболочке находится число электронов, численно совпадающее с номером группы.
7. У большинства атомов элементов побочных подгрупп на внешней оболочке находится 2 электрона, 1 электрон - Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au, или даже 0 - Pd.
Выводы: