Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Выполнилил: Студент группы ИСП-1 Бессмертный Никита Уксусная кислота
Содержание
- 1. Выполнилил: Студент группы ИСП-1 Бессмертный Никита Уксусная кислота
- 2. У́ксусная кислота (эта́новая кислота) CH3COOH — органическое
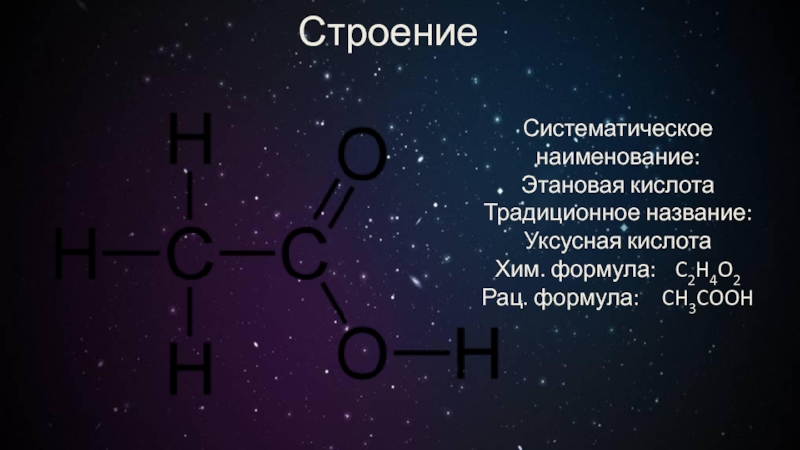
- 3. СтроениеСистематическое наименование: Этановая кислотаТрадиционное название: Уксусная кислотаХим. формула: C2H4O2Рац. формула: CH3COOH
- 4. Физические свойстваУксусная кислота — бесцветная, растворимая в
- 5. Химические свойства1) Взаимодействует с металлами Образуется: соль,водородПример:
- 6. 4)Взаимодействует с неметаллами (реакция замещения)Образуется: органическая и
- 7. 5)Взаимодействует с кислородом (реакция окисления)Образуется: Углекислый газ и водаПример: CH3COOH + 2O2 → 2CO2 + 2H2O
- 8. из ацетальдегида путём окисления атмосферным кислородом в
- 9. В природе уксусная кислота распространена в свободном
- 10. Уксусную кислоту, концентрация которой близка к 100
- 11. Спасибо за Внимание!
- 12. Скачать презентанцию
У́ксусная кислота (эта́новая кислота) CH3COOH — органическое соединение, cлабая, предельная одноосно́вная карбоновая кислота. Соли и сложные эфиры уксусной кислоты называются ацетатами.
Слайды и текст этой презентации
Слайд 2У́ксусная кислота (эта́новая кислота) CH3COOH — органическое соединение, cлабая, предельная
одноосно́вная карбоновая кислота. Соли и сложные эфиры уксусной кислоты называются
ацетатами.Слайд 3Строение
Систематическое наименование:
Этановая кислота
Традиционное название: Уксусная кислота
Хим. формула: C2H4O2
Рац. формула: CH3COOH
Слайд 4Физические свойства
Уксусная кислота — бесцветная, растворимая в воде жидкость с
острым характерным запахом. Молярная масса = 60,05 г/моль. Плотность =
1,0492 г/см³. Температура плавления = + 16,75 °C. Температура кипения = + 118,1 °C.Слайд 5Химические свойства
1) Взаимодействует с металлами
Образуется: соль,водород
Пример: Mg + 2CH3COOH
→ (CH3COO)2Mg + H2
2)Взаимодействует с оксидами
Образуется: соль, вода
Пример: CaO +
2CH3COOH → (CH3COO)2Ca + H2O3)Взаимодействует с основаниями
образуется: соль, вода
Пример: CH3COOH + NaOH → CH3COONa + H2O
Слайд 64)Взаимодействует с неметаллами (реакция замещения)
Образуется: органическая и неорганическая кислоты
Пример: –
CH3COOH + Cl2 → CH2ClCOOH (хлоруксусная кислота) + HCl;
– CH3COOH
+ F2 → CH2FCOOH (фторуксусная кислота) + HF;– CH3COOH + I2 → CH2ICOOH (иодуксусная кислота) + HI
Слайд 75)Взаимодействует с кислородом (реакция окисления)
Образуется: Углекислый газ и вода
Пример: CH3COOH
+ 2O2 → 2CO2 + 2H2O
Слайд 8из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2
и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
из
метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.
Получение
Слайд 9В природе уксусная кислота распространена в свободном виде или в
виде солей и сложных эфиров в растениях (в зеленых листьях)
, в выделениях животных (моче, желчи) , образуется при гниении и брожении (в кислом молоке, сыре, вине) . Брожение происходит под влиянием специфических бактерий "уксусного грибка".Нахождение в природе
Слайд 10Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной.
70—80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а 3—15%-й
— уксусом. Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании и для избавления от накипи.Уксусную кислоту применяют для получения лекарственных и душистых веществ, таких как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Применение