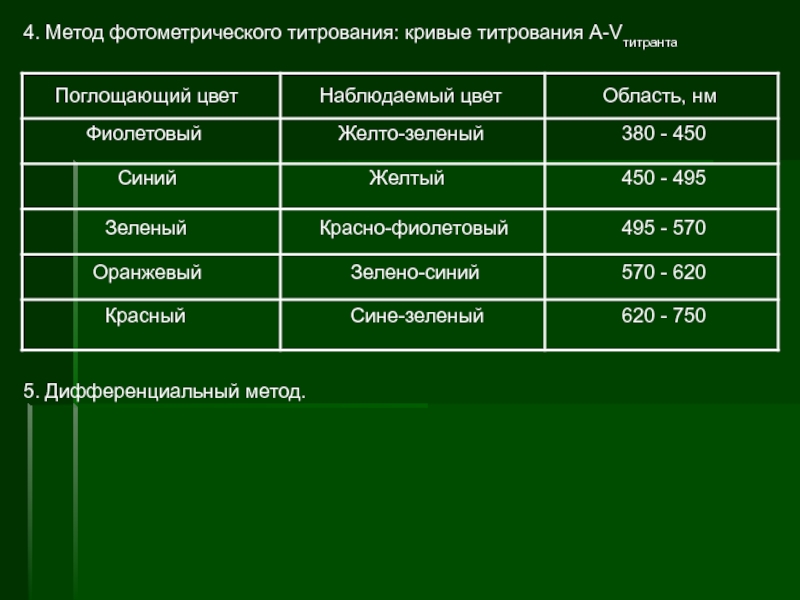
п.п.
Характеристика
Обозначение
Единица измерения
1
ν = с/λ
Гц, кГц =
103 Гц, мГц = 106 Гц, 1/сек
2
Длина волны – расстояние
между двумя максимумами
волны
λ
м, см, нм = 10-9 м
(видимая УФ-область),
мкм = 10-6 м,
Å = 10-10 м
3
Волновое число – число
волн, приходящихся на 1 см
ν’ = 1/λ
см-1 (используется в
ИКС)
4
Скорость излучения
Si = ν∙λi
cм/сек
5
Энергия квантов
Е = h∙ν = hC/λ =
= hCν’
h = 6.62 ∙ 10-34 Дж∙С