Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Характеристика основных ионов, содержащихся в природных растворах Главные ионы
Содержание
- 1. Характеристика основных ионов, содержащихся в природных растворах Главные ионы
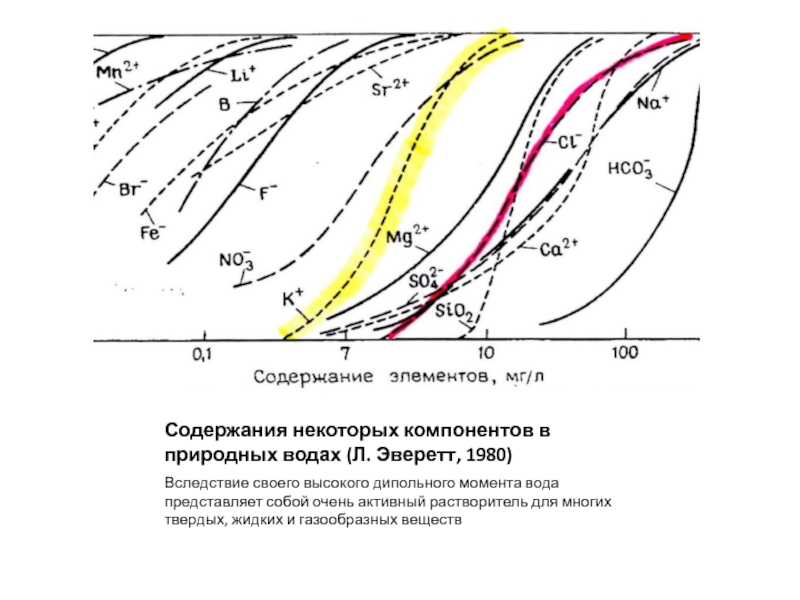
- 2. Содержания некоторых компонентов в природных водах (Л.
- 3. Анионы Хлор-ион.Растворимость NaCl при 20о – 360
- 4. Растворение каменной солиВторым источником хлор-иона в подземных
- 5. Роль хлор-иона для живого вещества Хлор относится
- 6. Загрязнение вод.Хлорорганические соединения - продукты замещения в
- 7. Сульфат-ион Главным источником сульфат-иона являются широко
- 8. сульфатредукцияВ отличие от хлор-иона, почти не вступающего
- 9. Гидрокарбонат-ион Концентрации изменяются от долей мг/л (кислые
- 10. диссоциация угольной кислотыКонцентрации гидрокарбонат-иона в подземных водах
- 11. выветривание алюмосиликатовВторым источником гидрокарбонат-иона в природных водах
- 12. КатионыНатрий (Na+). Является преобладающим среди катионов океанской
- 13. Источники натрияПри формировании морских осадков, сопровождающемся захоронением
- 14. Гидролиз щелочных пород: NaAlSiO4 (нефелин) +
- 15. Калий (K+). Калийные соли хорошо растворимы.
- 16. Кальций (Ca2+). Высокая растворимость хлоридов (745
- 17. При растворении гипсов и ангидритов концентрации кальция
- 18. 2Naтв + Сa2+ р-р Caтв +
- 19. Магний (Mg2+). Высокая растворимость хлоридов (
- 20. Скачать презентанцию
Содержания некоторых компонентов в природных водах (Л. Эверетт, 1980)Вследствие своего высокого дипольного момента вода представляет собой очень активный растворитель для многих твердых, жидких и газообразных веществ
Слайды и текст этой презентации
Слайд 1С.М.Судариков
Гидрогеохимия
Характеристика основных ионов, содержащихся в природных растворах
Главные ионы
Слайд 3Анионы
Хлор-ион.
Растворимость NaCl при 20о – 360 г/кг при 100о –
391. Хлориды кальция и магния растворяются лучше. Плохо растворим только
AgCl. Высокая миграционная способность хлор-иона определяется хорошей растворимостью солей, независимостью от газового режима, редким участием в обменных реакциях.Концентрации хлоридов в природных водах могут изменяться от десятых долей мг/л (льды и снег Антарктиды) до 320 г/л. Главный источник хлоридных солей – вода Мирового океана. Воды морей и лагун, захороненные при формировании осадочных пород морского генезиса – исходные для большей части седиментогенных вод артезианских бассейнов. среди которых преобладают хлоридные воды. В океанской воде концентрация хлор-иона достигает 19 г/кг, в лагунах при упаривании океанской воды до стадии садки гипса – 75–80 г/кг, до стадии галита – 150–170 г/кг, а на последних стадиях упаривания морской воды достигает 250–270 г/кг.
Слайд 4Растворение каменной соли
Вторым источником хлор-иона в подземных водах является растворение
залежей каменной соли (галита) и калийно-магнезиальных солей, содержащих такие минералы,
как сильвин , карналлит , бишофит . Растворимость хлористого натрия составляет в интервале температур от 0 до 100 °C 263–282 г/кг, хлористого магния 364–422 г/кг, хлористого кальция 373–614 г/кг; соответственно и концентрация хлор-иона в рассолах выщелачивания каменной соли может достигать 160–170 г/кг, а при выщелачивании калийно-магнезиальных солей – 270–310 г/кг. Условия для интенсивного растворения каменной и калийно-магнезиальных солей создаются, однако, только в тех случаях, когда эти соли залегают достаточно близко к поверхности, в зоне интенсивного водообмена. При залегании на больших глубинах соленосные толщи являются региональными водоупорами и поступление из них солей в водоносные горизонты осуществляется только в результате протекания диффузионных процессов.Слайд 5Роль хлор-иона для живого вещества
Хлор относится к важнейшим биогенным элементам
и входит в состав всех живых организмов. У человека и
животных ионы хлора участвуют в поддержании осмотического давления и регуляции водно-солевого обмена наряду с ионами натрия и калия. Человек потребляет 5-10 г NaCl в сутки (с пищей – 3-6 г хлора). Минимальная потребность 800 мг в сутки. В крови – 2,89 г/л.Необходимы растениям. Энергетический обмен, образование кислорода в процессе фотосинтеза. Положительно влияют на поглощение корнями кислорода, соединений Са, К, Mg.
Слишком много – плохо, но есть растения, которые приспособились к засолению – галофиты. Среди бактерий также известны галофилы – галобактерии на засоленных почвах.
Слайд 6Загрязнение вод.
Хлорорганические соединения - продукты замещения в органических соединениях атомов
водорода хлором (диоксины, пестициды и др).
ХС плохо растворяются в воде,
но обладают повышенной биологической активностью. В водоемах и грунтовых водах поглощаются ОВ и накапливаются в осадках. Диоксины - кумулятивные яды, глобальные экзотоксиканты. Обладают мощным мутагенным, иммунодепрессантным, канцерогенным, эмбриотоксическим и др. действием. Накапливаются в биосфере планеты, включая воду. Величина летальной дозы 10-6 на 1 кг живого веса. Для боевых отравляющих веществ – порядка 10-3 г/кг. Формула одного из диоксинов С12Н4Cl4O2.
Слайд 7Сульфат-ион
Главным источником сульфат-иона являются широко распространенные горные породы –
гипсы и ангидриты.
CaSO4 (ангидрит)+ H2O CaSO4. 2H2O(гипс)
Растворимость сульфата
кальция относительно невелика (~2 г/кг), что соответствует 1,4 г/кг сульфат-иона . В присутствии гипсоносных толщ обычно и формируются концентрации сульфат-иона 1–1,4 г/кг. В соленых водах и рассолах (имеющих обычно хлоридный состав) растворимость сульфата кальция растет с ростом минерализации, достигая максимума 7–8 г/кг при минерализации 150 г/кг. Вторым важным источником сульфат-иона в подземных водах являются процессы окисления сульфидных минералов, характерные для приповерхностных зон.
FeS2 + 2H2O + 3O2 –––> 2SO42- + Fe2+ +4H+ +2e;
Слайд 8сульфатредукция
В отличие от хлор-иона, почти не вступающего в химические реакции,
сульфат-ион легко восстанавливается при взаимодействии с органическим веществом, источником которого
могут быть торфяники, илы, нефтяные битумы.SO4 2- + 2H2O + 2Cорг –––> H2S + 2HCO3-;
SO4 2- + 2H + + 2Cорг –––> H2S + 2CO2;
Эти процессы всегда протекают с участием сульфатвосстанавливающих бактерий.
Слайд 9Гидрокарбонат-ион
Концентрации изменяются от долей мг/л (кислые воды) до 2-3 г/л
(нарзаны), реже до 100 г/л (растворение соды).
Главным источником гидрокарбонат-иона
в природных водах являются карбонатные породы – известняки и доломиты. Растворимость большинства карбонатов очень низкая, в частности для CaCO3 13 и для MgCO3 22 мг/кг. Образующиеся гидрокарбонаты растворимы значительно лучше и формируют широко распространенные в верхних частях гидрогеологического разреза гидрокарбонатные воды. Слайд 10диссоциация угольной кислоты
Концентрации гидрокарбонат-иона в подземных водах лимитируются также уравнениями
диссоциации угольной кислоты
H2СO3↔HСO3+H ; HСO3 ↔СO3+H
При значениях
pH<4,1 в воде преобладает недиссоциированная угольная кислота
при pH=4,1 появляется аналитически определимый гидрокарбонат-ион;
при pH=6,5 количества гидрокарбонат-иона и недиссоциированной угольной кислоты становятся равными;
при pH>8,3 появляется карбонат-ион, который преобладает при pH>10,3.
Слайд 11выветривание алюмосиликатов
Вторым источником гидрокарбонат-иона в природных водах являются процессы выветривания
алюмосиликатов
Все эти реакции ведут к повышению щелочности раствора. Минералогический
состав плагиоклазов, пироксенов, оливинов, амфиболов определяет соотношение главных анионов в воде, а образующаяся гидроксильная группа реагирует с углекислым газом биогенного происхожденияТак формируются гидрокарбонатные воды на площадях развития значительной части изверженных, метаморфических и терригенных пород. Их формирование - своего рода мостик между гидросферой и биосферой.
Слайд 12Катионы
Натрий (Na+).
Является преобладающим среди катионов океанской воды, содержащей 10,8 г/кг
натрия (77,3 %-экв). Накапливался в результате выветривания (гидролиза) первичных кислых
изверженных пород. При упаривании морской воды до 280 г/кг выпадает с галитом. В соленых континентальных озерах (например, Каспийское) – с мирабилитом. При захоронении морской воды вступает в обменные процессы. Заметим, что в морской воде его содержание ниже, чем хлор-иона (77,3 %-экв. натрия при 90,2 %-экв. хлора), т. е. помимо хлористого натрия океанская вода содержит значительное количество хлористого магния.Слайд 13Источники натрия
При формировании морских осадков, сопровождающемся захоронением соленой воды, в
водоносные горизонты попадает значительное количество натрия, который обычно является преобладающим
катионом подземных соленых вод и рассолов. Поскольку растворимость хлористого натрия ниже, чем хлористого магния и хлористого кальция, при значениях минерализации выше 300–350 г/кг в рассолах преобладают щелочноземельные металлы.В пресных подземных водах одним из главных источников натрия являются процессы выветривания полевых шпатов. Содержание натрия в этих водах обычно не превышает первых десятков миллиграммов на литр.
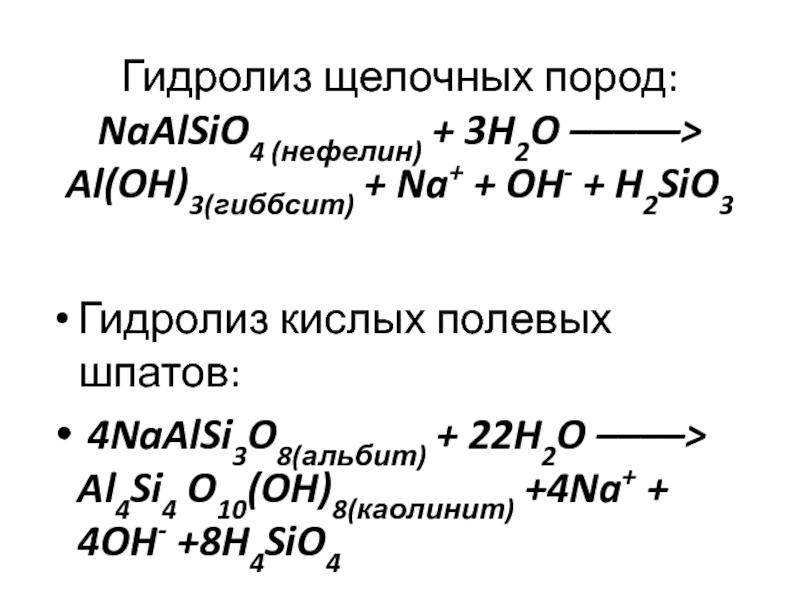
Слайд 14 Гидролиз щелочных пород: NaAlSiO4 (нефелин) + 3H2O –––––> Al(OH)3(гиббсит) + Na+
+ OH- + H2SiO3
Гидролиз кислых полевых шпатов:
4NaAlSi3O8(альбит) + 22H2O
––––> Al4Si4 O10(OH)8(каолинит) +4Na+ + 4OH- +8H4SiO4Слайд 15Калий (K+).
Калийные соли хорошо растворимы. Растворимость KСl при 20о
– 340 г/кг, при 100о – 567. Растворимость K2SO4 при
20о – 111 г/кг, при 100о – 241. Содержание калия в морской воде 0,39 г/кг (1,6 %-экв). На самых последних стадиях упаривания морской воды, когда из воды начинают выпадать калийно-магнезиальные соли, концентрация калия в рассоле достигает 20–25 г/кг. Такие же (редко до 40 г/кг) концентрации калия могут быть встречены в сверхкрепких рассолах седиментационного генезиса.Кларки калия и натрия в литосфере равны (2,5 %), однако содержание калия в природных водах, как правило, значительно ниже содержания натрия (на 1-2 порядка). Причины – поглощение растениями; сорбирование глинистыми фракциями.
В пресных подземных водах концентрации калия обычно не превышают первых миллиграммов на литр.
Источники калия в природных водах. Гидролиз калиевых полевых шпатов формирует небольшие (до нескольких мг/л) концентрации в большинстве природных вод. В водах выщелачивания калийно-магнезиальных солей концентрации калия могут достигать 20 и более г/кг.
Слайд 16Кальций (Ca2+).
Высокая растворимость хлоридов (745 г/кг при 20о и
1590 при 100о), относительно низкая – сульфатов (2 г/кг) и
низкая – карбонатов.В морской воде лишь 0,41 г/кг, но она близка к насыщению по CaCO3, достигнутому к началу фанерозоя. Фанерозой – эра кальция.
Главным источником кальция в природных водах являются карбонатные и сульфатные горные породы и кальциевые полевые шпаты. Концентрации кальция, формирующиеся при разрушении карбонатных и сульфатных пород, контролируются парциальным давлением углекислоты и обычно не превышают 50–150 мг/л. Усиливается процесс при высоких содержаниях углекислого газа и в нарзанах содержание кальция достигает 0,4-0,6 г/кг.
Слайд 17При растворении гипсов и ангидритов концентрации кальция достигают 450–600 мг/л.
Процессы
растворения и выщелачивания горных пород протекают на громадных площадях, в
результате чего кальций становится одним из главных компонентов природных вод.Другим важным процессом, выводящим кальций в природные растворы, является катионный обмен, в результате которого воды морского генезиса, содержащие значительные количества натрия и магния, при взаимодействии с глинистыми породами обогащаются кальцием.
Слайд 182Naтв + Сa2+ р-р Caтв + 2Na+р-р
В результате относительное
содержание кальция в подземных рассолах оказывается обычно существенно большим, чем
в океанской воде. В предельно насыщенных подземных рассолах с минерализацией, достигающей 400–460 г/кг (560–650 г/л), концентрации кальция могут достигать 150–170 г/кг (75–80 %-экв.). Наиболее яркие проявления таких рассолов встречены в отложениях усольской свиты нижнего кембрия Ангаро-Ленского артезианского бассейна на глубинах 1100–2000 м.Слайд 19Магний (Mg2+).
Высокая растворимость хлоридов ( 545 г/кг при 20о
и 730 при 100о) и сульфатов ( 360 и 680),
но низкая – карбонатов. Является одним из главных ионов океанской воды, содержание магния в которой составляет около 1,3 г/кг, или 17,6 %-экв.Хлор-магниевый тип морской воды.
При упаривании океанской воды в лагунах концентрация магния растет и на последних стадиях упаривания может достигать 70–100 г/кг и более. В подземных рассолах, однако, такие концентрации магния редки, поскольку значительная часть его расходуется на обменные процессы; даже в сверхкрепких подземных рассолах концентрации магния обычно не превышают 20–25 г/кг.
В пресных подземных водах всегда встречается от 5–6 до 80–100 мг/л магния. Его источником является выщелачивание доломитов или же магнезиальных минералов.
Источники: гидролиз магнезиальных минералов основных и ультраосновных пород, выщелачивание доломитов (rCa/rMg =1), магнезитов (rCa/rMg <<1). Силикатные и карбонатные породы дают не более 50 мг/л магния.