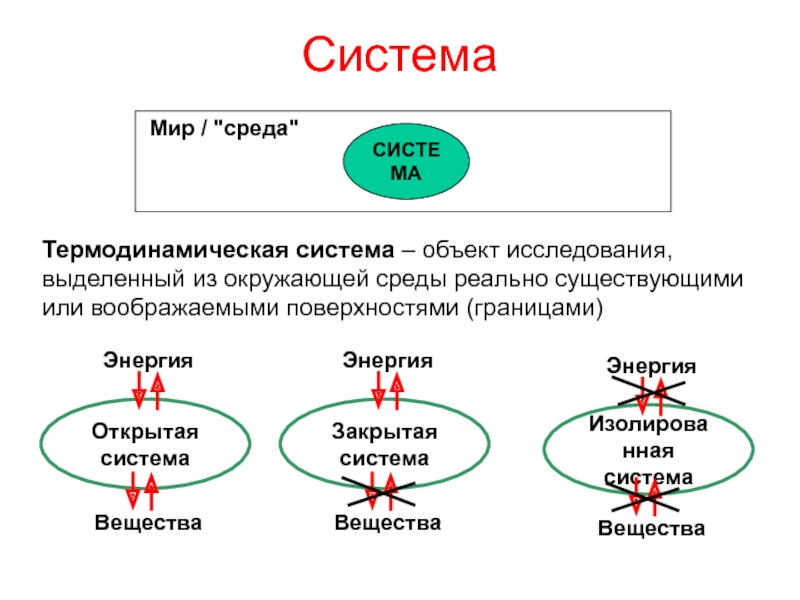
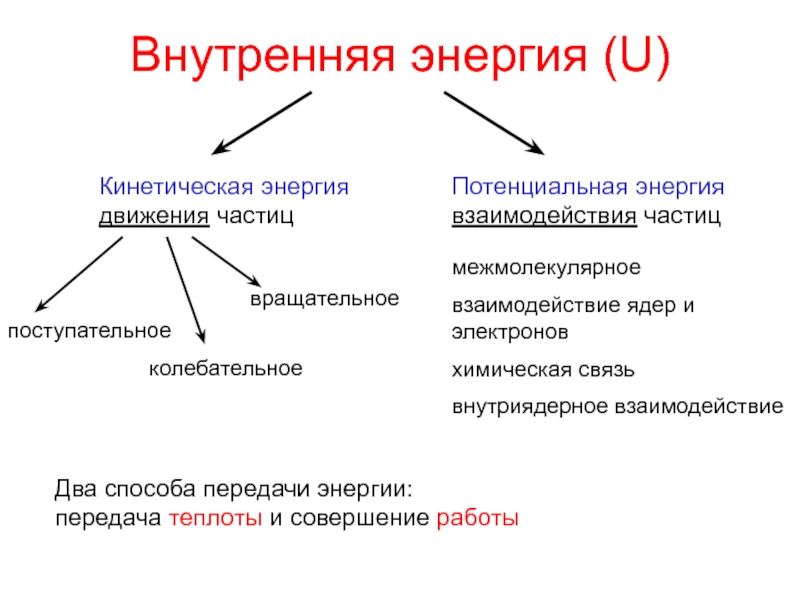
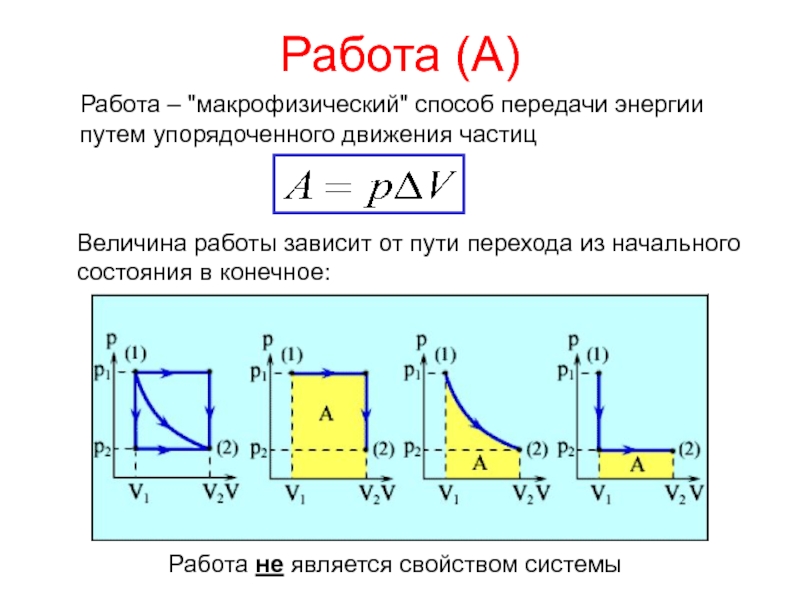
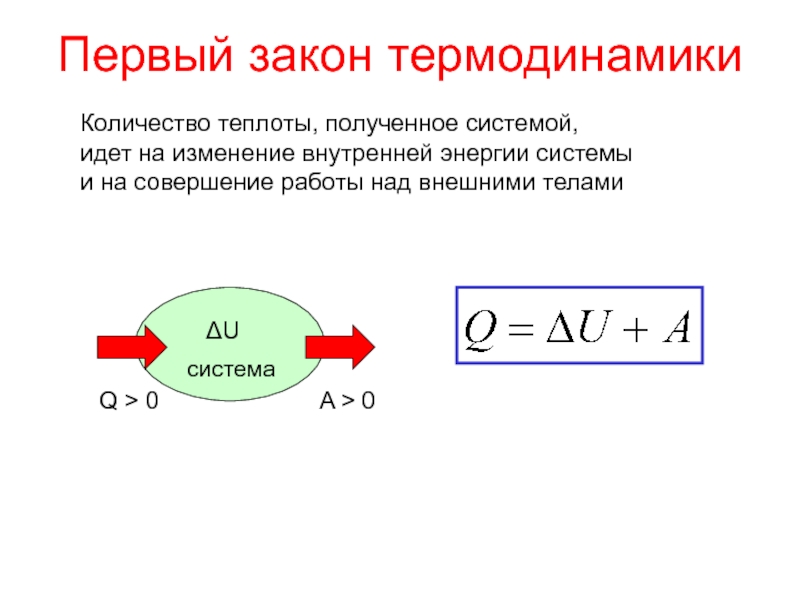
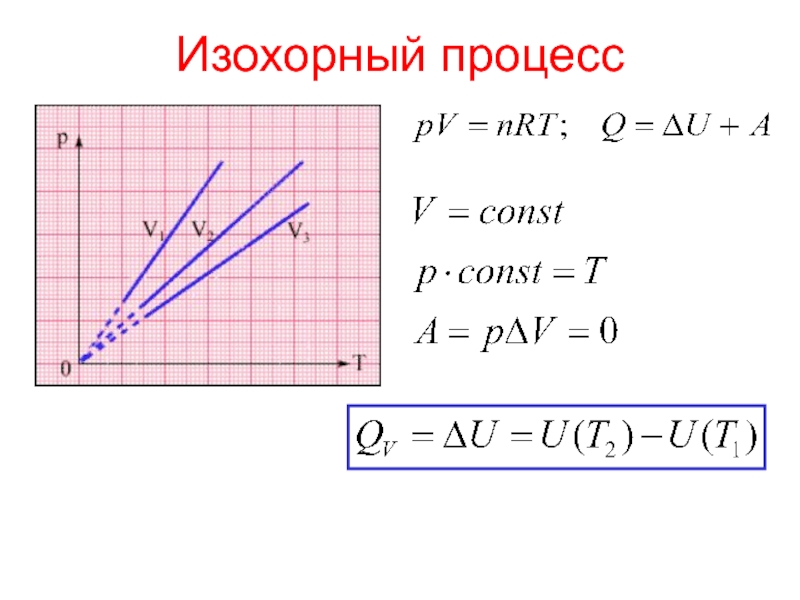
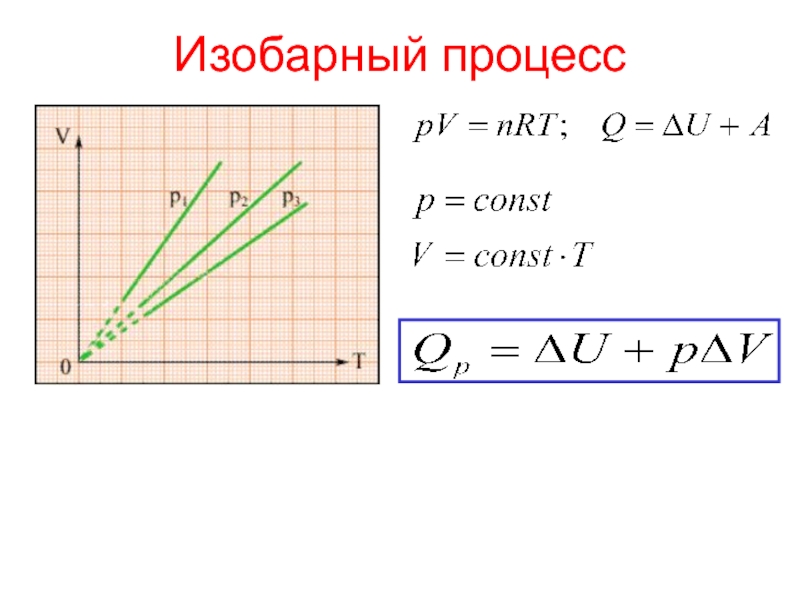
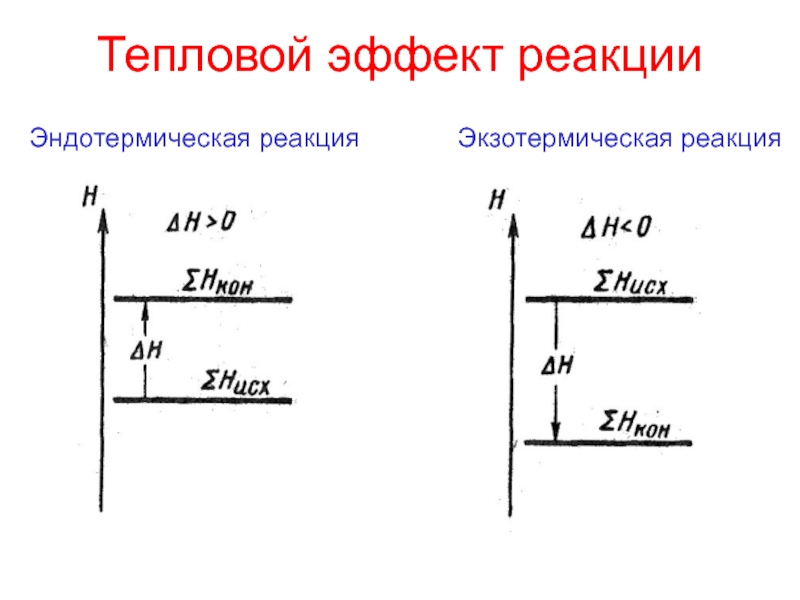
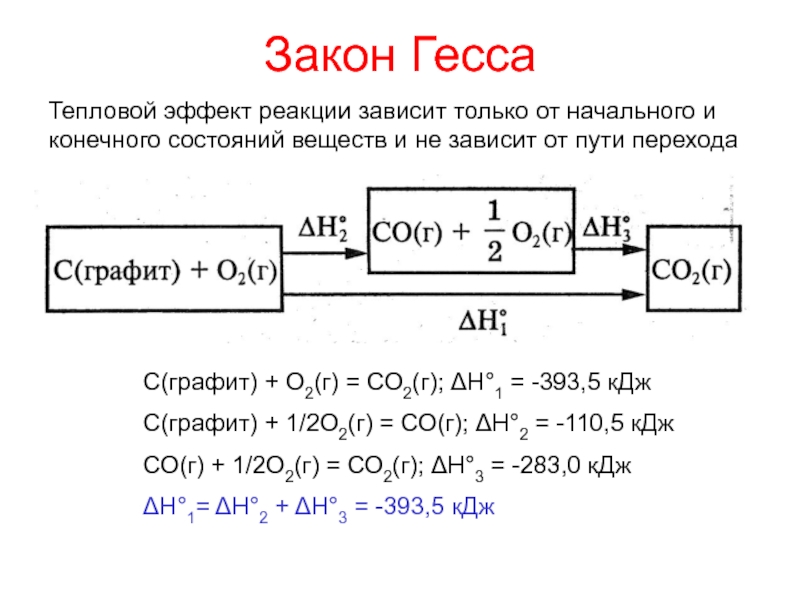
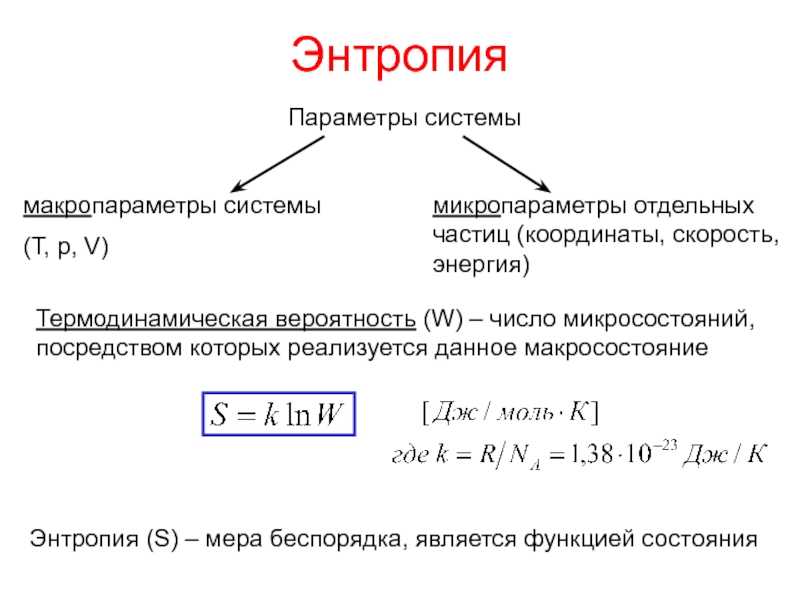
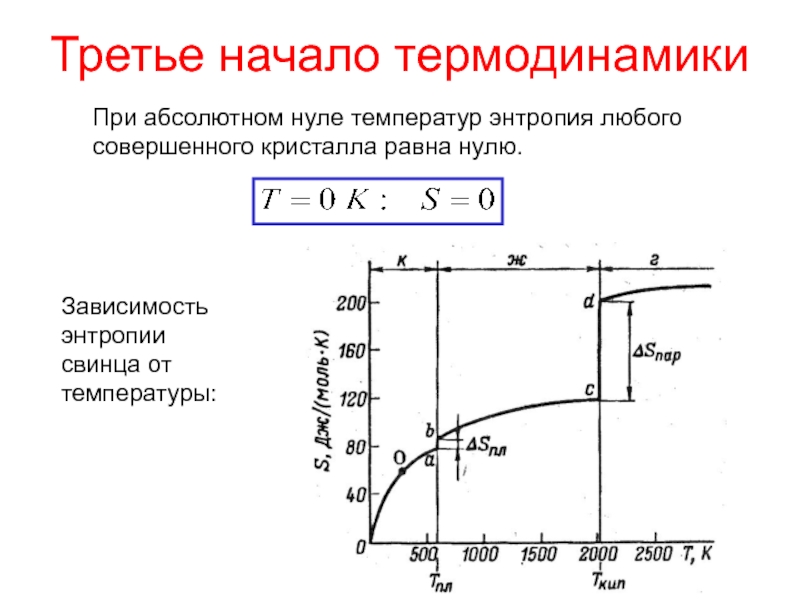
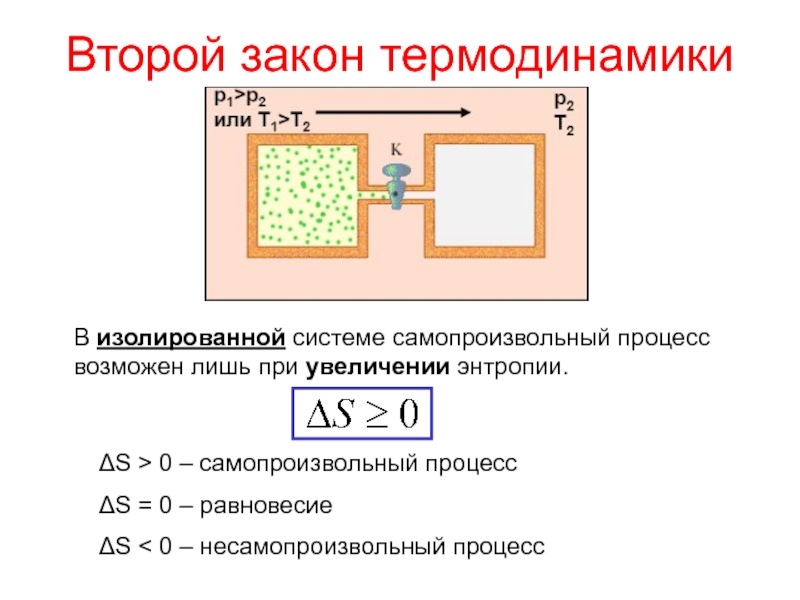
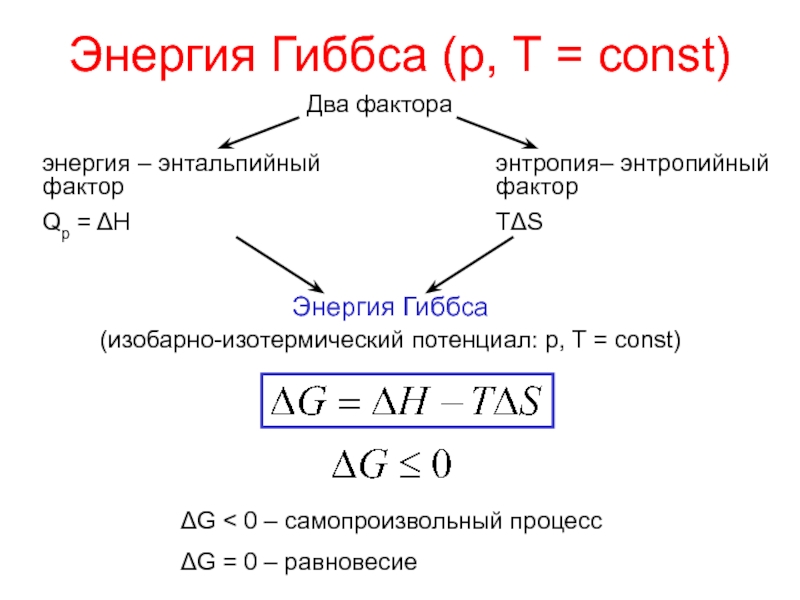
теплотой;
изучает взаимосвязь теплоты, работы и других видов энергии
Химическая термодинамика
изучает
превращения энергии при химических реакциях:энергетические эффекты химических процессов
возможность и направление самопроизвольного протекания реакций