Слайд 1Химия в строительстве
доктор технических наук, профессор
Матвеева Лариса Юрьевна
Слайд 2Содержание
Модуль 1. Тема: Металлы и сплавы. Коррозия металлов и
защита
Лекция 1 Часть1 .Свойства металлов
Вопросы:
1. Распространенность металлов в природе.
2.
Положение металлов в Периодической системе элементов Д.И. Менделеева.
3. Классификация металлов.
4. Физические свойства металлов.
5. Химические свойства металлов.
6. Кристаллическая структура металлов. Природа металлической связи.
Слайд 3Определение металлов
Металлы (от лат. metallum – шахта, рудник, греческого metallon
– копи) – эта вещества, обладающие в обычных условиях характерными,
так называемыми, металлическими свойствами:
высокой электрической проводимостью,
высокой теплопроводностью,
металлическим блеском,
непрозрачностью,
отрицательным коэффициентом электрической проводимости,
пластичностью.
В технике к металлам относят как собственно металлы (простые вещества), так и их сплавы, для которых также характерны металлические свойства.
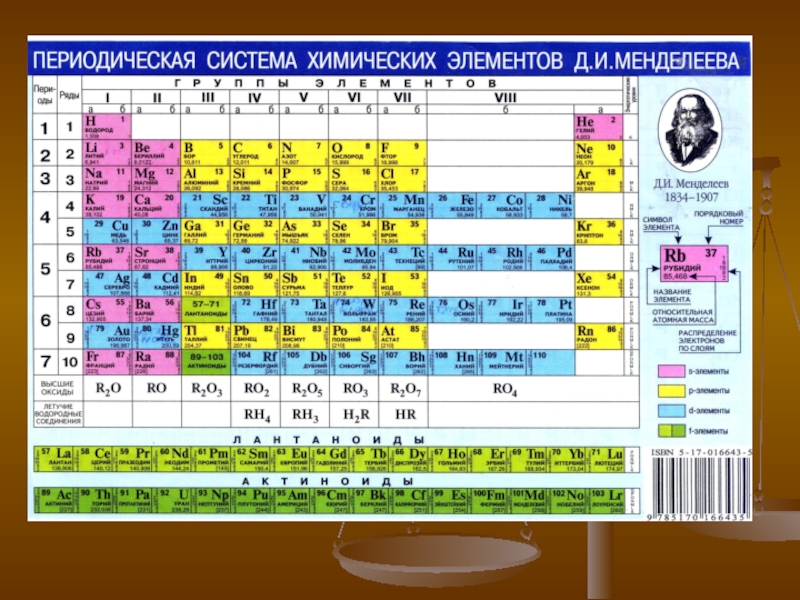
Слайд 4Металлы в периодической системе элементов Д.И. Менделеева
Из 118 химических элементов,
открытых на данный момент (из них не все официально признаны),
к металлам относят:
6 элементов в группе щелочных металлов,
6 в группе щёлочноземельных металлов,
38 в группе переходных металлов,
11 в группе лёгких металлов,
7 в группе полуметаллов,
14 в группе лантаноиды14 в группе лантаноиды + лантан,
14 в группе актиноиды14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
вне определённых групп бериллийвне определённых групп бериллий и магний.
Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
Слайд 6Современные представления о металлах
Металлы обладают специфическими механическими свойствами. Они более
или менее ковкие, а многие из них имеют большую прочность
при растяжении и при сжатии.
Раньше характерными признаками металлов считались блеск, пластичность и ковкость – «светлое тело, которое ковать можно» (М. В. Ломоносов.).
Но металлическим блеском обладают и некоторые неметаллы, например йод, кремний и др.
Известны и хрупкие металлы, например висмут.
В настоящее время одним из важнейших признаков металлов считается отрицательный температурный коэффициент электрической проводимости, т.е. понижение электрической проводимости с ростом температуры, и особенность электронного и кристаллического строения.
Слайд 7Распространенность металлов в природе
К наиболее распространенным в природе металлам относятся
алюминий, железо, кальций, натрий, калий, магний, титан.
В таблице приводится
содержание наиболее распространенных в природе металлов в литосфере (в земной коре на глубину до 16 км).
Большая часть металлов находится в земной коре в виде химических соединений (в виде минералов). К наиболее распространенным минералам относятся: силикаты, оксиды, сульфиды, карбонаты, сульфаты, фосфаты, галогениды.
Слайд 8Нахождение металлов в природе
Самыми распространенными минералами являются силикаты:
каолин А12О3∙2SiO2∙2Н2O, слюда белая К2O∙ЗА12О3∙6SiO2∙2Н2O, ортоклаз
К2О· А12О3∙6SiO2, асбест СаО∙MgO·4SiO2 и др.
К природным силикатам относятся полевые шпаты, глины, слюды, тальк, асбест и др. Силикаты, содержащие алюминий, называются алюмосиликатами.
Из оксидных минералов распространены магнетит Fe3O4, гематит Fe2O3, гетит Fe2O3·Fе(ОН)3, хромистый железняк FеО·Cr2O3, боксит А12О3∙xН2O, пиролюзит MnO2, гаусманит Мn3О4, куприт Сu2O и др.
Сульфидные минералы: железный колчедан FeS, свинцовый блеск PbS, цинковая обманка ZnS, киноварь HgS, антимонит Sb2S3, халькопирит СuFеS2
Карбонатные минералы: мел, мрамор, известняк, ракушечник - СаСO3, магнезит МgСО3, доломит СаСO3·МgСО3, малахит СuСО3∙Сu(ОН)2 и др.
Сульфатные минералы: мирабилит Nа2SO4·10Н2О, тенардит Na2SO4, гипс СаSO4∙2Н2O, кизерит МgSO4·Н2O, тяжелый шпат ВаSO4, и др.
Фосфатные минералы: апатиты ЗСа3(Р04)2СаF2, ЗСа3(РO4)2∙СаС12, гидроксил-апатит ЗСа3(РO4)2Са(ОН)2 и др.
Из галогенидов распространены минералы: каменная соль (галит) NaС1, сильвин КС1, карналлит КС1·МgС12∙6Н2O, флюорит СаF2.

Слайд 9Металлы в природе
Наименее активные металлы: ртуть, серебро, золото и металлы
платиновой группы находятся в земной коре в свободном виде (самородки),
но доля таких месторождений невелика.
Значительная часть металлов и их соединений находится в земной коре в виде месторождений, т.е. характеризуется неравномерным распределением. Но некоторые металлы не обладают способностью к концентрированию в земной коре,
т.е. распределены в какой-то мере равномерно; такие металлы относятся к рассеянным элементам. Обычно рассеянные элементы входят в виде изоморфной примеси в минералы более распространенных элементов, например, рубидий Rb изоморфно замещает калий К, кадмий Сd – цинк Zn, гафний Hf – цирконий Zr и т.д.
Слайд 10Химия металлов
К металлам относятся приблизительно 75% существующих элементов. К металлам
относятся все s-элементы, кроме водорода и гелия,
все d-элементы, все f-элементы и часть р-элементов: алюминий Аl, галлий Ga, германий Ge, индий In, олово Sn, сурьма Sb, таллий Tl, свинец Pb, висмут Bi, полоний Ро.
Граница между металлами и неметаллами в Периодической таблице в ее длинном варианте проходит по диагонали от бора В до астата Аt.
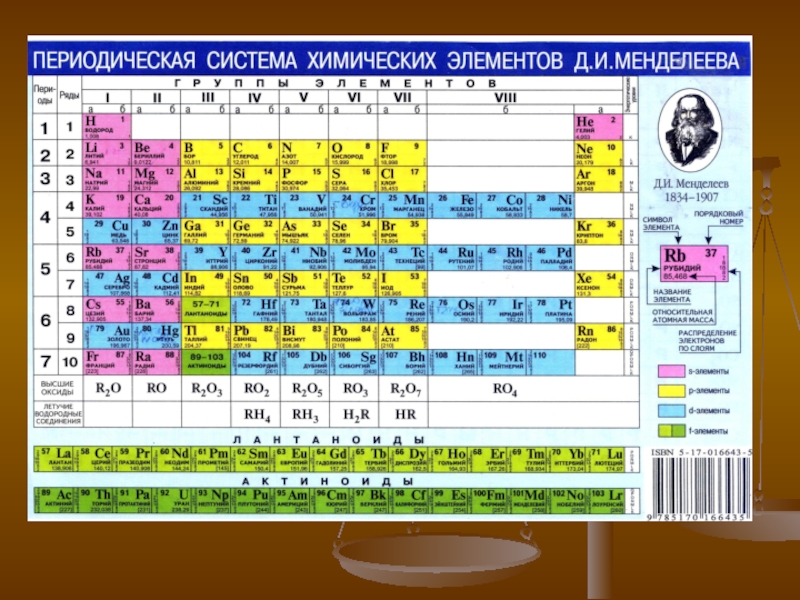
Слайд 12Все металлы в зависимости от их положения в Периодической таблице
Д.И. Менделеева делятся на четыре группы: s-металлы, р-металлы, d-металлы и
f-металлы. Две последние группы, т.е. d-металлы и f-металлы, объединяются под названием «переходные» металлы.
Эта классификация связана с природой валентных электронов. К s-металлам относятся металлы 1-й группы главной подгруппы Периодической таблицы Менделеева, имеющие один s-электрон на внешнем энергетическом уровне, и металлы II-й группы главной подгруппы, имеющие два s-электрона на внешнем энергетическом уровне.
Из s-металлов выделяют более узкие группы: «щелочные» металлы – это металлы первой группы главной подгруппы, а именно: литий Li, натрий Nа, калий К, рубидий Rb, цезий Cs, франций Fг (получен искусственно, стабильных изотопов не имеет); «щелочно-земельные» металлы: кальций Са, стронций Sr , барий Ва, радий Rа, т.е. металлы второй группы главной подгруппы, начиная с кальция.
Атомы р-металлов имеют на р-орбиталях внешнего энергетического уровня от одного до трех электронов. Всего таких металлов десять.
К d-металлам относятся те, у которых происходит изменение числа электронов от одного до десяти на предпоследнем энергетическом уровне. Данные металлы располагаются между вторым s-металлом и первым p-металлом 4-го и последующих периодов.
Классификация металлов

Слайд 13Металлы в периодической таблице Д.И. Менделеева
Из d-металлов выделяют группу благородных
металлов, которая включает в себя золото Аu и платиновые металлы:
рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir, платину Pt.
У f-металлов соответственно заполняются электронами f-подуровни третьего уровня, считая с внешнего; число электронов последовательно возрастает от одного до четырнадцати, f-металлы входят в 6-й (элементы № 58–71) и в 7-й (элементы № 90–103) периоды Периодической системы.
Группа «редкоземельных» металлов включает 17 металлов III-группы побочной подгруппы Периодической системы элементов: три d-металла – это скандий Sc, иттрий Y, лантан La и четырнадцать f-металлов (лантаноиды).
Семейство лантаноидов включает: церий Се, празеодим Рr, неодим Nd, прометий Рm, самарий Sm, европий Еu, гадолиний Gd, тербий Tb, диспрозий Dy, гольмий Но, эрбий Ег, тулий Тm, иттербий Yb, лютеций Lu. Редкоземельные металлы с четными порядковыми номерами распространены заметно больше, чем с нечетными номерами.
Актиноиды – это семейство из 14 радиоактивных элементов III-й группы побочной подгруппы 7-го периода периодической системы (порядковые номера 90–103): торий Th, протактиний Ра, уран U, нептуний Np, плутоний Pu, америций Am, кюрий Сm, берклий Вк, калифорний Cf, эйнштейний Es, фермий Fm, менделевий Md, нобелий No, лоуренсий Lr. Актиноиды, подобно лантаноидам, благодаря сходству конфигураций внешних электронных оболочек их атомов

Слайд 14Классификация металлов
Редкие элементы включают в себя малораспространенные в природе элементы
с содержанием в земной коре ниже 0,01 %. Из металлов
сюда относятся легкие металлы (литий Li, цезий Cs, бериллий Be, стронций Sr) редкоземельные, тугоплавкие (цирконий Zr, ниобий Nb, молибден Mo, тантал Ta, вольфрам W и др.), платиновые металлы, радиоактивные элементы (уран U, торий Th и др.).
Рассеянными с технологической точки зрения называются элементы, не образующие собственных месторождений и добываемые попутно при переработке руд других элементов или из нерудного сырья . Среди металлов рассеянными являются рубидий Rb, скандий Sc, галлий Ga, индий In, таллий Tl, гафний Hf, рений Re, кадмий Cd и др.
В промышленности имеет место разделение металлов на черные и цветные.
К черным относят железо Fe и сплавы на его основе. К цветным относят медь Cu, а также сплавы на ее основе и металлы, применяемые в этих сплавах или металлы, заменяющие медь в промышленности (свинец Pb, цинк Zn, никель Ni, олово Sn, алюминий Al, магний Mg и некоторые др.)
В технике в зависимости от свойств металлы классифицируют на те или иные группы, например, легкие металлы - плотность меньше 5 г/см, тяжелые – плотность больше 5 г/см3. К легким металлам относятся щелочные, щелочноземельные металлы, а также бериллий Be, магний Mg, алюминий Al, скандий Sc , титан Ti и иттрий Y, к тяжелым относятся все остальные металлы. Самый легкий металл – литий Li (ρ=0,531 г/см3), самый тяжелый – осмий Os (ρ=22,7 г/см3).
В зависимости от температуры плавления металлы принято делить на легкоплавкие и тугоплавкие. Металлы с температурой плавления ниже 1000°С относятся к легкоплавким, металлы с температурой плавления выше 1800°С – к тугоплавким.
Широко распространены названия: драгоценные металлы – к ним относятся серебро Ag, золото Au и платиновые Pt металлы; легирующие – это марганец Mn, хром Cr, вольфрам W, молибден Mo, ниобий Nb, ванадий V и др. металлы, небольшие добавки которых к сплавам придают сплавам новые свойства. При этом меняются плотность, температура плавления, электропроводность, твердость, пластичность, коррозионная стойкость и др.; радиоактивные металлы – это уран U, радий Ra, полоний Po, торий Th, плутоний Pu, актиний Ac, франций Fr и некоторые др.

Слайд 15Физические свойства металлов
Металлы обладают рядом сходных физических свойств, отличающих их
от неметаллов. Все металлы, за исключением ртути, – твердые вещества,
только температура плавления ртути лежит ниже нуля (–39°С). Наиболее тугоплавким металлом является вольфрам, его температура плавления 3395°С. Температуры плавления остальных металлов лежат в этих пределах.
Металлы обладают различной твердостью, которую сопоставляют с твердостью алмаза. Наиболее твердым металлом является хром. Мягкие металлы – литий, натрий, калий – легко режутся ножом.
Самым замечательным свойством металлов является очень высокая диэлектрическая проводимость, которая объясняется наличием свободных подвижных электронов в металле.
Непрозрачность металлов также объясняется присутствием свободных электронов. Подвижные электроны гасят световые колебания
Металлы обладают высокой отражательной способностью в видимой части света, вследствие чего они обладают характерным металлическим блеском.
Все металлы отражают радиоволны, на чем основана радиолокация (обнаружение металлических объектов с помощью радиоволн).
Механические свойства металлов – прочность, твердость, упругость характеризуют их способность сопротивляться деформации и разрушению при воздействии внешних напряжений.
Характерным механическим свойством металлов является пластичность, способность деформироваться под действием внешнего воздействия без нарушения металлической прочности. Пластичность имеет очень большое практическое значение. Благодаря этому свойству металлам можно придать требуемую форму.

Слайд 16Химические свойства металлов
Атомы металлов способны только отдавать валентные электроны, проявляя
восстановительные свойства:
Ме0 – nе– = Ме+n (окисление). Ме -
восстановитель.
Как восстановители металлы взаимодействуют с неметаллами, водой, растворами щелочей, кислот и солей.
Взаимодействие металлов с простыми веществами – неметаллами.
Металлы при определенных условиях взаимодействуют с неметаллами. Например, с кислородом они образуют оксиды:
to to
2Mg + O2 = 2MgO 4А1 + 3O2 = 2А12O3
Из щелочных металлов только литий при взаимодействии с кислородом образует оксид, натрий окисляется до пероксида, а другие щелочные металлы – до более сложных соединений:
4Li + O2 = 2Li2O 2Nа + O2 = Nа2O2
оксид лития пероксид натрия
При нагревании металлы реагируют с неметаллами:
to to
Mg + Вr2 = MgBr2 ЗСа + 2Р = Са3Р2
бромид магния фосфид кальция
to to
2А1 + N2 = 2А1N 4А1 + ЗС = А14С3
нитрид алюминия арбид алюминия
to to
Сu + S = СuS 2Mg + Si = Мg2Si
сульфид меди(II) силицид магния
Слайд 17
Химические свойства металлов
По химической активности металлы расположены в ряд, который
называют электрохимическим рядом напряжений. Этот ряд включает и водород, так
как его атомы, как и атомы металлов, образуют катионы Н+.
Li K Ba Ca Na Mg Be Al Mn Zn Cr Fe(II) Cd Ni Sn Pb H2 Cu Ag Hg Au
На основании ряда напряжений можно характеризовать химические свойства металлов: чем левее в ряду напряжений стоит металл, тем он химически активнее, тем больше его восстановительная способность.
Каждый металл, не взаимодействующий с водой, начиная с магния, вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей;
Металлы, стоящие в ряду напряжений до водорода, вытесняют (восстанавливают) его из разбавленных кислот (исключение HNO3).
Слайд 18Химические свойства металлов
С кислородом металлы образуют оксиды: 2Mg +
O2 =t 2MgO 4А1 + 3O2 =t 2А12O3; 4Li +
O2 = 2Li2O; 2Nа + O2 = Nа2O2
С водой при обычной температуре реагируют металлы, которые в ряду напряжений стоят до водорода (металл вытесняет водород из воды) и гидроксиды которых растворимы в воде. К таким металлам относятся щелочные и щелочно-земельные металлы: 2Nа + 2Н2O = 2NаОН + Н2↑;
Fе (II) + Н2O ≠ (так как Fе(ОН)2 нерастворим в воде)
При нагревании с водой или парами воды взаимодействуют металлы от магния до олова. Реакция протекает с образованием гидроксидов или оксидов и выделением водорода:
Мg + 2Н2O = Мg(ОН)2 + Н2↑; ЗFе + 4Н2O = Fе3O4 + 4Н2↑
Слайд 19С растворами щелочей реагируют металлы, которые в ряду напряжений стоят
до водорода (металл вытесняет водород из воды), а их оксиды
и гидроксиды амфотерны (оксидные и гидроксидные пленки растворяются в растворе щелочи).
К таким металлам относятся цинк, алюминий, олово, свинец и некоторые другие. Процесс протекает в три стадии:
-растворение в растворе щелочи пленки амфотерного оксида, которая покрывает поверхность металла;
-взаимодействие металла, освобожденного от защитной оксидной пленки, с водой с образованием нерастворимого амфотерного гидроксида;
-растворение образовавшейся пленки гидроксида в растворе щелочи:
А12O3 + 2NаОН + ЗН2O = 2Nа[А1(ОН)4]
2А1 + 6Н2O= 2А1(ОН)3↓+ ЗН2↑
2А1(ОН)3 + 2NаОН = 2Nа[А1(ОН)4]
Взаимодействие с щелочами
Слайд 20Взаимодействие с кислотами и растворами солей
С разбавленными кислотами, которые проявляют
окислительные свойства за счет ионов водорода (разбавленные серная, фосфорная, сернистая,
все бескислородные и органические кислоты и др.) НС1, Н2S04, НСООН реагируют металлы, расположенные в ряду напряжений до водорода (эти металлы способны вытеснять водород из кислоты, а также, образующие с этими кислотами растворимые соли (на поверхности этих металлов не образуется защитная солевая пленка).
2А1 + 6НС1 = 2А1С13 + ЗН2↑
Mg + Н2SO4 = МgSO4 + Н2↑
Сu + Н2SO4 ≠ (так как Сu стоит после Н2)
Рb + Н2SO4 ≠ (так как РbSO4 нерастворим в воде)
С растворами солей:
Каждый металл, начиная с магния, вытесняет все следующие за ним в ряду напряжений металлы из растворов их солей:
Fе + СuSO4= FеSO4 + Сu
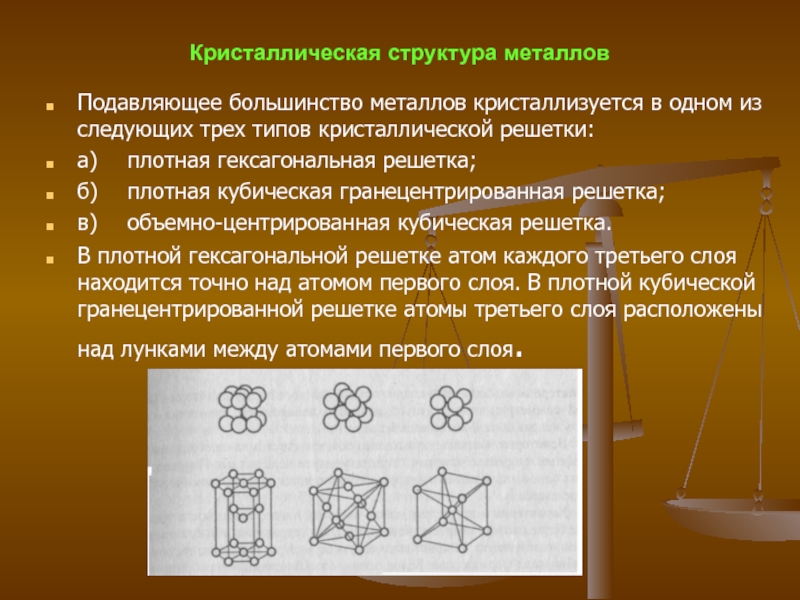
Слайд 21Кристаллическая структура металлов
Подавляющее большинство металлов кристаллизуется в одном из следующих
трех типов кристаллической решетки:
а) плотная гексагональная решетка;
б) плотная кубическая гранецентрированная решетка;
в) объемно-центрированная кубическая
решетка.
В плотной гексагональной решетке атом каждого третьего слоя находится точно над атомом первого слоя. В плотной кубической гранецентрированной решетке атомы третьего слоя расположены над лунками между атомами первого слоя.
Слайд 22Природа металлической связи
Металлическая связь – особый вид химической связи, присущей
исключительно металлам. Особенность металлической связи заключается в том, что кристаллическая
решетка металлов образована положительно заряженными ионами, тогда как электроны высших энергетических уровней делокализованы по всему пространству металла.
Согласно квантовой механике в металлическом кристалле распределение электронов претерпевает значительные изменения. При образовании металлического кристалла из свободных атомов, сближение их приводит к усилению взаимодействия между ними, поэтому внешние энергетические уровни электронов смещаются, расщепляются, расширяются и частично смыкаются, образуя вместо дискретных уровней практически непрерывные энергетические зоны. Такое изменение состояния не затрагивает электроны внутри слоев, т.е. внутренние электроны атомов не обобществляются, они прочно фиксированы каждый у «своего» атома. Поэтому эти электроны вместе с ядром атома образуют положительный ион данного металла, участвующий в структуре металлического кристалла, как единое целое. Электроны же внешних энергетических уровней уже не принадлежат отдельным атомам, т.е. происходит их «обобществление», возникают свободные электроны.
Совокупность свободных электронов часто называют «электронным газом».

Слайд 23Электрическая проводимость металлов
Способность делокализованных электронов свободно передвигаться по кристаллу и
переносить энергию из более нагретой его части в менее нагретую
объясняет и высокую теплопроводность металлов.
Наличие свободных электронов проявляется и в других явлениях. Так раскаленные металлы испускают электроны (термоэлектронная эмиссия). Эмиссия возникает и под действием электромагнитного излучения в видимой и ультрафиолетовых областях спектра (фотоэлектрический эффект) при бомбардировке поверхности металлов электронами (вторичная электронная эмиссия) или ионами (ионно-электронная эмиссия). Электрический ток в металлах возникает и при перепаде температур.
При нагревании колебания атомов металла в кристаллической решетке становятся более интенсивными, это затрудняет движение электронов. Поэтому с повышением температуры электрическое сопротивление металлов возрастает, что и приводит к уменьшению электропроводности.
При сильном охлаждении, при температурах, близких к абсолютному нулю, может наступить явление сверхпроводимости, когда практически исчезает сопротивление металла электрическому току.

Слайд 24Содержание
Модуль 1. Тема: Металлы и сплавы. Коррозия металлов и
защита
Лекция 1. Часть 2
Вопросы:
1. Сталь. Чугун. Железо. Свойства. Применение.
2. Производство
чугуна. Доменный процесс.
3. Производство стали.
4. Легированные стали.
5. Строительные стали. Применение в строительстве.
Слайд 25Сталь. Чугун. Железо
Металлургия черных металлов включает производство железа и
сплавов на основе железа – чугуна, стали, ферросплавов и является
ведущей отраслью промышленности. Сталь и чугун – это сплавы железа с углеродом.
Чугуном называют сплав, содержащий более 2,14% углерода, сталью – меньше 2,14% углерода.
Кроме углерода сталь и чугун всегда содержат в небольших количествах марганец, кремний, фосфор, серу.
Ферросплавы (специальные чугуны) составляют 2–3% всего производства чугуна и имеют в своем составе повышенное содержание элементов: ферросилиций (9–13% Si), ферромарганец (10–25% Мn), богатый ферромарганец (70–75% Мn) и др. Ферросплавы применяют для легирования сталей.
Слайд 26Железо. Свойства. Применение
Железо – блестящий пластичный металл серебристо-белого цвета, хорошо
поддается ковке, прокатке и другим видам механической обработки, Тпл.=1539 °С,
плотность при 20 °С составляет 7,87 г/см3.
Железо относительно легко проводит электрический ток (около 19% от электропроводности серебра).
Во влажном воздухе железо быстро ржавеет, превращаясь постепенно в FeO(OH), а также другие соединения, которые, вследствие своей рыхлой структуры, не защищают железо от дальнейшего окисления; при нагревании на воздухе до красного каления образуется Fe3O4. В воде железо интенсивно корродирует. В разбавленных кислотах железо легко растворяется с образованием солей Fe(II) и выделением водорода. Концентрированные азотная и серная кислоты пассивируют железо, что используется в технике. При обычных условиях оно не взаимодействует с растворами щелочей.
Железо – один из самых распространенных элементов в природе, его содержание в земной коре составляет 4,65% (по массе). Известно свыше 300 минералов железа, важнейшие среди них: магнетит (магнитный железняк) Fe3O4; гематит (красный железняк) Fe2O3; лимонит (бурый железняк) Fe2O3∙nH2O; сидерит (шпатовый железняк) FeCO3, железо входит в состав природных силикатов и др. Наряду с полезными примесями – Мn, Сг, V, Тi Ni, Со железные руды содержат вредные примеси – фосфор, серу и др.
Железо и его сплавы составляют основу современной техники. Технически чистое железо (0,02% С; 0,035% Мn; 0,14% Сг; 0,02% S; 0,015% Р) выплавляют из чугуна в сталеплавильных печах или кислородных конвертерах. Чистое железо получают различными методами (электролиз, разложение пентакарбонила Fe(CO)5, восстановлением оксидов железа Н2, СО и др. восстановителями).
Чистое железо (губчатое железо с добавками) и особо чистое железо применяют в электротехнике, где используют его магнитные свойства, а также при производстве специальных сталей.

Слайд 27Внедоменная металлургия
Существует метод прямого восстановления железа из руд с помощью
смешанного газа (СО + Н2), в результате так называемых процессов
внедоменной металлургии.
Прямым восстановлением железо получают в виде железной губки (97–99 % Fе) в твердом состоянии. При данном методе улучшается экология, отпадает необходимость в дорогостоящем коксе, что кроме экономии определяет отсутствие в полученном железе вредных примесей серы и фосфора, переходящих при доменной плавке из кокса.
В России построен на базе руд Курской магнитной аномалии Оскольский металлургический комбинат (г. Старый Оскол, Белгородской области) по производству железа прямым восстановлением.
Слайд 28Производство чугуна. Доменный процесс
Получение чугуна в доменной печи и переплавка
чугуна в сталь в настоящее время являются основой металлургии. Основную
массу железа выплавляют в виде чугуна и стали.
Железные руды в зависимости от содержания в них пустой породы делят на богатые (45–70% Fе) и бедные. Промышленное значение имеют руды с содержанием железа свыше 16%.
В доменных печах непосредственно плавят железные руды, богатые железом, предварительно раздробленные. Чаще всего плавят окускованный железорудный концентрат, полученный из измельченной и обогащенной руды. Массовое содержание железа в концентратах составляет 60–70%. Перед плавкой мелкие и порошкообразные концентраты предварительно окусковывают. Применяют два способа окусковывания: англомерация с получением англомерата и окомковывание (окатывание) с получением окисленных окатышей. Восстановление оксидов железа в доменной печи является очень сложным процессом. Исходными материалами при этом являются: железная руда или рудный концентрат, содержащие оксиды железа, кокс (специально обработанный уголь), флюсы. Данная сложная смесь называется шихтой.
Кокс является топливом и источником получения восстановителя СО.

Слайд 29Доменная печь
Состав шлака зависит от состава шихты и марки выплавляемого
чугуна. Шлак используется в производстве строительных материалов (шлаковый кирпич, шлаковая
вата, цемент и др.). Доменная печь относится к печам шахтного типа.
Высота доменной печи в зависимости от производительности достигает 35 м и более, диаметр в самом широком месте составляет –7,5 м. Печь заключена в стальной кожух и устанавливается на железобетонном фундаменте, внутри выложена огнеупорами. Сверху в доменную печь вводится шихта, снизу под давлением через фурмы подается горячий воздух (дутье). Колошник 2 предназначен для приемки шихты и отвода образующегося доменного газа, приблизительный cocтав которого: 25–34% СО, 1–3% Н2, остальное С02, N2 и др. Доменный газ после очистки используется на подогрев дут для доменной печи и др. Коническая часть шихты облегчает продвижение шихты сверху вниз. На уровне распара заплечников 3 образовавшееся губчатое железо науглероживается, постепенно плавится, и для удержания в распаре этой массы, объем которой уменьшается, заплечники 3 сужаются. Жидкий чугун накапливается в горне на лещади 7.

Слайд 30Процесы в доменной печи
При сжигании угля в доменной печи образуется
углекислый газ, который, проходя через слой раскаленного угля, восстанавливается до
оксида углерода (II):
С + О2 = СО2; СО2 + С = 2СО.
Окись углерода (II) восстанавливает руду (Fe2О3). Продукты восстановления зависят от температуры, которая возрастает по мере движения руды к низу домны.
При 400–500 °С железо Fe(III) частично восстанавливается в Fe(II):
3Fe2О3 + СО = 2Fe3О4 + СО2.
Передвигаясь в зону более высоких температур (600 °С), все железо (III) превращается в железо (II):
Fe3О4 + СО = 3FeO + СО2.
При температурах 700–900 °С железо (II) восстанавливается до металлического железа:
FeO + СО = Fe + СО2
Некоторое количество оксидов железа при температурах 1000–1100 °С также восстанавливается углеродом:
FeO + C = Fe + CO.
Образующееся в доменной печи металлическое железо сначала находится в твердом состоянии (губчатое железо), так как железо имеет высокую температуру плавления (1539 °С).
Слайд 31ЧУГУН
Расплавленное железо растворяет в себе углерод, цементит, кремний, марганец,
фосфор, серу с образованием чугуна.
Жидкий чугун и шлаки стекают в
горн, и поскольку плотность чугуна ~ 6,9 г/см3, а плотность шлака ~ 2,5 г/см3, то более легкий шлак собирается над чугуном, предохраняя его от окисления. Жидкий чугун и шлак легко отделяются друг от друга, вытекая из доменной печи через отверстия, расположенные на разных уровнях. Максимальная температура в доменной печи достигает 1600–1750 °С.
Получаемый чугун содержит около 93% железа, от 2,5% до 5% углерода и небольшие количества кремния (0,5–4%), марганца (1–3%), фосфора (0,02–2,5%) и серы (0,005–0,08%).
В зависимости от условий охлаждения получаются два вида чугуна: белый и серый. При быстром охлаждении чугуна углерод выделяется в виде цементита Fе3С, образуется белый чугун. Он обладает высокой твердостью, но хрупок, поэтому имеет ограниченное применение. В основном его перерабатывают на сталь, поэтому называют передельным. При медленном охлаждении жидкого чугуна углерод выделяется в виде графита, образующийся при этом чугун имеет серый цвет, потому называется серым чугуном. Серый чугун характеризуется высокими литейными свойствами и применяется в машиностроении для отливки тяжелых частей машин, маховиков, коленчатых валов двигателей, поршней, цилиндров и др.
Чугун является основным исходным материалом для получения стали, на это расходуется примерно 80–85% всего чугуна. В то же время чугун – наиболее распространенный литейный сплав.
Переработка чугуна в сталь связана с удалением серы, фосфора, кремния и снижением содержания углерода (до ~ 2% и менее).

Слайд 32Производство стали в мире составляет 90–95 % производства всех металлов.
Сталь является основой промышленного производства и строительства, важнейшим продуктом черной
металлургии. Содержание углерода в стали меньше 2,14 %.
Высокоуглеродистые стали содержат более 0,6% С; среднеуглеродистые 0,25–0,6% С и низкоуглеродистые – менее 0,25% С. В стали присутствуют примеси: марганец (до 0,8%), кремний (до 0,4%), фосфор (до 0,07%), сера (до 0,06%).
Сталь по сравнению с чугуном имеет более высокие механические свойства. Задача переплавки чугуна в сталь заключается в удалении из чугуна избытка углерода, кремния, марганца и вредных примесей фосфора и серы, которые придают стали хрупкость. Углерод из чугуна, окисляясь кислородом, превращается в газообразные оксиды (СО и С02). Кремний, марганец, сера, фосфор и др. в результате ряда реакций, протекающих при переплавке, переходят в различные малорастворимые или нерастворимые соединения, которые с флюсами образуют на поверхности металла шлак.
Процесс выплавки стали завершается конечной операцией – раскислением, которая заключается в восстановлении железа из FеО, наличие которого в стали ухудшает механические свойства. Для легированных сталей процесс раскисления обычно совмещают с легированием. Раскисление производится ферромарганцем и ферросилицием, при этом железо восстанавливается:
FеО + Мn = Fе+ МnО,
2FеО +Si = 2Fе = SiO2.
Для полного удаления кислорода в конце процесса добавляется немного алюминия:
2FеО + А1 = 2Fе + А12O3.
Производство стали

Слайд 33Способы производства стали
В настоящее время основными способами производства стали являются
кислородно-конвертерный, мартеновский, бессемеровский (конвертерный) и электросталеплавильный.
Бессемеровским (конвертерным) методом получают низкосортные
стали, в мартеновских печах получают легированные стали.
Кислородно-конвертерный способ позволяет выплавлять сталь широкого ассортимента. В качестве шихты используется: жидкий чугун, железный лом, рудный концентрат, флюсы.
При мартеновской плавке шихтовые материалы – это передельный чугун (в твердом и жидком состоянии), рудный концентрат, стальной лом (скрап), флюсы. Мартеновский способ менее экономичен, чем конвертный и электросталеплавильный.
В последнее время широкое применение в черной металлургии получила выплавка стали в особых электрических печах (электросталеплавильный метод: дуговые и индукционные электропечи), позволяющих осуществлять плавку в вакууме, под высоким давлением, при высоких температурах расплава (свыше 3000 °С).
Данный метод применяется для выплавки наиболее качественных сталей, высоколегированных и сплавов особого назначения, например тугоплавких, содержащих молибден, вольфрам, коррозионностойких, жароупорных и др.

Слайд 34Легированные стали
Легированные сплавы, которые выдерживают широкий диапазон температур (от –269
до +1200 °С, в отдельных случаях до 2000–2500 °С) при
повышенных давлениях, в агрессивных средах, обладающих определенным комплексом магнитных, электрических, оптических и других свойств.
С железом легирующие элементы образуют твердые растворы, т.е. они могут входить в состав феррита и аустенита, упрочняя их.
По отношению к углероду легирующие элементы делятся на две группы: 1) элементы, которые с углеродом образуют устойчивые химические соединения, – карбиды (хром, молибден, марганец, вольфрам, ванадий, цирконий, титан и др.); данные карбиды тверже карбида железа и менее хрупки;
2) элементы, которые в стали не образуют карбидов (никель, кобальт, алюминий медь и др.); они способствуют процессу графитизации стали.
Легированная сталь в зависимости от структуры, получаемой при охлаждении, разделяется на пять классов: 1) перлитная;
2) мартенситная; 3) аустенитная; 4) ферритная и 5) карбидная.
Слайд 35Виды легированной стали
1) Перлитная сталь получается при малом количестве легирующих
элементов (до 5%). Она хорошо обрабатывается режущим инструментом и значительно
улучшает механические свойства после термической обработки (закалки и отпуска).
При увеличении содержания легирующих элементов (свыше 5%) происходит переход перлитной стали в 2) мартенситную, которая обладает очень высокой твердостью и трудно поддается обработке резанием.
При очень большом содержании (10–30%) легирующих элементов (Ni, Мn и Со) в стали сохраняется структура аустенита при обычных температурах. Такая сталь относится к 3) аустенитному классу, среди них нержавеющие немагнитные и жаропрочные стали.
Сталь 4) ферритного класса в отожженном состоянии имеет структуру легированного феррита с небольшим количеством цементита. Стали ферритного класса содержат значительное количество легирующих элементов Сг, W, и не воспринимают закалку.
5) Карбидная сталь содержит значительное количество углерода и карби-дообразующих элементов (Сr, W, Мn, Тi, Zr). В этих сталях образуются слоистые карбиды, располагающиеся в основной массе. Сталь карбидного класса применяют для изготовления инструментов.
Легированные стали и сплавы делят на несколько классов: нержавеющие, жаростойкие и жаропрочные, износоустойчивые, магнитные, с особыми тепловыми свойствами и др.

Слайд 36Строительные стали
Строительные конструкционные стали предназначены для работы в атмосферных условиях
при обычных и пониженных температурах.
Строительные стали должны обладать хорошей
свариваемостью, пластичностью, хорошей обрабатываемостью резанием. Низкоуглеродистую сталь обыкновенного качества применяют для изготовления строительных конструкций.
Несущие сварные и клепаные конструкции зданий и сооружений изготавливают из мартеновской и кислородно-конвертерной стали. Для конструкций, не имеющих сварных соединений, и для сварных конструкций, подверженных только статическим нагрузкам, применяют в основном мартеновскую сталь.
Конструкции из листовой стали (резервуары, трубопроводы и другие изделия) изготавливают из стали различных марок: мартеновской или конвертерной, кипящей или полуспокойной. Эти стали обладают хорошей свариваемостью, достаточно высокой ударной вязкостью, малочувствительны к концентрации напряжений.
Слайд 37
Применение сталей в строительстве
Стали с гарантированными механическими свойствами применяют в
качестве арматурной стали для армирования различных обычных и железобетонных конструкций.
Основным
материалом для строительных стальных конструкций в течение многих лет была низкоуглеродистая сталь. Растущие потребности строительной техники требуют снижения массы строительных конструкций и уменьшения их сечения, а также применения сталей с более высокими физико-механическими свойствами, что и привело к замене углеродистых сталей низколегированными.
Низколегированные строительные стали обладают высокой пластичностью и ударной вязкостью. Для улучшения структуры, уменьшения чувствительности сталей к старению и хладоломкости в них иногда вводят (в сотых долях %) титан, бор, вольфрам, цирконий, ванадий. Низколегированные стали применяют в строительстве для сварных и клепаных конструкций, для армирования железобетонных конструкций.
Слайд 38Мостовые металлические конструкции
Мостовые металлические конструкции изготавливают из горячекатаной малоуглеродистой мартеновской
стали. Структура мостовых сталей должна быть однородной, мелкозернистой, без дефектов.
Прочностные характеристики (предел прочности, предел текучести, относительное удлинение, ударная вязкость) имеют решающее значение для элементов мостовых конструкций.
Слайд 39Металлические строительные конструкции
Слайд 40Металлические строительные конструкции
Слайд 42Лекция окончена.
Спасибо за внимание.