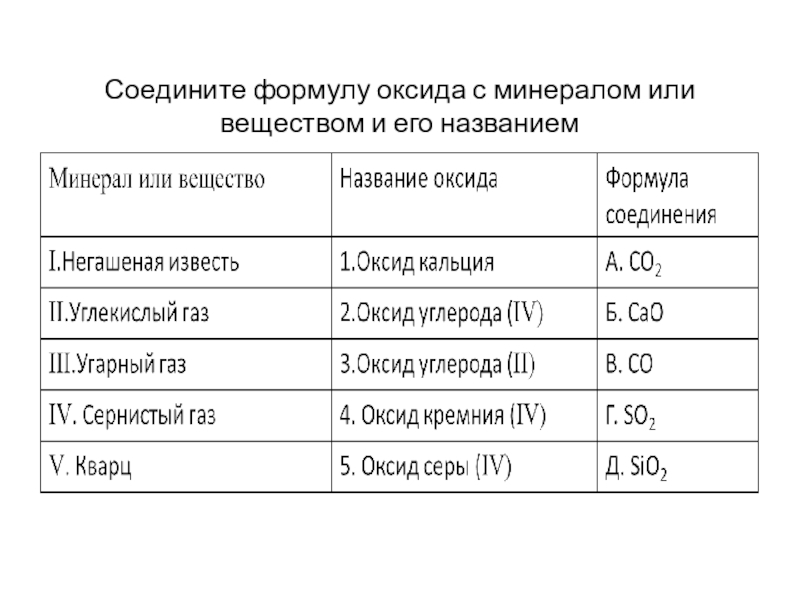
негашеная известь- оксид кальция)
Рациональная номенклатура для неорганический веществ
СО2 — оксид углерода (IV), тривиальное название «углекислый газ»;Международная номенклатура
Построение названий органических веществ в соответствии с номенклатурой IUPAC