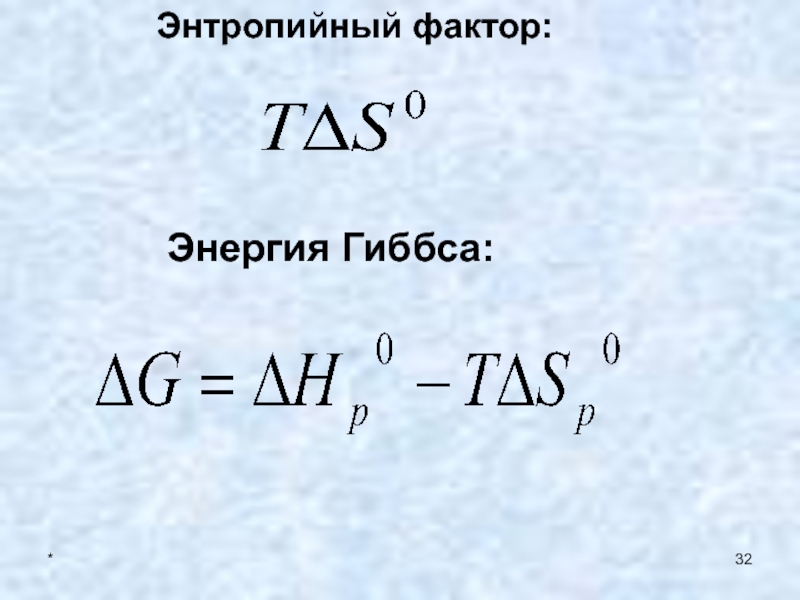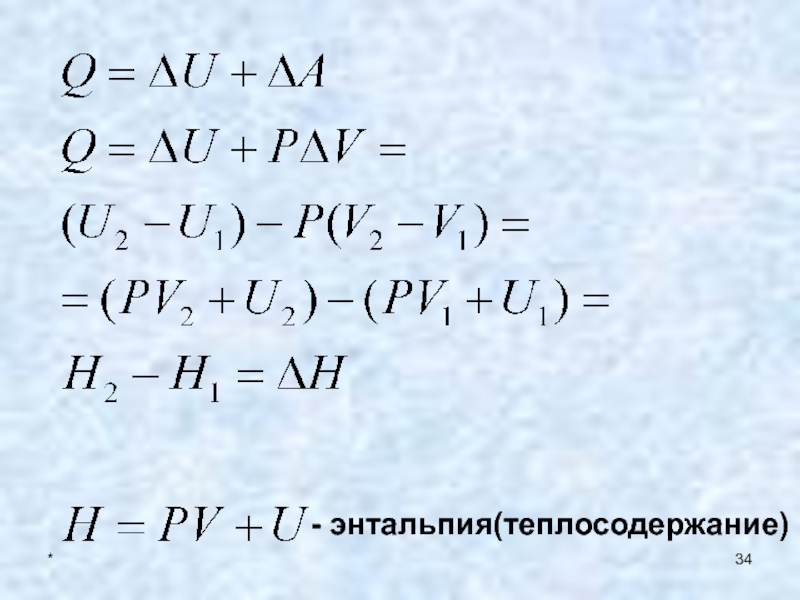Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Законы сохранения в ХТП
Содержание
- 1. Законы сохранения в ХТП
- 2. *1. Классификация химических реакцийХимико-технологический процесс (ХТП) –это
- 3. *1. Классификация химических реакцийЦель химической технологии –провести
- 4. *1. Классификация химических реакцийДля анализа хода процесса
- 5. *1. Классификация химических реакцийВ зависимости от фазового
- 6. *
- 7. *
- 8. *
- 9. *
- 10. *1. Классификация химических реакцийПоскольку скорость реакции взаимодействия
- 11. *
- 12. *2. Реакционная способностьОдной из основных задач химии
- 13. *2. Реакционная способностьРеакционная способность, характеристика химической активности
- 14. *2. Реакционная способностьКоличественно Реакционную способность выражают
- 15. *2. Реакционная способностьЭлектронные смещения качественно описываются в
- 16. *2. Реакционная способностьСкорость химической реакции прямо пропорциональна
- 17. *2. Реакционная способностьЗакон действующих масс устанавливает связь
- 18. *2. Реакционная способностьгдеai — активности веществ, выраженные
- 19. *2. Реакционная способностьНа практике в расчётах, не
- 20. *2. Реакционная способностьХимическое равновесие — состояние химической
- 21. *2. Реакционная способностьВсе химические реакции, в принципе,
- 22. *2. Реакционная способностьПоложение химического равновесия зависит от
- 23. *2. Реакционная способностьДля того, чтобы совершился элементарный
- 24. *2. Реакционная способностьЭнергия активации в химии и
- 25. *2. Реакционная способностьВ химической модели, известной как
- 26. *
- 27. *2. Реакционная способностьПри низкой (для определённой реакции)
- 28. *2. Реакционная способностьr = Gпродукта/(V*t) = (GнА
- 29. * P -
- 30. * Q>0, ΔH
- 31. * Стандартные условия: t=25°C, T=298K
- 32. * Энтропийный фактор:Энергия Гиббса:
- 33. * Энергия Гиббса характеризует динамику, направленность
- 34. *- энтальпия(теплосодержание)
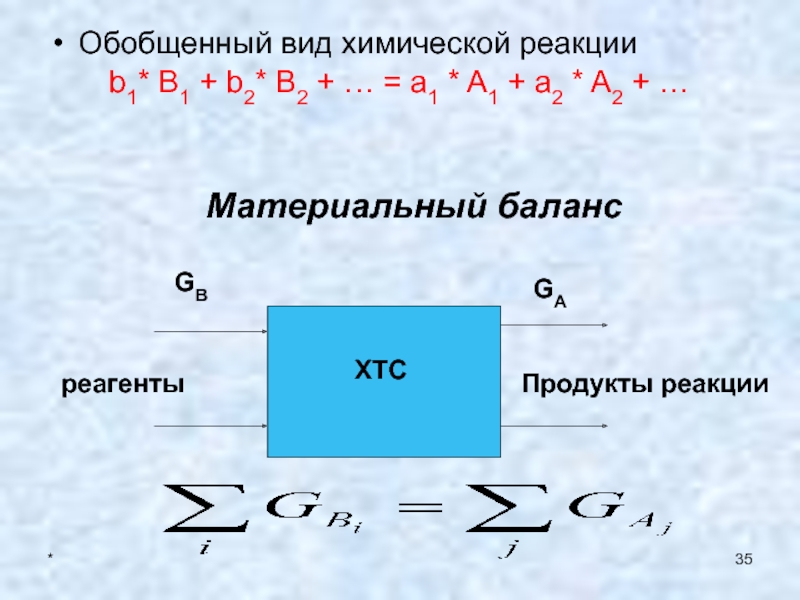
- 35. *Обобщенный вид химической реакции
- 36. *3. УСЛОВИЕ ЗАДАЧИCH4 C
- 37. *Теплофизические данныеАтомные массы: водорода = 1, кислород=16, углерод=12.
- 38. *4. Химическая реакцияОпределяем молярный объем для продуктов
- 39. * 4. Определяем расход
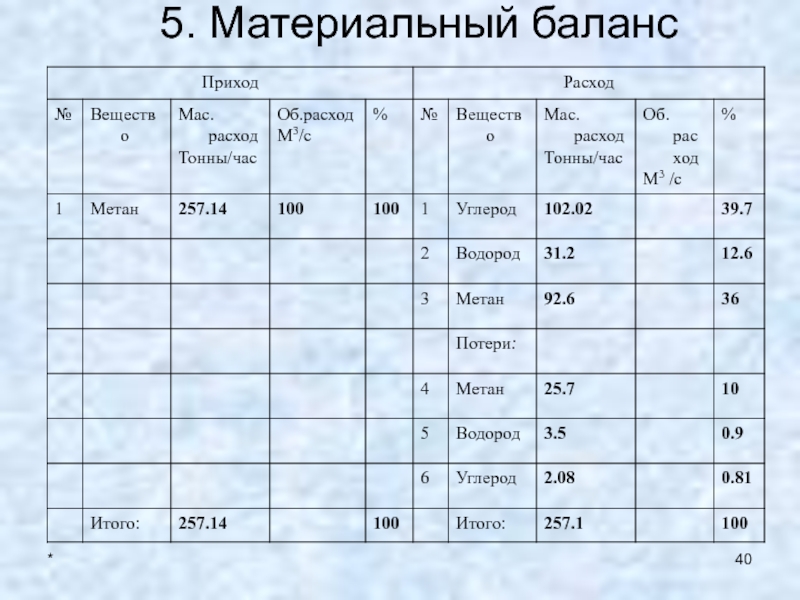
- 40. *5. Материальный баланс
- 41. *5. Материальный балансОпределим расходный коэффициент по углероду,
- 42. *5. Материальный балансПрореагировало метана 138.8 т/час, тогда
- 43. *6. Тепловой балансТепловые потоки ХТП Q1+
- 44. *Тепловые потокиQ1, Q4– тепловые потоки пропорциональные
- 45. *Тепловой эффект реакцииТепловой эффект реакции при нормальных условияхИзменение теплоемкости в процессе реакцииИзменение температуры в процессе реакции
- 46. * 12. Определяем нормальный молярный тепловой эффект
- 47. * 16. Определяем молярный тепловой эффект при
- 48. * 18. Определим энтальпии сырья и продуктов:
- 49. *
- 50. *Определим массовый расход теплоносителя:
- 51. *
- 52. Скачать презентанцию
*1. Классификация химических реакцийХимико-технологический процесс (ХТП) –это производственный процесс, при осуществлении которого изменяют химический состав перерабатываемого продукта с целью получения вещества с другими свойствами.Любой ХТП разделяется на ряд стадий:Подвод реагирующих компонентов
Слайды и текст этой презентации
Слайд 1*
Лекция 7.2.
Законы сохранения в ХТП
Классификация реакций
Реакционная способность
Условие задачи
Химическая реакция
Материальный
баланс
Слайд 2*
1. Классификация химических реакций
Химико-технологический процесс (ХТП) –это производственный процесс, при
осуществлении которого изменяют химический состав перерабатываемого продукта с целью получения
вещества с другими свойствами.Любой ХТП разделяется на ряд стадий:
Подвод реагирующих компонентов в зону реакции;
Химическое взаимодействие компонентов;
Разделение продуктов реакции и выделение целевого продукта из смеси.
Слайд 3*
1. Классификация химических реакций
Цель химической технологии –
провести процесс как можно
выгоднее,
наиболее полно превратить исходное сырье в продукты реакции,
получить
максимальное количество продукта из взятого сырья, повысить выработку в реакторе в единицу времени.
Химические превращения вещества в ХТП осуществляются в специальном аппарате – химическом реакторе ( реактор с мешалкой и теплообменником, насадочная колонна, колонна синтеза, контактный аппарат, автоклавы).
Слайд 4*
1. Классификация химических реакций
Для анализа хода процесса используются ТЭП:
Степень превращения
– это отношение количества вещества вступившего в реакцию к его
исходному количеству: А → В ; ХА = ( GAн – GкА ) / GнА ;Выход продукта – отношение количества полученного продукта к максимально возможному: А → В ; ВА = Gвых/ Gвых.максим= Gвых / GнА ;
Селективность – это отношение количества целевого продукта к общему количеству полученных продуктов: А → В ; А → Д; СВ = GB/( GB + GД ) = GB / (GнА- GkA) ;
Слайд 5*
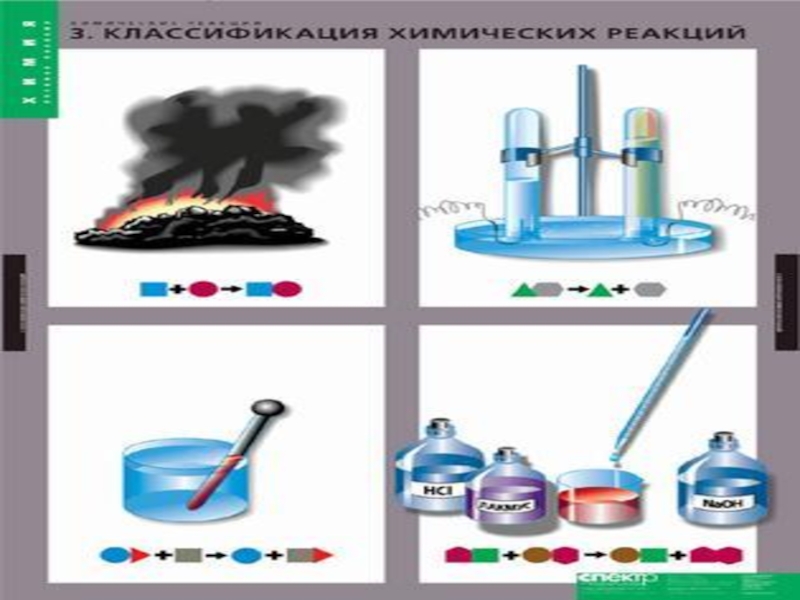
1. Классификация химических реакций
В зависимости от фазового состава реагентов и
продуктов : гетерогенные и гомогенные;
В зависимости от механизма осуществления реакции:
простые и сложные( параллельные, последовательные, многстадийно-параллельные);По молекулярности реакции: моно-, би- и тримолекулярные реакции;
По порядку реакции: первого, второго, третьего, дробного и т.д.;
В зависимости от наличия катализатора: каталитические, некаталитические, автокаталитические;
По тепловому эффекту: экзотермические, эндотермические.
Слайд 10*
1. Классификация химических реакций
Поскольку скорость реакции взаимодействия двух веществ пропорциональна
произведению концентраций этих двух субстратов, такого типа реакции называются реакциями
второго порядка.Если бы для реакции требовалось одновременное участие трёх субстратов, то скорость её должна была бы зависеть от произведения концентраций всех трёх веществ, и мы бы имели реакцию третьего порядка. Этого однако практически не бывает, поскольку в подобных ситуациях сначала обычно реагируют две молекулы. а уж потом в дело вступает третья.
Слайд 12*
2. Реакционная способность
Одной из основных задач химии является установление зависимости
между строением молекул, энергетическими характеристиками химических связей и реакционной способностью
веществ, а также изучение влияния различных факторов на скорость и механизм химического превращения.Скорость и механизм химических превращений изучает особый раздел химии – химическая кинетика.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени и в единице объема.
Слайд 13*
2. Реакционная способность
Реакционная способность, характеристика химической активности веществ, учитывающая как
разнообразие реакций, возможных для данного вещества, так и их скорость.
Например, благородные металлы (Au, Pt) и инертные газы (Не, Ar, Kr, Xe) химически инертны, т. е. у них низкая реакционная способность; щелочные металлы (Li, Na, К, Cs) и галогены (F, Cl, Вг, I) химически активны, т. е. обладают высокой реакционной способностью.Слайд 14*
2. Реакционная способность
Количественно Реакционную способность выражают константами скоростей реакций
или константами равновесия в случае обратимых процессов. Современные представления о
реакционной способности основаны на электронной теории валентности и на рассмотрении распределения (и смещения под действием реагента) электронной плотности в молекуле.Слайд 15*
2. Реакционная способность
Электронные смещения качественно описываются в терминах индуктивных и
мезомерных эффектов, количественно — с применением квантовомеханических расчётов. Главный фактор,
определяющий относительную Р. с. в ряду родственных соединений, — строение молекулы: характер заместителей, их электронное и пространственное влияние на реакционный центр, геометрия молекул. Р. с. зависит и от условий реакции (природы среды, присутствия катализаторов или ингибиторов, давления, температуры, облучения и т.п.). Все эти факторы оказывают на скорость реакций различное, а иногда противоположное влияние в зависимости от механизма данной реакции.Слайд 16*
2. Реакционная способность
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих
веществ в степени равной значению стехиометрических коэффициентов при данном веществе
в уравнении химической реакции. ( Кинетический закон действующих масс ).Слайд 17*
2. Реакционная способность
Закон действующих масс устанавливает связь между массами реагирующих
веществ в химических реакциях . Закон действующих масс сформулирован в
1864—1867 гг.К.Гульдбергом и П.Вааге. Согласно этому закону скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Закон действующих масс используют при различных расчетах химических процессов. Он позволяет решить вопрос, в каком направлении возможно самопроизвольное течение рассматриваемой реакции при заданном соотношении концентраций реагирующих веществ, какой выход нужного продукта может быть получен.Слайд 18*
2. Реакционная способность
где
ai — активности веществ, выраженные через концентрации, парциальные
давления либо мольные доли;
νi — стехиометрический коэффициент (для исходных
веществ принимается отрицательным, для продуктов — положительным); Kc — константа химического равновесия
Слайд 19*
2. Реакционная способность
На практике в расчётах, не требующих особой точности,
значения активности обычно заменяются на соответствующие значения концентраций (для реакций
в растворах) либо парциальных давлений (для реакций между газами).Пример: для стандартной реакции
константа химического равновесия определяется по формуле
Слайд 20*
2. Реакционная способность
Химическое равновесие — состояние химической системы, при котором
возможны реакции, идущие с равными скоростями в противоположных направлениях. При
химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.А + В ⇄ С + D В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Слайд 21*
2. Реакционная способность
Все химические реакции, в принципе, обратимы. Это означает,
что в реакционной смеси протекает как взаимодействие реагентов, так и
взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением, концентрацией веществ). Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты.Слайд 22*
2. Реакционная способность
Положение химического равновесия зависит от следующих параметров реакции:
температуры, давления и концентрации. Влияние, которое оказывают эти факторы на
химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье.Слайд 23*
2. Реакционная способность
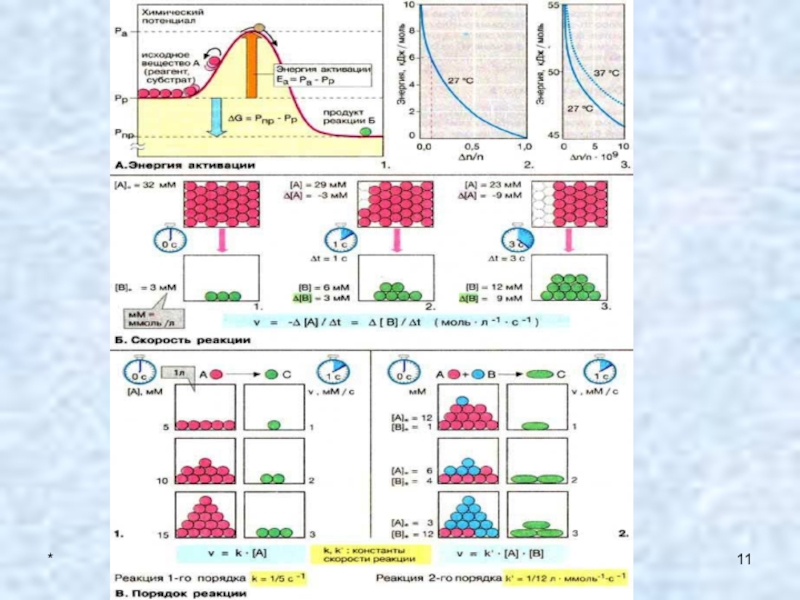
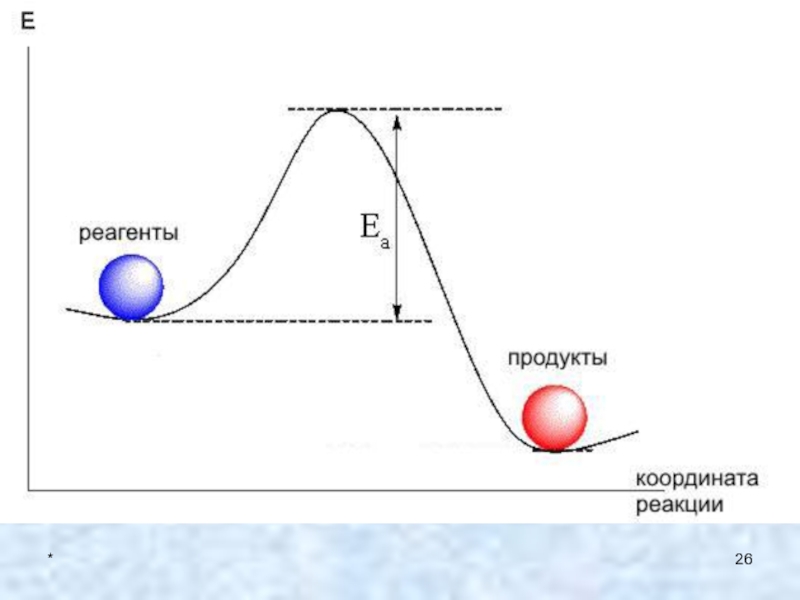
Для того, чтобы совершился элементарный акт химического взаимодействия,
реагирующие частицы должны столкнуться друг с другом. Однако далеко не
каждое столкновение частиц приводит к химическому взаимодействию. Сталкивающиеся частицы должны обладать энергией, достаточной для преодоления сил отталкивания ( энергия активации реакции)Слайд 24*
2. Реакционная способность
Энергия активации в химии и биологии — минимальное
количество энергии, которую требуется сообщить системе (в химии выражается в
джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889 г. Типичное обозначение энергии реакции Ea.Слайд 25*
2. Реакционная способность
В химической модели, известной как Теория активных соударений,
есть три условия, необходимых для того, чтобы произошла реакция:
Молекулы должны
столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция. Молекулы должны обладать необходимой энергией Еа. В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
Молекулы должны быть правильно ориентированы друг относительно друга.
Слайд 27*
2. Реакционная способность
При низкой (для определённой реакции) температуре большинство молекул
обладают энергией меньшей, чем энергия активации, и неспособны преодолеть энергетический
барьер. Однако в веществе всегда найдутся отдельные молекулы, энергия которых значительно выше средней. Даже при низких температурах большинство реакций продолжают идти. Увеличение температуры позволяет увеличить долю молекул, обладающих достаточной энергией, чтобы преодолеть энергетический барьер. Таким образом повышается скорость реакции.Слайд 28*
2. Реакционная способность
r = Gпродукта/(V*t) = (GнА – GкА) /
(V*t) =GB / (V*t)
rпр = Kпр* Сma* Cnb
- Закон действующих массГульдберга и Вааге
Rобр = Kобр* Ckc* Cld
G = V * µ / Vm
Vm0 = 22.4 дм3 ; Vm0/ VmT = T0 / Tр
Слайд 29*
P - давление
T – температура
V – объем
Q - теплотаU – внутренняя энергия
H – энтальпия
S – энтропия
G – энергия Гиббса
Δ - изменение величины
Слайд 33*
Энергия Гиббса характеризует динамику, направленность химического процесса:
- возможно самопроиз-
вольное протекание
процесса.
- реакция невозможна.
- система в равновесии.
Слайд 35*
Обобщенный вид химической реакции
b1* B1 +
b2* B2 + … = a1 * A1 + a2
* A2 + …Материальный баланс
ХТС
реагенты
Продукты реакции
GB
GA
Слайд 36*
3. УСЛОВИЕ ЗАДАЧИ
CH4 C + H2
Расход метана
= 100 м3 в секунду.
Степень превращения = 60%;
Потери сырья, водорода
и тепла = 10%;Потери углерода = 2%;
Температура сырья = 25 С;
Температура реакции = 1450 С;
Удельная теплота фазового перехода теплоносителя = 1000кдж/кг.
Слайд 38*
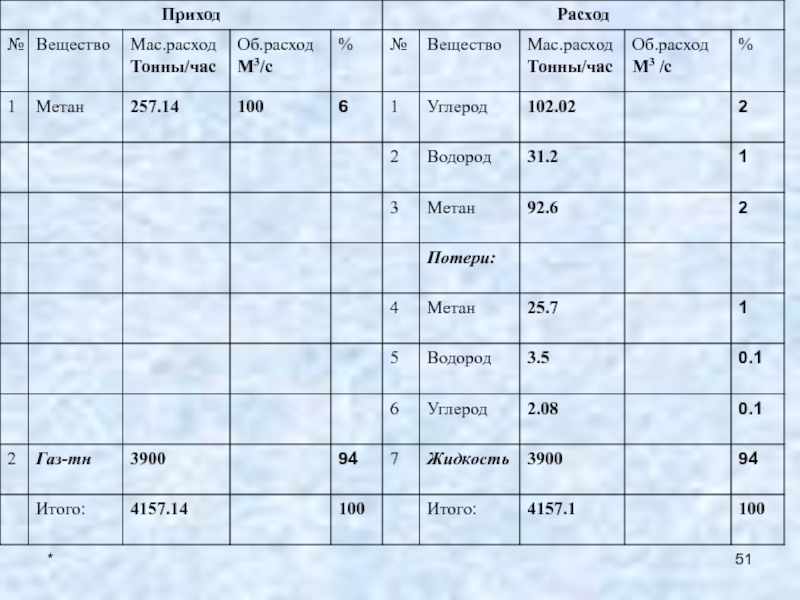
4. Химическая реакция
Определяем молярный объем для продуктов реакции:
Vtm = V0m * Tr / T0 = 22.4 *
1723/ 298 = 129.5 дм3;2. Определяем массовый расход метана:
Gмет=Vмет * Mмет / V0m =100*16/22.4 = 71.43 кг/с или 257.14 тонн/час;
3. Определяем потери метана и расход метана, поданного в зону реакции:
Gпотеримет = 0.1 * 257.14 = 25.7 т/час;
Gреакмет = 257.14 – 25.7 = 231.4 т/час;
Слайд 39*
4. Определяем расход метана, подвергаемого пиролизу:
Gпирмет = 231.4 * 60
/100 = 138.8 тонн/час:5. Определяем расход метана, не вступившего в реакцию:
Gневстмет= 231.4 – 138.8 = 92.6 тонн/час;
6. Определяем расход полученного углерода:
Gуглерод = 138.8 * 12 / 16 = 104.1 тонн/час;
7. Определим потери графита:
Gпотериуглерод = 0.02 * 104.1 = 2.08 тонн/час; .
8. Определим расход оставшегося графита:
Gкуглерод = 104.1 – 2.08 = 102.02 тонн/час;
9. Определяем расход водорода:
Gводород = 138.8 * 4/ 16 = 34.7 тонн/час;
10. Определяем потери водорода:
Gпотериводород = 0.1 * 34.7 = 3.5 тонн/час;
11. Определяем расход оставшегося водорода:
Gкводород = 34.7 – 3.5 = 31.21 тонн/час;
Слайд 41*
5. Материальный баланс
Определим расходный коэффициент по углероду, Ку:
Ку = GM
/ GKY = 257.14 / 102.02 = 2.52 т. CH4
на т.Теоретически из 257.14 т/час метана можно получить углерода согласно следующей пропорции:
из 16 г. метана можно получить 12 г. углерода;
из 257.14 т/час - Х т/час углерода;
Тогда Х = ( 257.14 х 12 ) / 16 = 193.6 т/час углерода.
Выход по углероду β = 102.02 / 193.6 = 0.58 (58%).
Слайд 42*
5. Материальный баланс
Прореагировало метана 138.8 т/час, тогда из него можно
получить углерода согласно следующей пропорции:
из 16 г. метана
можно получить 12 г. углерода;из 138.8 т/час метана - Х т/час углерода.
Тогда Х = ( 138.8 х 12 ) / 16 = 104.1 т/час углерода;
Селективность равна γ = 102.02 / 104.1 = 0.98 (98%)
Слайд 43*
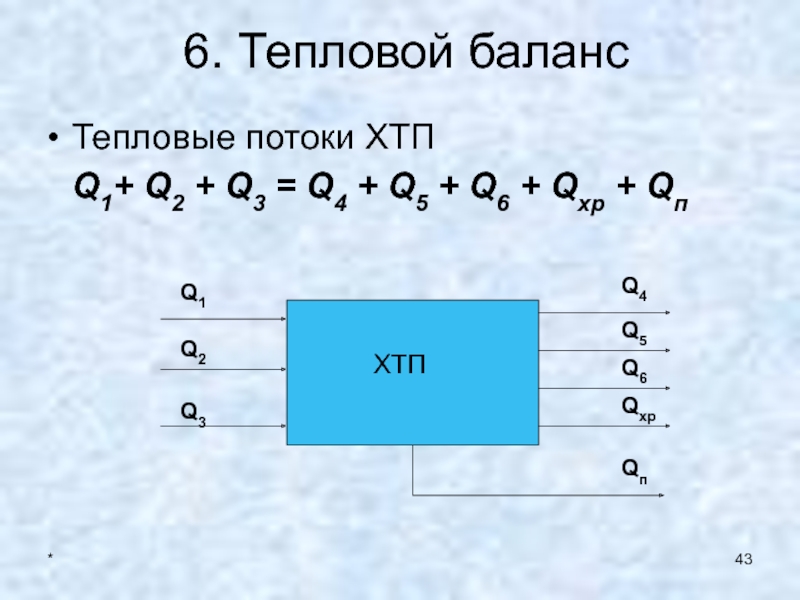
6. Тепловой баланс
Тепловые потоки ХТП
Q1+ Q2 + Q3
= Q4 + Q5 + Q6 + Qхр + Qп
Q1
ХТП
Q2
Q3
Q4
Q5
Q6
Qп
Qхр
Слайд 44*
Тепловые потоки
Q1, Q4– тепловые потоки пропорциональные энтальпии или
теплосодержанию и массовому потоку = G*C*T.
Q2, Q5
- тепловые потоки, связанные с изменением фазового состояния реагентов и продуктов реакции = G * rs.Q3, Q6 – тепловые потоки, связанные с использованием теплоносителя и
равные либо Gтн*Cтн* Tтн , либо Gтн* rsтн.
Qхр – тепловой эффект химической реакции.
Qхр = ΔHT* G/µ
Qп – тепловые потери.
Слайд 45*
Тепловой эффект реакции
Тепловой эффект реакции при нормальных условиях
Изменение теплоемкости в
процессе реакции
Изменение температуры в процессе реакции
Слайд 46*
12. Определяем нормальный молярный тепловой эффект реакции:
1 * 0 + 2 * 0 - 1 *
( - 75) = 75 Кдж / пробег;13. Определяем молярные и удельные теплоемкости сырья и продуктов:
C0CH=18+61*300/1000=
36 дж/(моль*град) = 2 Кдж /(кг*град );
CtCH=18+61*1700/1000=
120 дж/(моль*град) = 7 Кдж/(кг*град );
CtC = 17+ 4*1700/1000 = 24 = 2 ;
CtH = 27+ 3*1700/1000 = 32 = 16 ;
14. Определяем изменение температуры:
1700 – 300 = 1400;
15. Определяем изменение теплоемкости:
1 * 24 + 2 * 32 – 1 * 36 =24 +64–36 =+ 52 дж / (моль*град );
Слайд 47*
16. Определяем молярный тепловой эффект при температуре реакции:
75000 + 1400 *
52 = 150 Кдж / пробег;Реакция эндотермическая.
17. Определяем химический эквивалент реакции:
Qхр = 150 * 28.34 / 12 = 354 Мвт;
Если в условии задачи стоит вопрос о расчете только теплового режима рекции, то на этом и завершается выполнение поставленной задачи
Слайд 48*
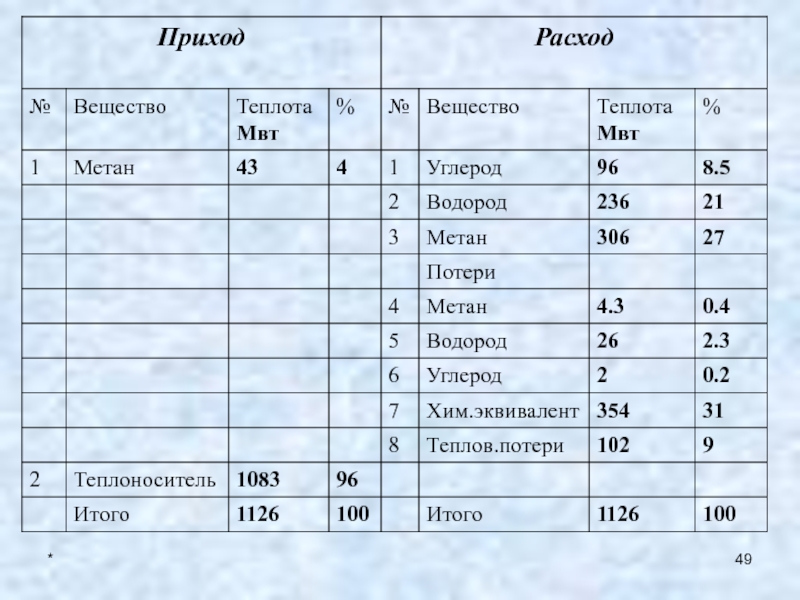
18. Определим энтальпии сырья и продуктов:
257.14 * 2 * 300 / 3.6 =
43 Мвт;92.6 * 7 * 1700 / 3.6 = 306 Мвт;
102.02 * 2 * 1700 / 3.6 = 96 Мвт;
31.2 *16 *1700 / 3.6 = 236 Мвт;
25.7 * 2 * 300 / 3.6 = 4.3Мвт;
2.08 * 2 * 1700/ 3.6 = 2 Мвт;
3.5 * 16* 1700/ 3.6 = 26 Мвт.
Слайд 50*
Определим массовый расход теплоносителя:
Qтн= Gтн*rs
Gтн= Qтн/ rs= 1083
Мвт /1000Кдж/кг1083 кг / с = 3900 тонн в час.
20 . Скорректируем таблицу материального баланса: