Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролитическая диссоциация
Содержание
- 1. Электролитическая диссоциация
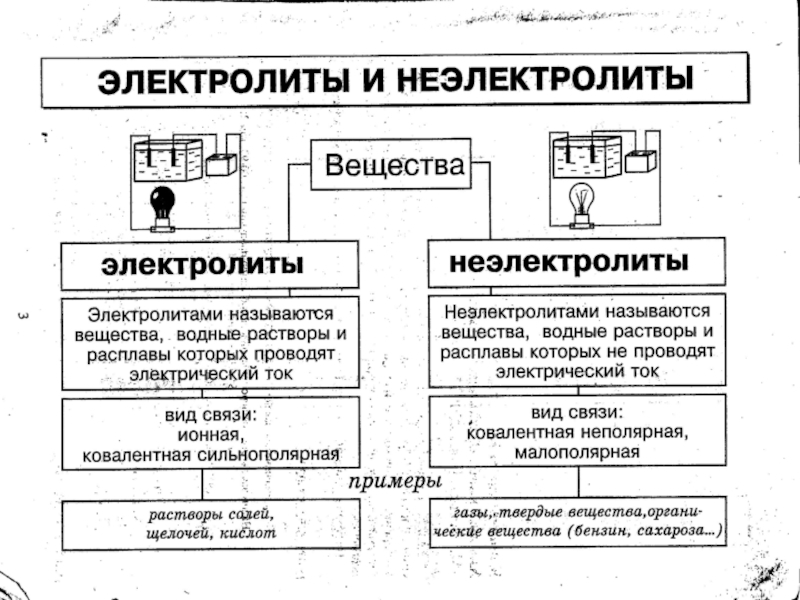
- 2. ЦЕЛИ УРОКА:Изучить понятия об электролитах и
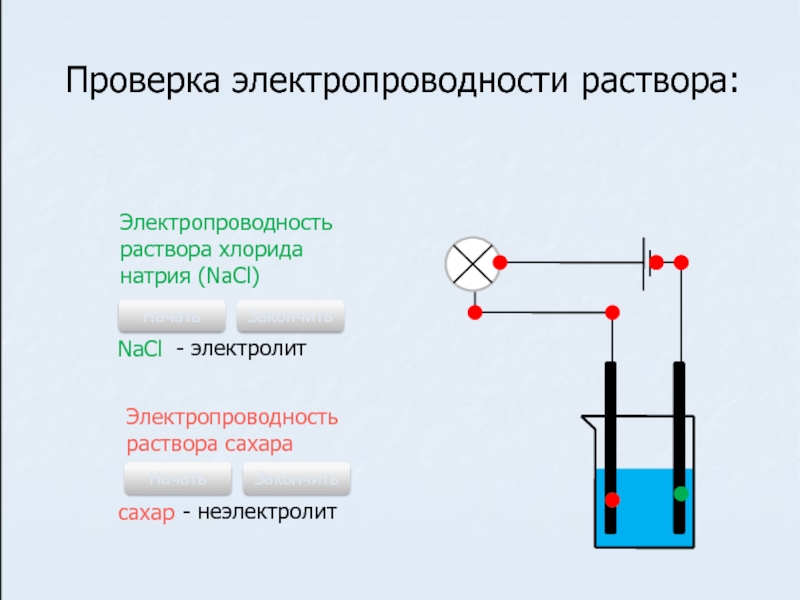
- 3. Проверка электропроводности раствора: Электропроводность раствора хлорида натрия (NaCl)НачатьЗакончитьNaCl- электролитЭлектропроводность раствора сахараНачатьЗакончитьсахар- неэлектролит
- 4. Слайд 4
- 5. С.Аррениус изучая электропроводность растворов
- 6. Сванте Аррениус (1859-1927) Шведский
- 7. C Аррениус считал,
- 8. Схема электролитической
- 9. 1.Ориентация молекул воды
- 10. В растворах электролитов
- 11. Слайд 11
- 12. Слайд 12
- 13. Проверь себя! Что является причиной электропроводности
- 14. Спасибо за внимание Д/з параграф 35, №1
- 15. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
ЦЕЛИ УРОКА:
Изучить понятия об электролитах и неэлектролитах.
Рассмотреть механизм диссоциации
веществ с различным типом связи.
и классификацией электролитов.Слайд 3Проверка электропроводности раствора:
Электропроводность раствора хлорида натрия (NaCl)
Начать
Закончить
NaCl
- электролит
Электропроводность раствора
сахара
Начать
Закончить
сахар
- неэлектролит
Слайд 5
С.Аррениус изучая электропроводность растворов различных веществ, пришел
в 1887 г. к выводу, что причиной электропроводности является наличие
в растворе ионов, которые образуются при растворении электролита в воде.Процесс распада электролита на ионы называют электролитической диссоциацией.
Слайд 6Сванте Аррениус (1859-1927)
Шведский физикохимик, создатель теории
электролитической диссоциации, академик Королевской академии наук Швеции.
Слайд 7
C Аррениус считал, что в растворах
находятся свободные ионы
( не учитывал взаимодействия электролита с водой).
А Каблуков И.А. и Кистяковский В.А. доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы.
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104,5 0 , благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
Слайд 8
Схема электролитической диссоциации
хлорида натрия на гидратированные ионы
1) Ориентация молекул – диполей воды около ионов кристалла.
2) Гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла.
3) Диссоциация (распад) кристалла электролита на гидратированные ионы.
NaCl = Na+ + Cl-
Слайд 9
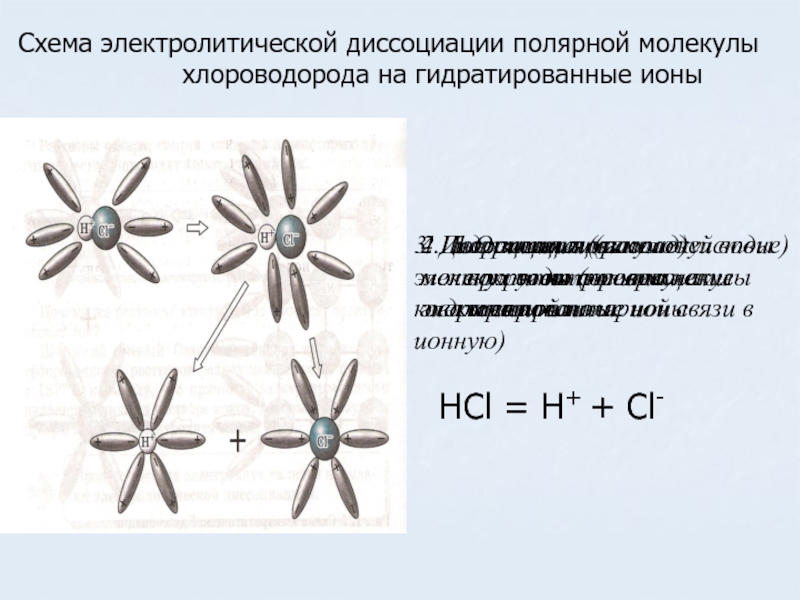
1.Ориентация молекул воды вокруг полюсов
молекулы электролита.
Схема электролитической диссоциации полярной молекулы
хлороводорода на гидратированные ионы2.Гидратация (взаимодействие) молекул воды с молекулами электролита
3. Ионизация молекул электролита (превращение ковалентной полярной связи в ионную)
4.Диссоциация (распад) молекул электролита на гидратированные ионы
HCl = H+ + Cl-
Слайд 10
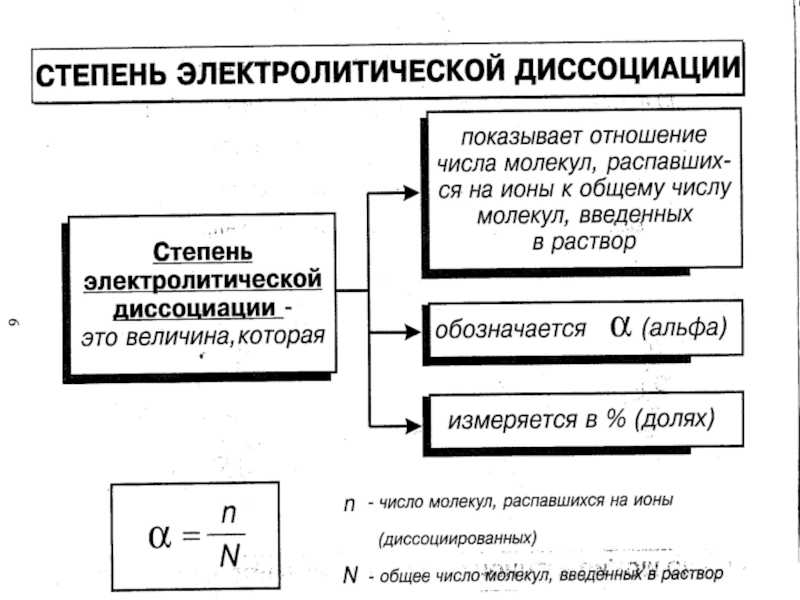
В растворах электролитов наряду с ионами
присутствуют и молекулы.
Поэтому растворы электролитов характеризуются степенью
диссоциации, которую обозначают греческой буквой («альфа»)Слайд 13Проверь себя!
Что является причиной электропроводности
веществ?
наличие
в растворе ионов.
2) Как называется процесс распада на ионы?
электролитическая
диссоциация3) Кто был основоположником учения
об электролитической диссоциации?
Шведский ученый Сванте Аррениус
4) Перечислите последовательности процессов,происходящих при диссоциации HCl.
Ориентация молекул воды вокруг полюсов электролита;
Гидратация молекул воды с молекулами электролита;
Ионизация молекул электролита;
Диссоциация молекул электролита на гидратированные ионы.
5) От чего зависит сила электролитов?
Степени электролитической диссоциации
6) Степень диссоциации электролита =0,7.
Сколько распавшихся молекул приходится на каждые 10 молекул растворенного вещества?
семь