Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алкены (10 класс)
Содержание
- 1. Алкены (10 класс)
- 2. Цели урокаизучить способы получения, химические свойства применение алкенов на примере непредельного углеводорода - этилена
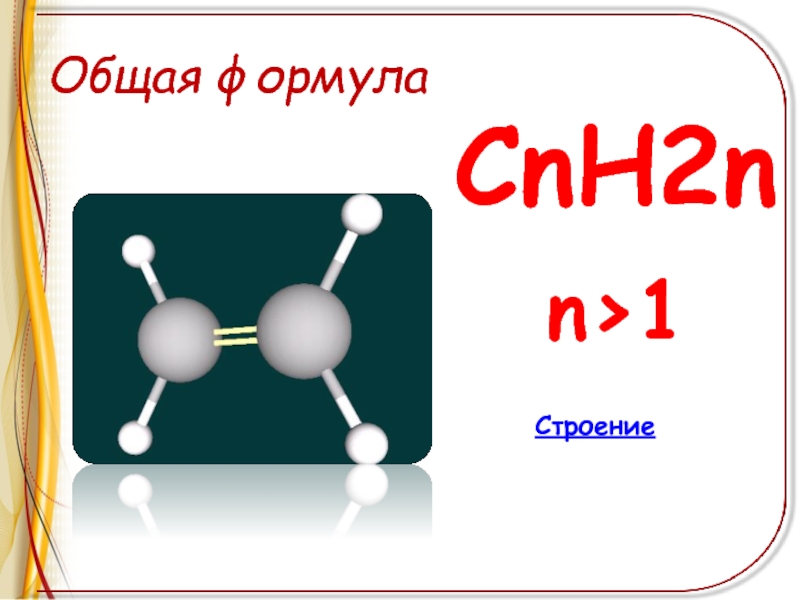
- 3. Общая формула СnH2n n>1Строение
- 4. Изомерия
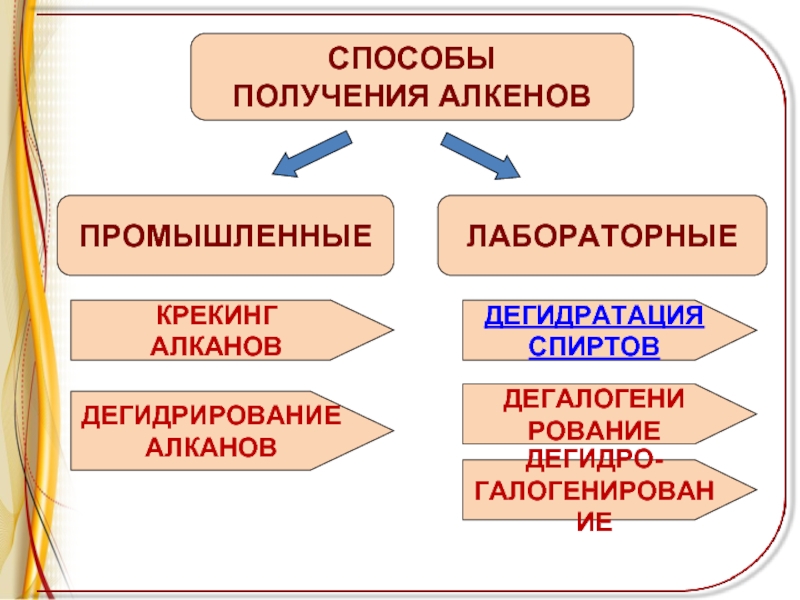
- 5. ПРОМЫШЛЕННЫЕСПОСОБЫПОЛУЧЕНИЯ АЛКЕНОВЛАБОРАТОРНЫЕКРЕКИНГ АЛКАНОВДЕГИДРИРОВАНИЕАЛКАНОВДЕГИДРАТАЦИЯСПИРТОВДЕГАЛОГЕНИРОВАНИЕДЕГИДРО-ГАЛОГЕНИРОВАНИЕ
- 6. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯДЕГИДРАТАЦИЯ СПИРТОВСПИРТ → АЛКЕН +
- 7. Получение алкеновКРЕКИНГ АЛКАНОВАЛКАН → АЛКАН
- 8. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН →
- 9. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯДЕГИДРОГАЛОГЕНИРОВАНИЕ
- 10. РЕАКЦИИ ОКИСЛЕНИЯГОРЕНИЕ АЛКЕНОВ ПРИМЕР:
- 11. РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С
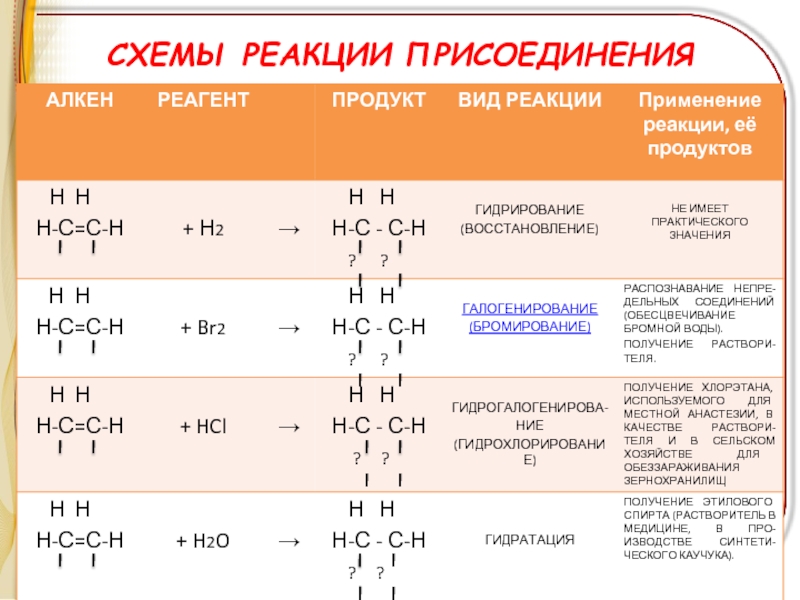
- 12. СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
- 13. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИЭто процесс соединения одинаковых молекул в
- 14. Домашнее задание§ 4, упр. 4, 7, 8
- 15. Скачать презентанцию
Цели урокаизучить способы получения, химические свойства применение алкенов на примере непредельного углеводорода - этилена
Слайды и текст этой презентации
Слайд 2Цели урока
изучить способы получения,
химические свойства
применение алкенов
на
примере непредельного углеводорода - этилена
Слайд 5ПРОМЫШЛЕННЫЕ
СПОСОБЫ
ПОЛУЧЕНИЯ АЛКЕНОВ
ЛАБОРАТОРНЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГАЛОГЕНИ
РОВАНИЕ
ДЕГИДРО-
ГАЛОГЕНИРОВАНИЕ
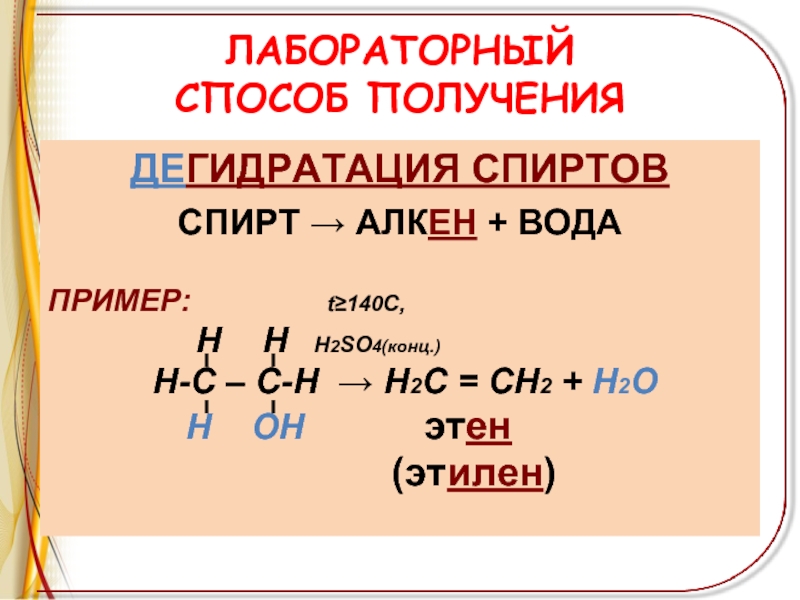
Слайд 6ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРАТАЦИЯ СПИРТОВ
СПИРТ → АЛКЕН + ВОДА
ПРИМЕР:
t≥140C,
Н Н Н2SO4(конц.)Н-С – С-Н → Н2С = СН2 + Н2О
Н ОН этен
(этилен)
Слайд 7Получение алкенов
КРЕКИНГ АЛКАНОВ
АЛКАН → АЛКАН + АЛКЕН
С БОЛЕЕ ДЛИННОЙ
С МЕНЕЕ ДЛИННОЙУГЛЕРОДНОЙ УГЛЕРОДНОЙ
ЦЕПЬЮ ЦЕПЬЮ
ПРИМЕР:
t=400-700C
С 10 Н 22→ С5Н 12+ С5Н10
декан пентан пентен
Слайд 8ПРОМЫШЛЕННЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ АЛКАНОВ
АЛКАН → АЛКЕН + ВОДОРОД
ПРИМЕР:
Н3С - СН3 → Н2С = СН2 + Н2
этан этен
(этилен)
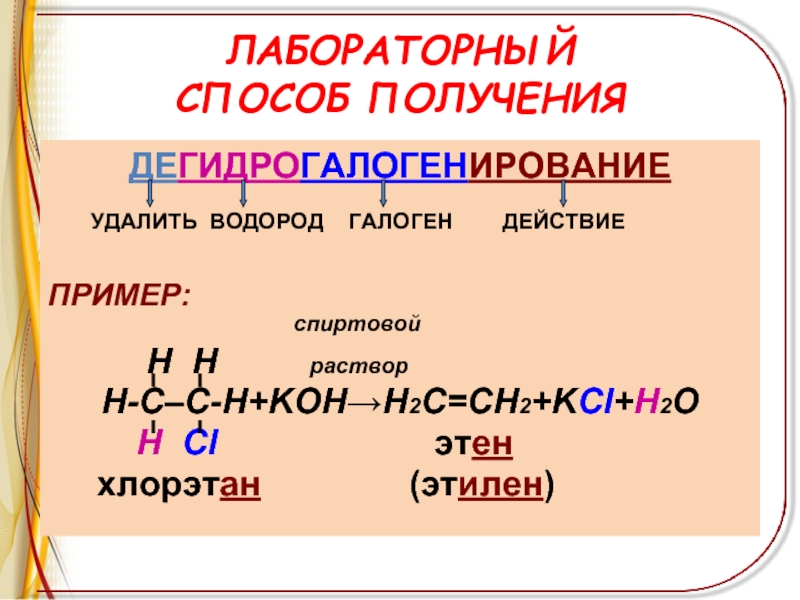
Слайд 9ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
УДАЛИТЬ ВОДОРОД
ГАЛОГЕН ДЕЙСТВИЕ
ПРИМЕР:
спиртовойH H раствор
Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O
Н Cl этен
хлорэтан (этилен)
Слайд 11РЕАКЦИИ ОКИСЛЕНИЯ
МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ
(реакция Е.Е.Вагнера)
Н2С=СН2 + [O] + H2O H2C -
CH2OH OH
этиленгликоль
(этандиол-1,2)
! Качественная реакция на непредельность углеводорода – на кратную связь
Слайд 13РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
Это процесс соединения одинаковых молекул в более крупные.
ПРИМЕР: n
CH2=CH2 (-CH2-CH2-)n
этилен полиэтилен (мономер) (полимер)
n – степень полимеризации, показывает число молекул, вступивших в реакцию
-CH2-CH2- структурное звено
Теги






![Алкены (10 класс) РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ (реакция РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ (реакция Е.Е.Вагнера)Н2С=СН2 + [O] + H2O](/img/thumbs/55cb390d12ff26df4bb3eb1b5b9f0f98-800x.jpg)