Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация урока химии по теме "Окислительно-восстановительные реакции"
Содержание
- 1. Презентация урока химии по теме "Окислительно-восстановительные реакции"
- 2. 1) Какие реакции называются окислительно- восстановительными?
- 3. Окислительно – восстановительные реакции- это реакции, протекающие
- 4. Что такое процесс окисления?
- 5. Окисление – это процесс отдачи электронов, степень окисления при этом повышается. Что такое процесс окисления?
- 6. 3) Какой процесс называется восстановлением?
- 7. 3) Какой процесс называется восстановлением? Восстановление –
- 8. Как называются частицы, отдающие электроны?
- 9. Как называются частицы, отдающие электроны? Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
- 10. Как называются частицы, принимающие электроны?
- 11. Как называются частицы, принимающие электроны?Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.
- 12. Что такое «степень окисления»?
- 13. Что такое «степень окисления»?Степень окисления - это условный заряд
- 14. Слайд 14
- 15. Самостоятельная работа
- 16. Цель урока: Обобщить, систематизировать и расширить знания об
- 17. Окислительно-восстановительные реакции чрезвычайно распространены. С ними связаны,
- 18. Проблема: Перед посадкой семена протравливают раствором перманганата
- 19. Реакции окисления – восстановления могут протекать в
- 20. Обычно для создания кислотной среды добавляют серную
- 21. В четыре пронумерованные пробирки налито по 1-2
- 22. Лабораторный опыт Раствор KMnO4
- 23. Результат лабораторного опыта: Раствор KMnO4(малиновый) (в кислой
- 24. Продукт восстановления MnO4- в различных средах
- 25. KMnO4 + K2SO3 +
- 26. • 2KMnO4 + 5Na2SO3 + 3H2SO4 =
- 27. Слайд 27
- 28. В приведённых ниже схемах даны продукты реакций.
- 29. 10KI + 2КMnO4 + 8H2SO4 = 2MnSO4+
- 30. NaI + КMnO4 + . . . —> I2 + K2MnO4 + NaOH
- 31. 2NaI + 2КMnO4 + 2KOH = I2
- 32. . . . + КMnO4 + H2O —> NaNO3 + MnO2 + KOH
- 33. 3 NaNO2 + 2 КMnO4 + H2O
- 34. Домашнее заданиеНа «3» расставьте коэффициенты методом электронного
- 35. Рефлексия
- 36. HNO2 = HNO3 + NO + H2ONH3
- 37. 3HNO2 = HNO3 + 2NO + H2OВ
- 38. Скачать презентанцию
1) Какие реакции называются окислительно- восстановительными?
Слайды и текст этой презентации
Слайд 3Окислительно – восстановительные реакции- это реакции, протекающие с изменением степеней окисления
атомов химических элементов или ионов, входящих в состав реагирующих веществ
Слайд 5Окисление – это процесс отдачи электронов, степень окисления при этом
повышается.
Что такое процесс окисления?
Слайд 73) Какой процесс называется восстановлением?
Восстановление – это процесс присоединения электронов,
степень окисления при этом понижается.
Слайд 9Как называются частицы, отдающие электроны?
Атомы, молекулы или ионы, отдающие электроны,
окисляются; являются восстановителями.
Слайд 11Как называются частицы, принимающие электроны?
Атомы, ионы или молекулы, принимающие электроны,
восстанавливаются; являются окислителями.
Слайд 13Что такое «степень окисления»?
Степень окисления - это условный заряд атома в молекуле,
вычисленный в предположении, что молекула состоит из ионов и в
целом электронейтральна (условный заряд атома, который мы приписываем ему в случае принятия или отдачи электронов).Слайд 16Цель урока:
Обобщить, систематизировать и расширить знания об окислительно-восстановительных реакциях, углубить
знания о составлении окислительно-восстановительных реакций методом электронного баланса.
Слайд 17
Окислительно-восстановительные реакции чрезвычайно распространены. С ними связаны, например, процессы дыхания
и обмена веществ, протекающие в живом организме, гниение и брожение,
фотосинтез. Окислительно-восстановительные процессы сопровождают круговороты веществ в природе.Слайд 18
Проблема: Перед посадкой семена протравливают раствором перманганата калия. Хозяйка протравливала
семена в белой ткани и задумалась сможет ли она потом
вернуть цвет белой ткани?Сможем ли мы ей помочь?
Слайд 19
Реакции окисления – восстановления могут протекать в различных средах. В
зависимости от среды может изменяться характер протекания реакции между одними
и теми же веществами: среда влияет на изменение степеней окисления атомов.Слайд 20
Обычно для создания кислотной среды добавляют серную кислоту. Соляную и
азотную применяют реже, т.к. первая способна окисляться, а вторая сама
является сильным окислителем и может вызвать побочные процессы. Для создания щелочной среды применяют гидроксид калия или натрия, нейтральной – воду.Слайд 21
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора
перманганата калия. В первую пробирку добавьте несколько капель раствора серной
кислоты, во вторую – воду, в третью – гидроксид калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия. Отметьте, как изменяется окраска раствора в каждой пробирке.Слайд 22
Лабораторный опыт
Раствор
KMnO4
(малиновый)
Среда
кислая
(H2SO4)
Среда
нейтральная
Среда
щелочная
контроль
Na2SO3
Na2SO3
Na2SO3
(Н2О)
(КOH)
Слайд 23Результат лабораторного опыта:
Раствор
KMnO4
(малиновый)
(в кислой среде)
(в щелочной
среде)
контроль
бесцветный
бурый
(в нейтральной среде)
зелёный
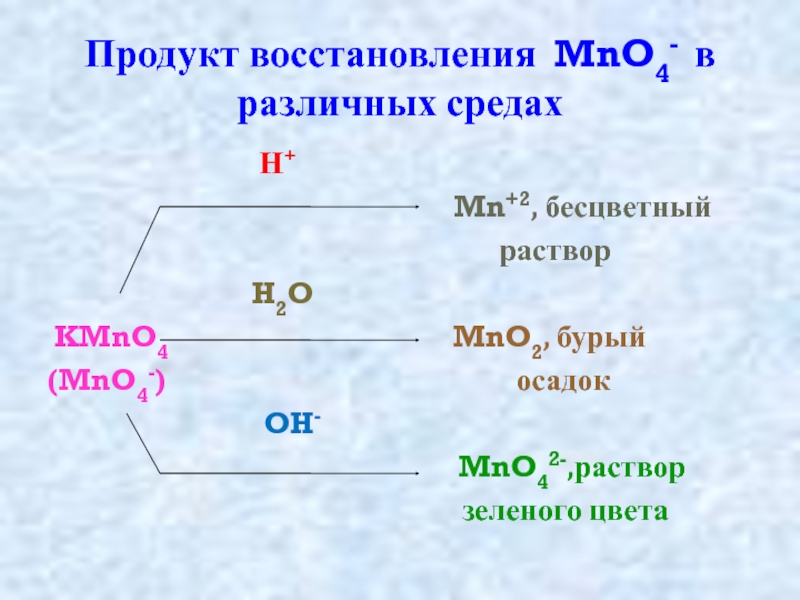
Слайд 24Продукт восстановления MnO4- в различных средах
Н+
Mn+2, бесцветный раствор
H2O
KMnO4 MnO2, бурый
(MnO4-) осадок
OH-
MnO42-,раствор
зеленого цвета
Слайд 25
KMnO4 + K2SO3 + H2SO4 →
KMnO4 + K2SO 3 + H2O
KMnO4 + K2SO3 + КOH →
укажите окислитель и восстановитель
Составьте уравнения ОВР методом электронного баланса:
→
Слайд 26
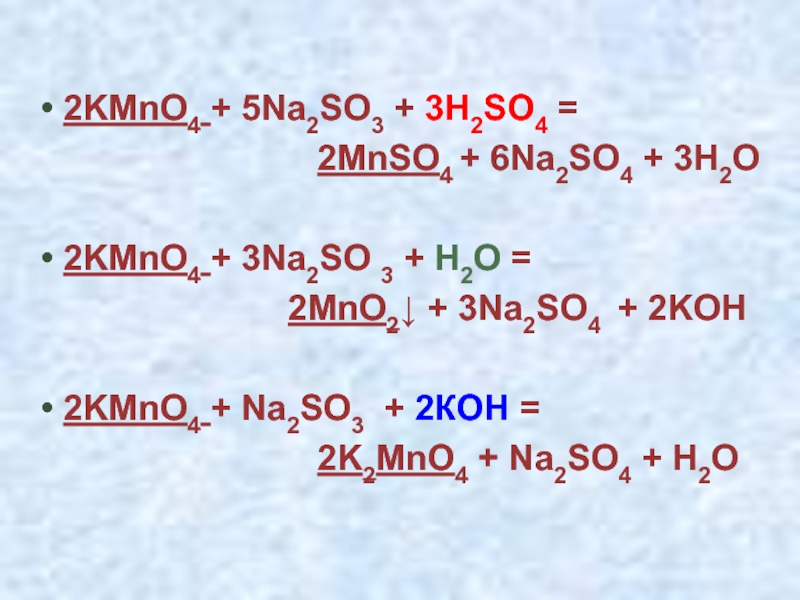
• 2KMnO4 + 5Na2SO3 + 3H2SO4 =
2MnSO4 + 6Na2SO4 + 3H2O
• 2KMnO4 + 3Na2SO 3 + H2O =
2MnO2↓ + 3Na2SO4 + 2KOH
• 2KMnO4 + Na2SO3 + 2КOH =
2K2MnO4 + Na2SO4 + H2O
Слайд 27
Пятна от раствора
перманганата калия быстро выводятся раствором пероксида водорода, подкисленным уксусной кислотой:
2KMnO4 + 9H2O2 + 6CH3COOH =
2Mn(CH3COO)2 +2CH3COOK + 7O2 + 12H2O
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
MnO2 + 3H2O2 + 2CH3COOH =
Mn(CH3COO)2 + 2O2 + 4H2O
Слайд 28В приведённых ниже схемах даны продукты реакций. Укажите реагенты, составьте
уравнения реакций, используя метод электронного баланса:
KI + КMnO4 +
= = MnSO4+ I2 + K2SO4 +H2O
Слайд 29
10KI + 2КMnO4 + 8H2SO4 = 2MnSO4+ 5I2 + 6K2SO4
+8H2O
2I-1 -2e —> I20 5 - окисление, восстановитель
Mn+7 + 5e
—> Mn+2 2- восстановление, окислительСлайд 31
2NaI + 2КMnO4 + 2KOH = I2 + 2K2MnO4 +
2NaOH
2I-1 -2e —> I20 1- окисление, восстановитель
Mn+7 + 1e —>
Mn+6 2- восстановление, окислительСлайд 33
3 NaNO2 + 2 КMnO4 + H2O = 3NaNO3 +
2MnO2 + 2KOH,
N+3 – 2e —> N+5 3 -
окисление, восстановительMn+7 + 3e —> Mn+4 2 - восстановление, окислитель
Слайд 34Домашнее задание
На «3» расставьте коэффициенты методом электронного баланса в 3-х
реакциях
На «4» расставьте коэффициенты методом электронного баланса в 4 -х
реакцияхНа «5» расставьте коэффициенты методом электронного баланса в 4 -х реакциях
Слайд 35Рефлексия
составьте синквейн по теме «ОВР»
1 словоСуществительное
2 слова
Прилагательное Прилагательное
3 слова
Глагол Глагол Глагол
4 слова
Слова, выражающие основную мысль
1 слово
Метафора или синоним
Слайд 37
3HNO2 = HNO3 + 2NO + H2O
В этой реакции окислителем
и восстановителем выступает одно и то же вещество - HNO2.
NH3
+ 8KMnO4 + 9KOH = KNO3 + 8K2MnO4 + 6H2OЗдесь окислитель - KMnO4, восстановитель - NH3.
Обратная связь
Если не удалось найти и скачать доклад-презентацию, Вы можете заказать его на нашем сайте. Мы постараемся найти нужный Вам материал и отправим по электронной почте. Не стесняйтесь обращаться к нам, если у вас возникли вопросы или пожелания:
Email: Нажмите что бы посмотреть



























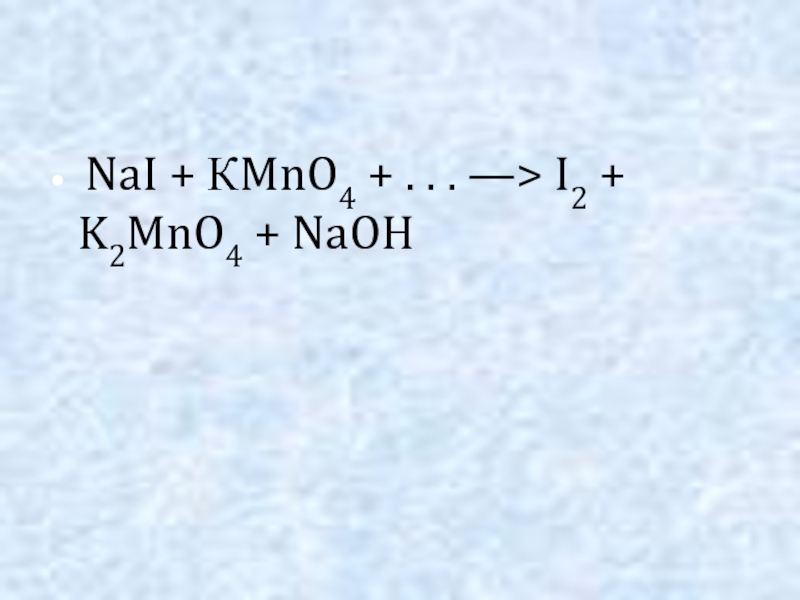 I2 + K2MnO4 + NaOH" alt=" NaI + КMnO4 + . . . —> I2 + K2MnO4 + NaOH">
I2 + K2MnO4 + NaOH" alt=" NaI + КMnO4 + . . . —> I2 + K2MnO4 + NaOH">
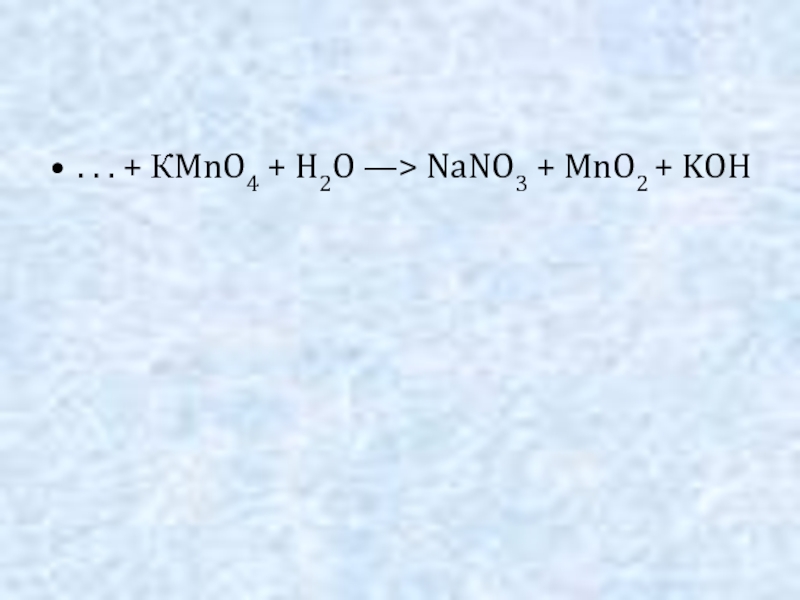 NaNO3 + MnO2 + KOH" alt=". . . + КMnO4 + H2O —> NaNO3 + MnO2 + KOH">
NaNO3 + MnO2 + KOH" alt=". . . + КMnO4 + H2O —> NaNO3 + MnO2 + KOH">























