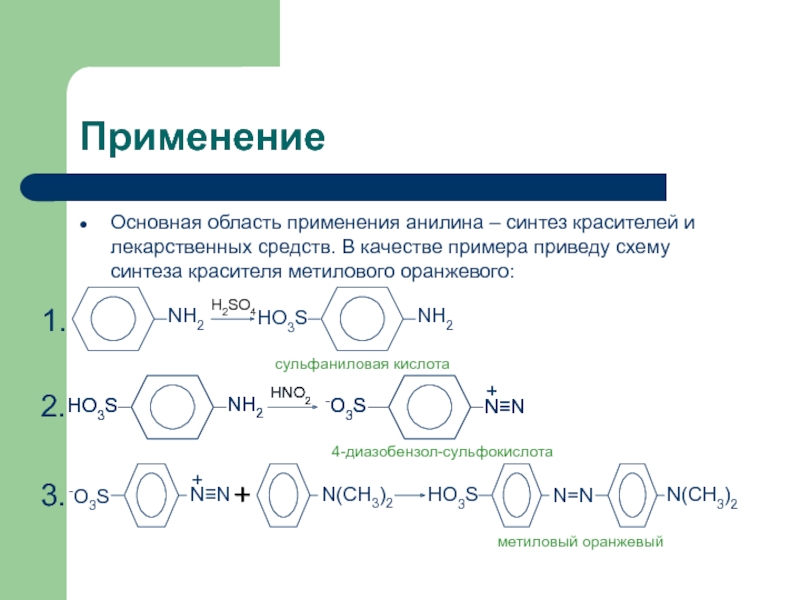
щелочью синяя окраска индиго исчезает и образуется вязкая масса коричневого
цвета. Очистив это в-во, Фрицше получил быстро желтеющую на воздухе маслянистую жидкость и назвал её анилином.Примерно в то же время О.Унфердорбен нагреванием кристаллического индиго получил продукт, который он назвал кристаллином.
Фридлиб Фердинанд Рунге в продуктах перегонки каменноугольной смолы открыл в-во, названное им кианолом.
Н.Н.Зинин в 1841 году открыл способ восстановления нитробензола до соответствующего ароматического амина – бензидама.
1843 г. – Гофман установил, что бензидам, кианол, кристаллин и анилин – одно и то же соединение. Остановились на анилине.


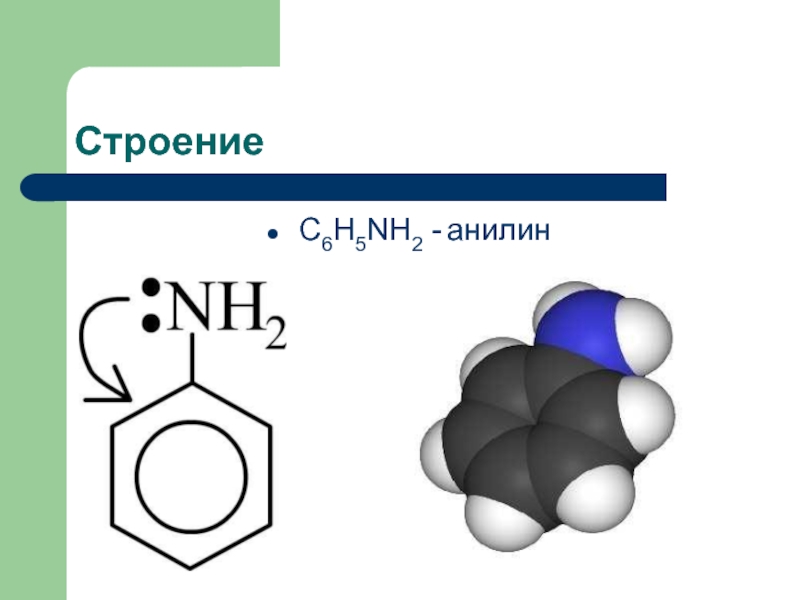
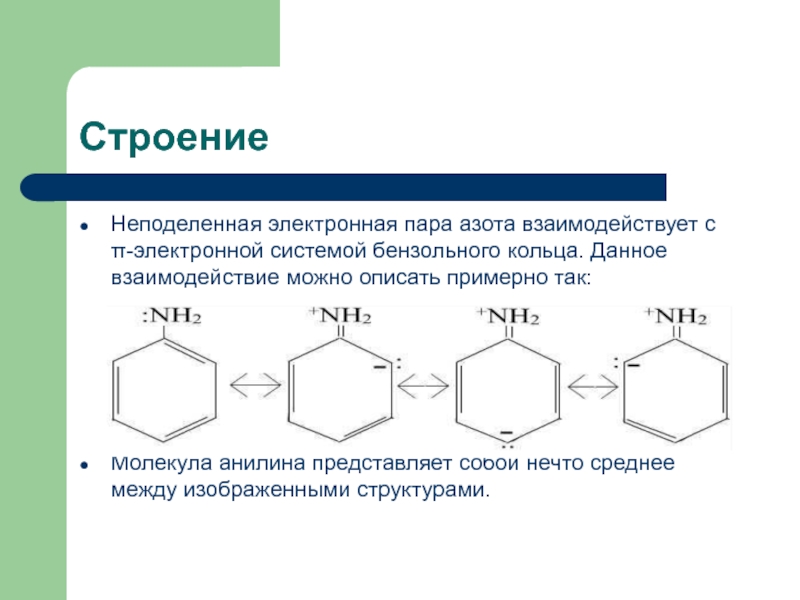


![Анилин ПолучениеВ промышленности C6H5NO2 + 3H2 250-300C,Ni,Cu C6H5NH2 + 2H2O C6H5NO2 + 6[H] ПолучениеВ промышленности C6H5NO2 + 3H2 250-300C,Ni,Cu C6H5NH2 + 2H2O C6H5NO2 + 6[H] Fe,HCl,H2O C6H5NH2 + 2H2O (Зинин, 1842)В](/img/thumbs/70787d1fd9a790d0d902fa957b8cf18d-800x.jpg)
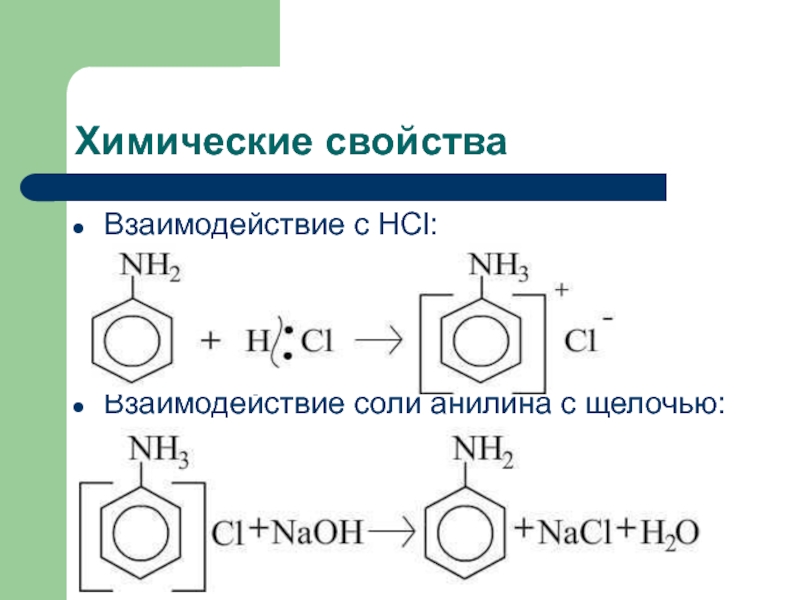
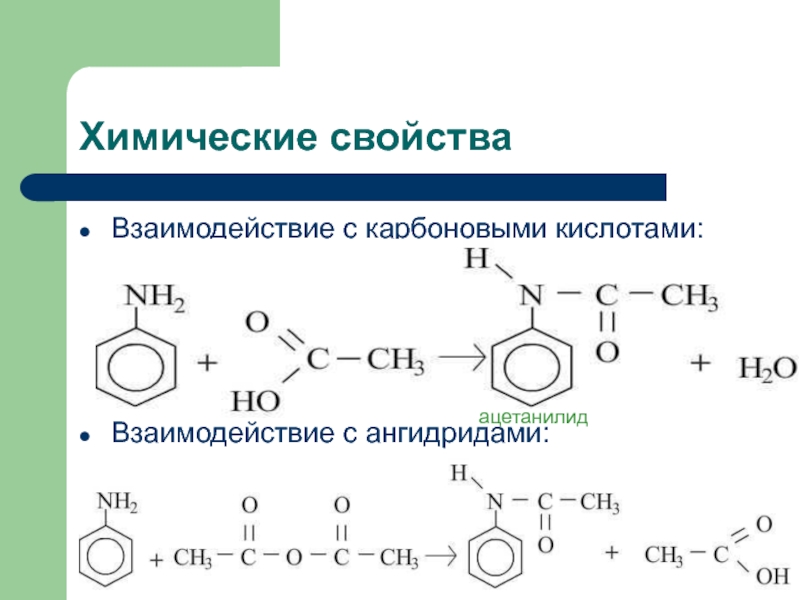
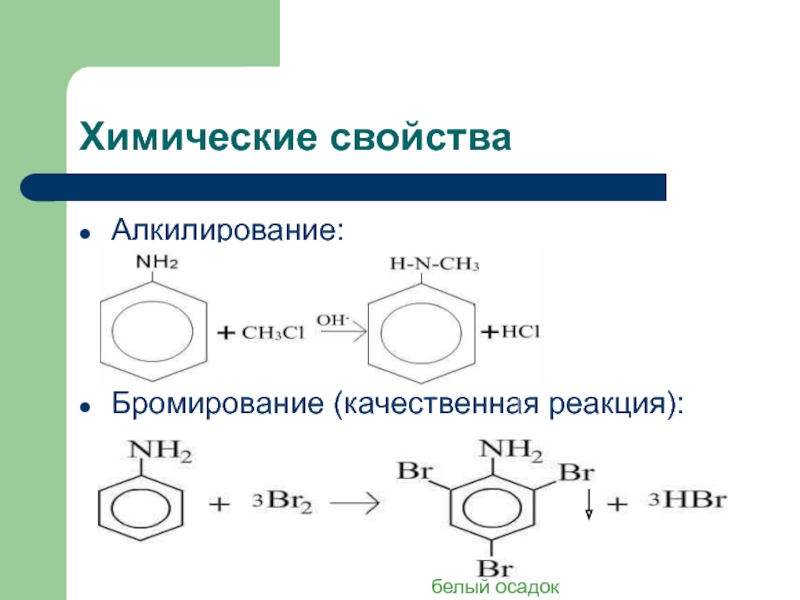
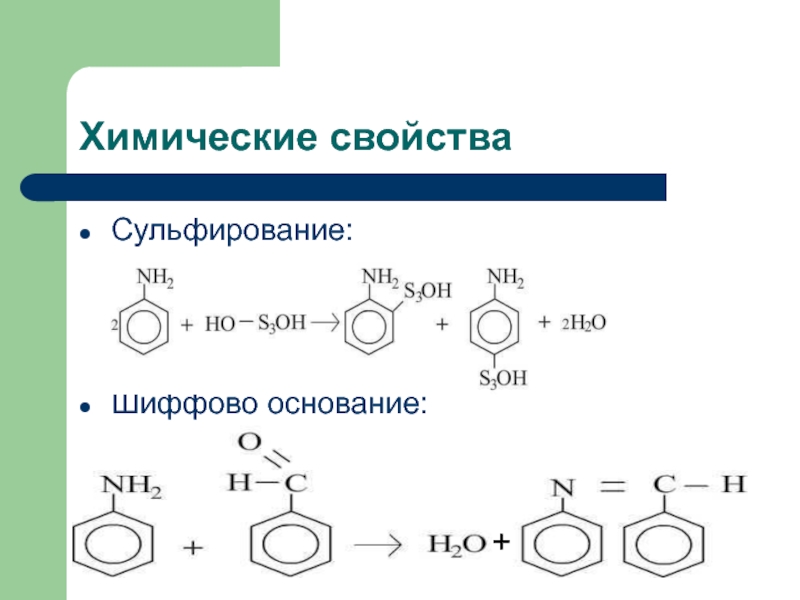
![Анилин Химические свойстваНитрование:C6H5NH2+NaNO2+2HCl [C6H5-N≡N]+Cl- +NaCl + 2H2Oхлорид диазонияДиазосоединения можно выделить в виде Химические свойстваНитрование:C6H5NH2+NaNO2+2HCl [C6H5-N≡N]+Cl- +NaCl + 2H2Oхлорид диазонияДиазосоединения можно выделить в виде кристаллических, легко взрывающихся веществ. Благодаря](/img/tmb/2/134481/c458b41f262877c2458d4a3e89ee8989-800x.jpg)