Слайд 1АРЕНЫ. БЕНЗОЛ И ЕГО ГОМОЛОГИ
ХИМИЯ, 10 КЛАСС
Слайд 2 Ароматические соединения (от греч. árômа — благовоние),
класс органических циклических соединений, все атомы которых участвуют в образовании
единой сопряжённой системы; p-электроны такой системы образуют устойчивую, т. е. замкнутую, электронную оболочку.
Название «Ароматические соединения» закрепилось вследствие того, что первые открытые и изученные представители этого класса веществ обладали приятным запахом.
Общая формула ароматических углеводородов
CnH2n-6. (n не менее 6)
СЛОВАРЬ
Слайд 3Гомологи бензола – соединения, образованные заменой одного или нескольких атомов
водорода в молекуле бензола на углеводородные радикалы (R):
С6Н5R (алкилбензол), RС6Н4R
(диалкилбензол) и т.д.
Номенклатура. Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол
С6Н5СH3 С6Н5С2H5 С6Н5С3H7
метилбензол этилбензол пропилбензол
Номенклатура
Слайд 4История открытия
Впервые бензол описал немецкий химик Иоганн Глаубер, который получил
это соединение в 1649 году в результате перегонки каменно-угольной смолы.
Но ни названия вещество не получило, ни состав его не был известен.
Иоганн
Глаубер
Слайд 5 Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был
открыт в 1825 году английским физиком Майклом Фарадеем, который выделил
его из жидкого конденсата светильного газа.
Майкл Фарадей
История открытия
Слайд 6В 1833 году немецкий физик и химик Эйльгард Мичерлих получил
бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от
этого и произошло название бензол)
Эйльгард Мичерлих
История открытия
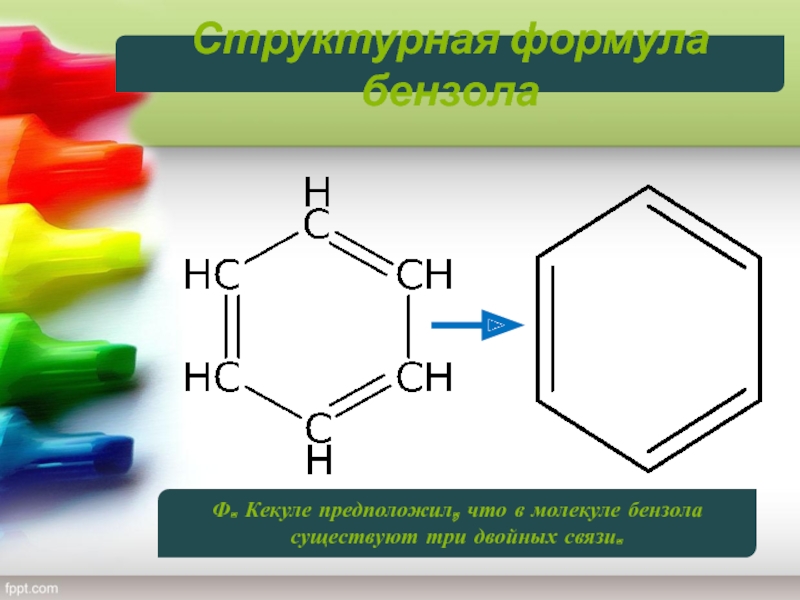
Слайд 7Структурная формула бензола
Была предложена немецким ученым А. Кекуле в
1865 году
Бензол не взаимодействует с бромной водой и
раствором перманганата калия!
А.Кекуле
Н0
Кекуле предположил, что в молекуле бензола существуют три двойных связи.
Структурная
формула бензола
Слайд 9Формула Кекуле и ее противоречивость
против!
за!
Слайд 10Строение бензола
В свое время было
предложено много
вариантов структурных
формул бензола, но
ни
одна из них не смогла
удовлетворительно
объяснить его особые
свойства.
Цикличность строения
бензола подтверждается
тем фактом, что его
однозамещенные
производные не имеют
изомеров.
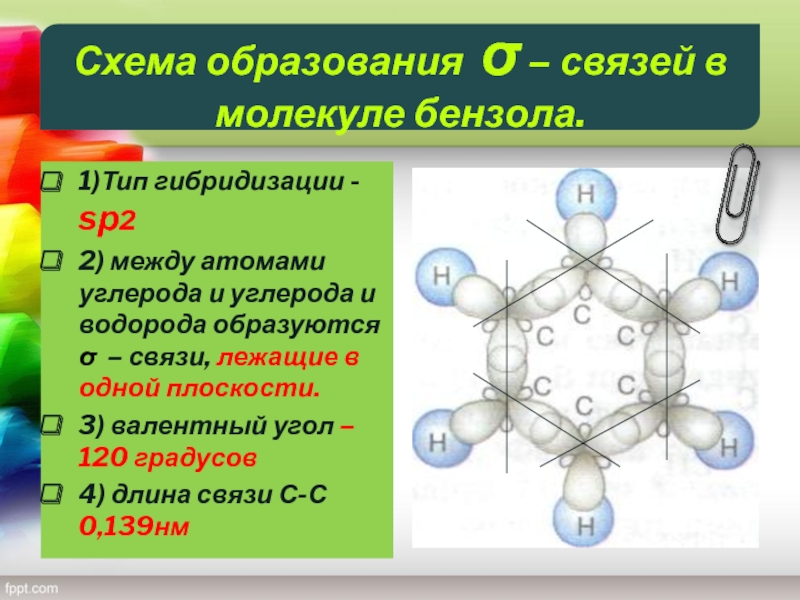
Слайд 11Схема образования σ – связей в молекуле бензола.
1)Тип гибридизации -
sр2
2) между атомами углерода и углерода и водорода образуются
σ – связи, лежащие в одной плоскости.
3) валентный угол – 120 градусов
4) длина связи С-С 0,139нм
Слайд 12Схема образования π – связей в молекуле бензола
За счет
негибридных
р – электронных облаков в молекуле бензола перпендикулярно плоскости
образования сигма - связей образуется единая
п- электронная система, состоящая из 6 р – электронов и общая для всех атомов углерода.
Слайд 13Электронное строение бензола
Современное представление об электронной природе связей в бензоле
основывается на гипотезе американского физика и химика, дважды лауреата Нобелевской
премии
Л. Полинга.
Именно по его предложению молекулу бензола стали изображать в виде шестиугольника с вписанной окружностью, подчеркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
Слайд 14Современная структурная формула бензола.
Сочетание шести сигма – связей с единой п
– системой называется ароматической связью
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом или бензольным ядром.
Слайд 15Реакции замещения.
1) Галогенирование
При взаимодействии бензола с галогеном (в
данном случае с хлором) атом водорода ядра замещается галогеном.
Слайд 16 В случае гомологов бензола более легко происходит
реакция радикального замещения атомов водорода в боковой цепи
Реакции замещения.
Реакции
замещения.
Слайд 172) Нитрование. При действии на бензол нитрующей смеси атом водорода
замещается нитрогруппой (нитрующая смесь – это смесь концентрированных азотной и
серной кислот в соотношении 1:2 соответственно).
Реакции замещения.
Реакции замещения.
Слайд 183) Сульфирование осуществляется концентрированной серной кислотой или олеумом. В процессе реакции
водородный атом замещается сульфогруппой.
C6H6 + H2SO4 (SO3) C6H5
– SO3H + H2O
(бензолсульфокислота)
Реакции замещения.
Реакции замещения.
Слайд 19
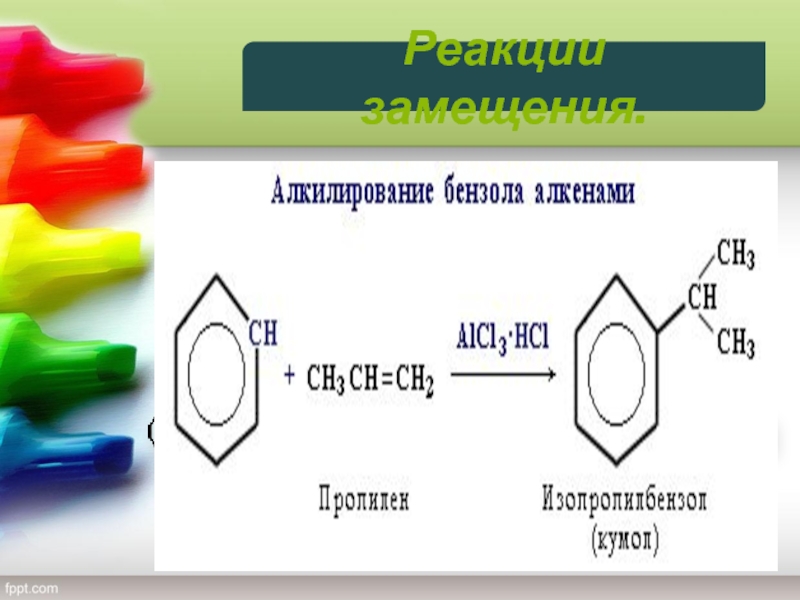
4) Алкилирование
Замещение атома водорода в бензольном кольце
на алкильную группу (алкилирование) происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса)
или алкенов в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса).
Реакции замещения.
Реакции замещения.
Слайд 20
Гомологи бензола (алкилбензолы) С6Н5–R более активно вступают в реакции замещения
по сравнению с бензолом.
Например, при нитровании толуола С6Н5CH3 (70 С)
происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
CH3С6Н5 + 3HNO3 CH3С6Н2(NO2)3 + 3H2O
2,4,6-тринитротолуол
тротил, тол)
При бромировании толуола также замещаются три атома водорода:
AlBr3
CH3С6Н5 + 3Br2 CH3С6Н2Br3 + 3HBr
2,4,6-трибромтолуол
Реакции замещения
с гомологами бензола
Слайд 21Несмотря на склонность бензола к реакциям замещения, он в жестких
условиях вступает и в реакции присоединения.
Реакции присоединения.
Слайд 22
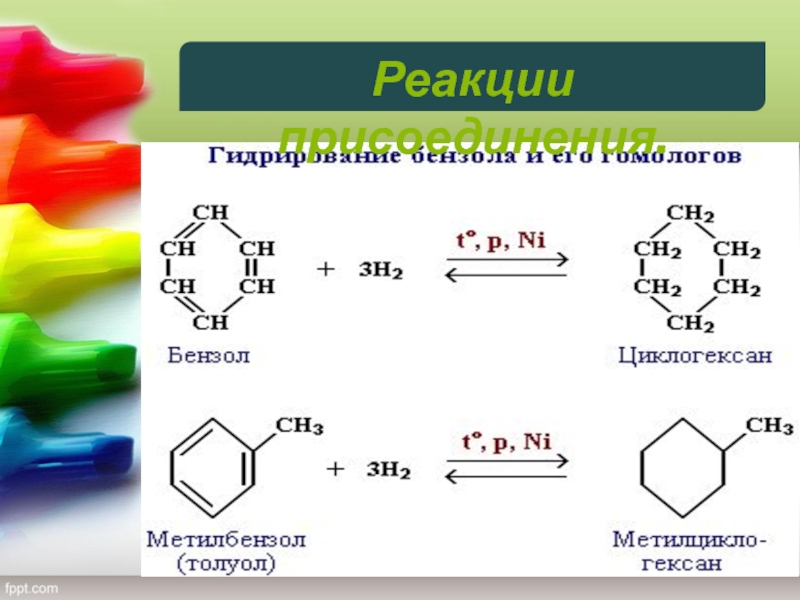
5) Гидрирование.
Присоединение водорода осуществляется только в присутствии
катализаторов и при повышенной температуре. Бензол гидрируется с образованием циклогексана,
а производные бензола дают производные циклогексана.
Реакции присоединения.
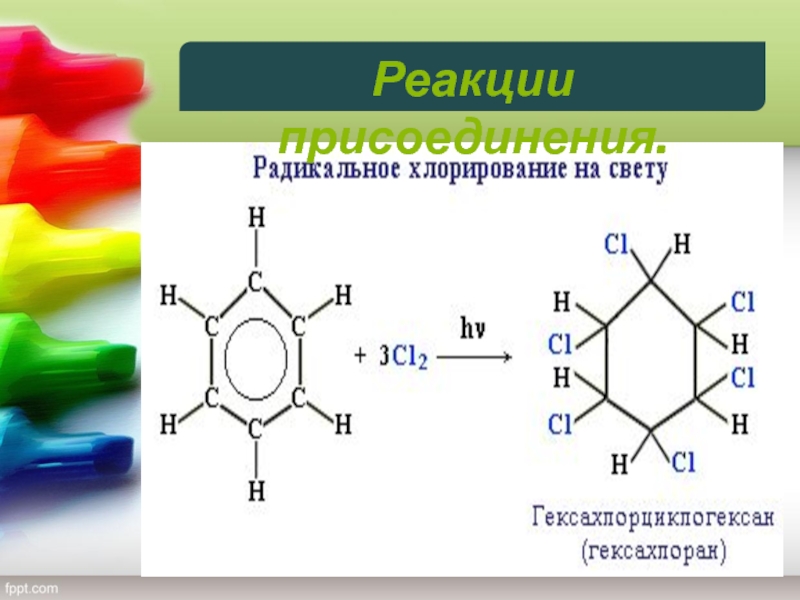
Слайд 246) Галогенирование. Радикальное хлорирование
В условиях радикальных реакций (ультрафиолетовый свет,
повышенная температура) возможно присоединение галогенов к ароматическим соединениям. При радикальном
хлорировании бензола получен "гексахлоран" (средство борьбы с вредными насекомыми).
Реакции присоединения
Реакции присоединения.
Слайд 26Запомните
Если в молекуле бензола один из
атомов водорода замещен на углеводородный радикал, то в дальнейшем в
первую очередь будут замещаться атомы водорода при втором, четвертом и шестом атомах углерода.
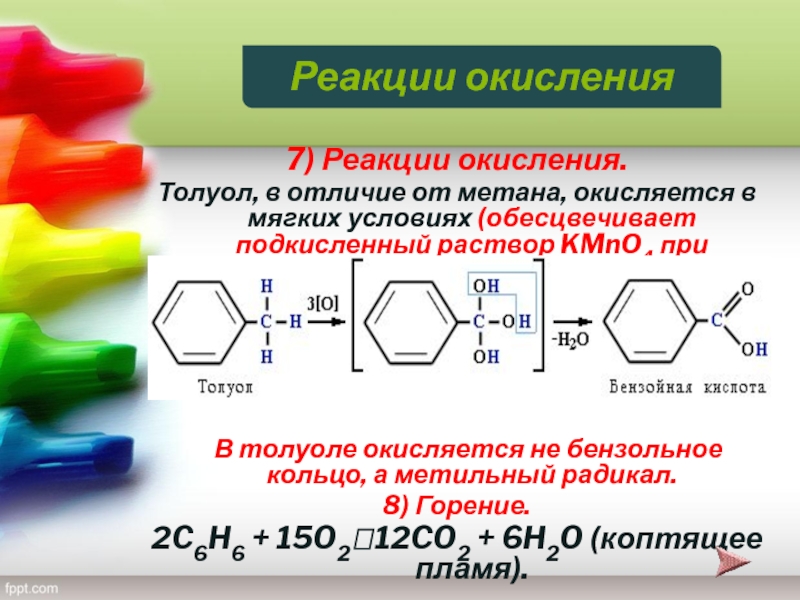
Слайд 277) Реакции окисления.
Толуол, в отличие от метана, окисляется в
мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):
В толуоле окисляется не бензольное кольцо, а метильный радикал.
8) Горение.
2C6H6 + 15O212CO2 + 6H2O (коптящее пламя).
Реакции окисления
Слайд 28
1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией
(способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется при повышенной температуре с
использованием катализатора, например оксида хрома
C7H16 ––500°C→ C6H5 – CH3 + 4H2
Получение бензола
Слайд 292) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский). В качестве катализатора
используется палладиевая чернь или платина при 300°C.
C6H12 ––300°C,Pd→ C6H6 +
3H2
Получение бензола
Слайд 303) Циклическая тримеризация ацетилена и его гомологов над активированным углем при
600°C (Н.Д.Зелинский).
3C2H2 ––500°C, С→ C6H6
4) Сплавление солей ароматических кислот со щелочью
или натронной известью.
C6H5-COONa + NaOH ––t°→ C6H6 + Na2CO3
Получение бензола
Слайд 31Применение
Бензол С6Н6 используется как исходный продукт для
получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола
и т.д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Слайд 32Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ
(тротил, тол).
Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто-, мета-
и пара-ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений.
Изопропилбензол (кумол) С6Н4-СН(СН3)2 – исходное вещество для получения фенола и ацетона.
Винилбензол (стирол) C6H5-CН=СН2 используется для получения ценного полимерного материала полистирола.
Применение
Слайд 33Тест по теме АРЕНЫ
1. Вещества с общей формулой СnH2n-6 относятся
к классу:
а) алканов; б) алкенов;
в) алкинов;
г)аренов.
Слайд 34Тест по теме АРЕНЫ
2. Атомы углерода в состоянии SP2 –
гибридизация находятся в молекуле:
а) этана;
б) этина;
в) пентина; г)бензола.
Слайд 35Тест по теме АРЕНЫ
3. Бензольное кольцо содержится в молекуле:
а)
гексана;
б) циклогексана;
в)
гексена;
г) толуола.
Слайд 36Тест по теме АРЕНЫ
4. Гомологами являются:
а) метан и хлорметан;
б)
этилен и этин;
в) бензол и толуол.
г) гексен и циклогексан
Слайд 37Тест по теме АРЕНЫ
5. Бензол можно получить из:
а) карбоната кальция;
б)
карбида кальция;
в) ацетилена;
г) метана.
Слайд 38Тест по теме АРЕНЫ
6. Укажите молекулярную формулу бензола:
а) С2Н4;
б) С8Н18;
в)
С6Н6; г) С6Н5-СН3.
Слайд 39Тест по теме АРЕНЫ
7. Какой тип реакций характерен для бензола:
а) полимеризации;
б) присоединения;
в) замещения;
г) окисления
Слайд 40Тест по теме АРЕНЫ
8. Допишите уравнения реакции, определите её тип,
назовите продукты реакции:
С6Н6 + CI2 → ? + ?
С6Н6 +
CI2 → ?
С6Н5 –СН3 + 3HO- NO2 → ?
Слайд 41Тест по теме АРЕНЫ
9. Физические свойства бензола и его гомологов.
10. Какой объём водорода (при н.у.) присоединится к 156 г.
бензола при его гидрировании.
Слайд 42Тест по теме АРЕНЫ
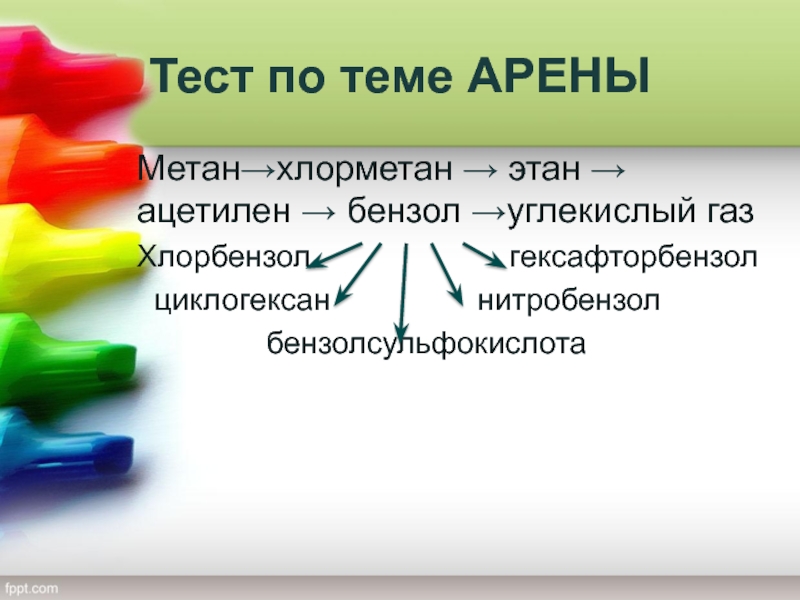
Метан→хлорметан → этан → ацетилен → бензол
→углекислый газ
Хлорбензол
гексафторбензол
циклогексан нитробензол
бензолсульфокислота