Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соли
Содержание
- 1. Соли
- 2. ОглавлениеОпределениеТипы солейНоменклатураДобычаПрименениеСоль и здоровьеИспользованиеВопросы для самопроверкиДомашнее заданиеИсточники материалов
- 3. СолиСОЛИ- продукты замещения атомов водорода кислоты на
- 4. ТИПЫ СОЛЕЙСредние (нормальные) соли — все атомы
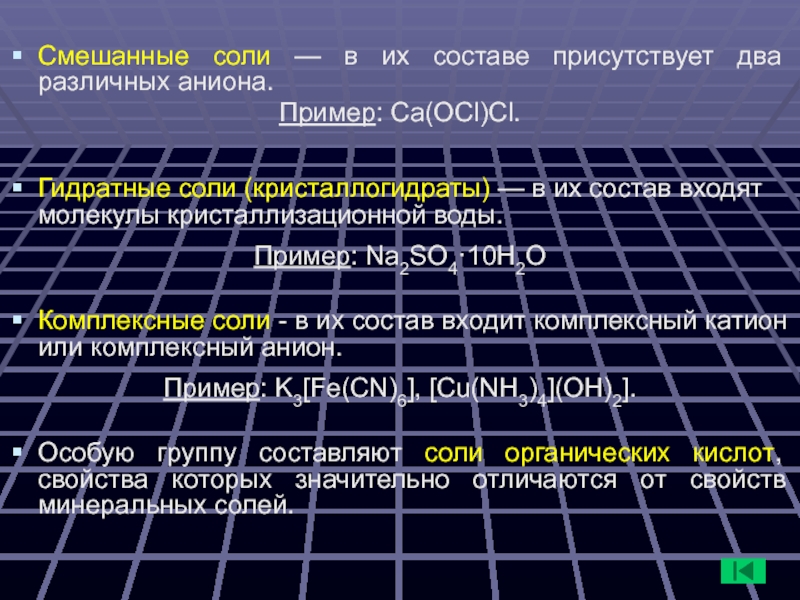
- 5. Смешанные соли — в их составе присутствует
- 6. Химический состав различных типов соли одинаков -
- 7. НоменклатураНазвания солей образуются из двух слов: название
- 8. ДобычаСоль добывают двумя путями: добычей полезных ископаемых и испарением морской воды.
- 9. ПрименениеСоли повсеместно используются как в производстве, так
- 10. Слайд 10
- 11. Соль и здоровьеПотребность в соли у человека
- 12. Слайд 12
- 13. ИспользованиеПри растительной, мучной пище требуются значительные солевые
- 14. Слайд 14
- 15. Вопросы для самопроверкиКакое значение имеет превращение кислых
- 16. Домашнее задание§ 24, упр. 2, 3 с. 199
- 17. Источники материаловГабриелян О. С. Контрольные и проверочные
- 18. Скачать презентанцию
ОглавлениеОпределениеТипы солейНоменклатураДобычаПрименениеСоль и здоровьеИспользованиеВопросы для самопроверкиДомашнее заданиеИсточники материалов
Слайды и текст этой презентации
Слайд 1Соли
Муниципальное общеобразовательное учреждение средняя общеобразовательная школа №5.
2010 год
Презентация подготовлена
учителем химии
Рощепкиной
Н. А.
Слайд 2Оглавление
Определение
Типы солей
Номенклатура
Добыча
Применение
Соль и здоровье
Использование
Вопросы для самопроверки
Домашнее задание
Источники материалов
Слайд 3Соли
СОЛИ- продукты замещения атомов водорода кислоты на металл или групп
ОН основания на кислотный остаток.
Соль или хлористый натрий - это
белое кристаллическое минеральное вещество, встречающееся в природе; растворяется в воде; один из немногих минералов, которые едят люди. Соль - самая древняя из специй.Слайд 4ТИПЫ СОЛЕЙ
Средние (нормальные) соли — все атомы водорода в молекулах
кислоты замещены на атомы металла. Пример: Na2CO3, K3PO4.
Кислые соли —
атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример: NaHCO3, K2HPO.Основные соли — гидроксогруппы основания (OH-) частично замещены кислотными остатками. Пример: Cu(OH)2CO3.
Двойные соли - в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример: KAl(SO4)2·12H2O.
Слайд 5Смешанные соли — в их составе присутствует два различных аниона.
Пример: Ca(OCl)Cl.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы
кристаллизационной воды. Пример: Na2SO4·10H2O
Комплексные соли - в их состав входит комплексный катион или комплексный анион.
Пример: K3[Fe(CN)6], [Cu(NH3)4](OH)2].
Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей.
Слайд 6Химический состав различных типов соли одинаков - 99% хлористого натрия
- но структура кристаллов изменяется сильно.
Обычная столовая соль состоит
из мелких гранул, кошерная соль намного более неровной структуры, крупнее. Для попкорна используется соль, которая легко растворяется. Каменная соль - большие куски минерала, хлористого натрия. Различие в форме и структуре позволяет добиться разного вкуса и полезна для различных блюд. Скорость, с которой она растворяется, также очень важна, и соль для соления должна быть очень мелкой, чтобы раствориться даже в холодной жидкости.
Слайд 7Номенклатура
Названия солей образуются из двух слов: название аниона в именительном
падеже и название катиона в родительном падеже: Na2SO4 — сульфат
натрия.Для металлов с переменной степенью окисления её указывают в скобках: FeSO4 — сульфат железа (II), Fe2(SO4)3 — сульфат железа (III).
Слайд 9Применение
Соли повсеместно используются как в производстве, так и в повседневной
жизни.
1. Соли соляной кислоты. Из хлоридов больше всего используют хлорид
натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды.2. Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы гипс. Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс.
3. Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония.
4. Из ортофосфатов важнейшим является ортофосфат кальция. Эта соль служит основной составной частью минералов — фосфоритов и апатитов. Фосфориты и апатиты используются в качестве сырья в производстве фосфорных удобрений
5. Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести.
Карбонат натрия (соду) применяют в производстве стекла и при варке мыла. Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Слайд 11Соль и здоровье
Потребность в соли у человека и животных (травоядных!)
связана с инстинктом. Соленость не случайно поэтому - одно из
четырех основных ощущений вкуса у человека. Более того, у человека, и особенно у диких животных, недостаток соли губительно сказывается на их силе и скорости реакции и, следовательно, оказывает влияние на способность животных добывать пищу, а у человека - на его работоспособность. Однако избыток соли в организме при усиленном потреблении ее не менее вреден - он вызывает различные заболевания. Отсюда видно, что необходим солевой баланс, который очень хрупок.Человек с солевым дефицитом обычно ощущает слабость и сонливость, при длительном отсутствии соли появляются головокружение, тошнота, потеря вкуса, иногда полная утрата вкусовых ощущений.
Слайд 13Использование
При растительной, мучной пище требуются значительные солевые добавки, при мясной
и молочной - гораздо меньшие, ибо любой животный организм и
продукт уже должен включать в себя необходимое количество соли.Между тем на практике бывает так, что с мясом, салом, яйцами, маслом и молоком, с сырами и колбасами человек потребляет прямо и косвенно больше соли, чем нужно. Поэтому эти продукты чаще фигурируют в числе вызывающих различные нарушения обмена веществ, в том числе солевые отложения, хотя не всегда это связано с ними самими. Так, например, отварное мясо без соли может преспокойно поглощаться теми, кому такое же мясо, но с солью, противопоказано.
Практически современный человек, питающийся в значительной мере мясными и молочными, рыбными солеными и копчеными продуктами, может почти обходиться без соли.
В кулинарном отношении недосол вообще не страшен - он быстро исправим. Вот почему это отражено и в пословице: "Недосол на столе, пересол - на спине". Так как пересол вызывает необходимость новых затрат времени и продуктов. Пересол устраняется разными, но всегда не особенно эффективными способами: у мясных блюд и в супах - добавлением сметаны, риса, картофеля и других солепоглощающих крахмалистых продуктов (муки, круп), в кашах и пюре - прибавлением свежего аналогичного, но совершенного несоленого пищевого материала, в рыбе - сметаной и добавлением воды, в грибах - сметаной и мучным соусом.
Слайд 15Вопросы для самопроверки
Какое значение имеет превращение кислых солей в средние
(например, гидрокарбонатов кальция и магния в карбоныты) в жизни человека?
Слайд 17Источники материалов
Габриелян О. С. Контрольные и проверочные работы. Дидактическое пособие.
М., Дрофа, 2005.
Габриелян О. С.. Контрольные и проверочные работы. К
учебнику О. С. Габриеляна. «Химия. 9 класс». М.: Дрофа, 2009 г.Теория и методика обучения химии /Под ред. О. С. Габриеляна / М. – Академия, 2009.
http://www.xumuk.ru/encyklopedia/
http://www.chemistry-43school.narod.ru/
http://pptcloud.ru/kartinki/khimija/