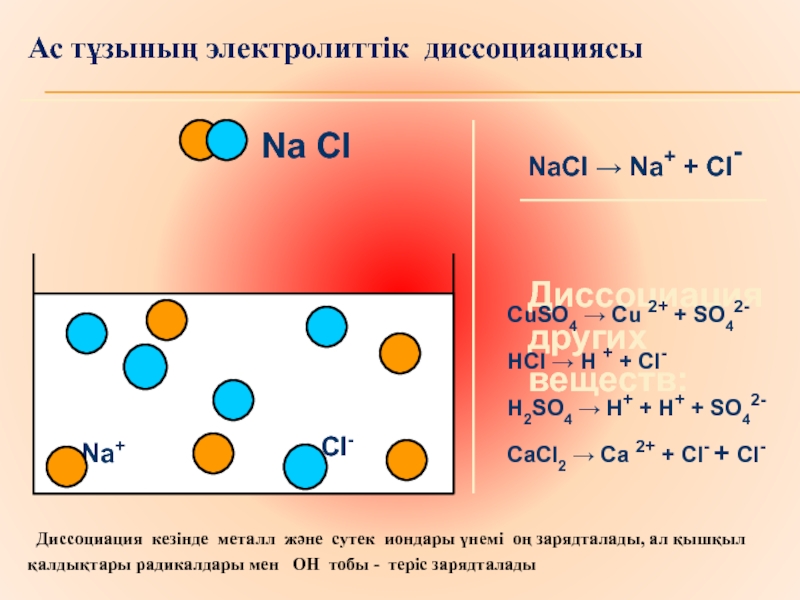
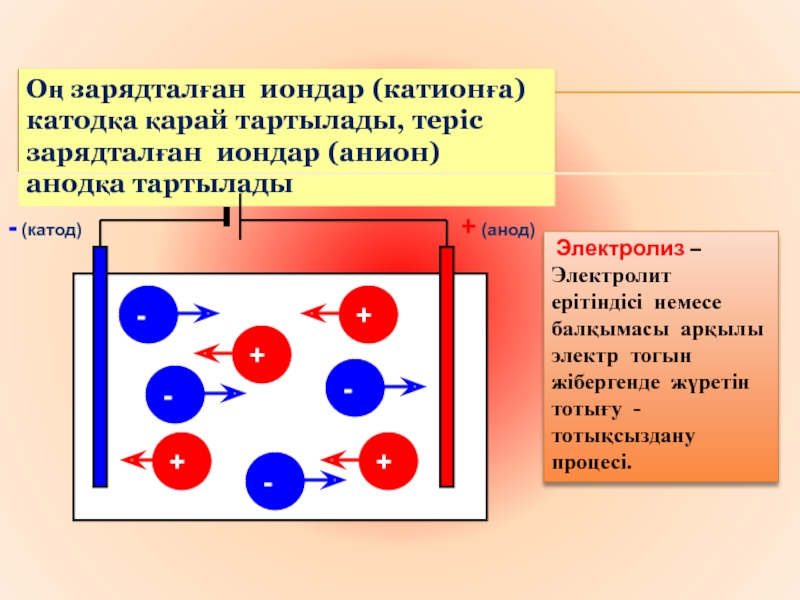
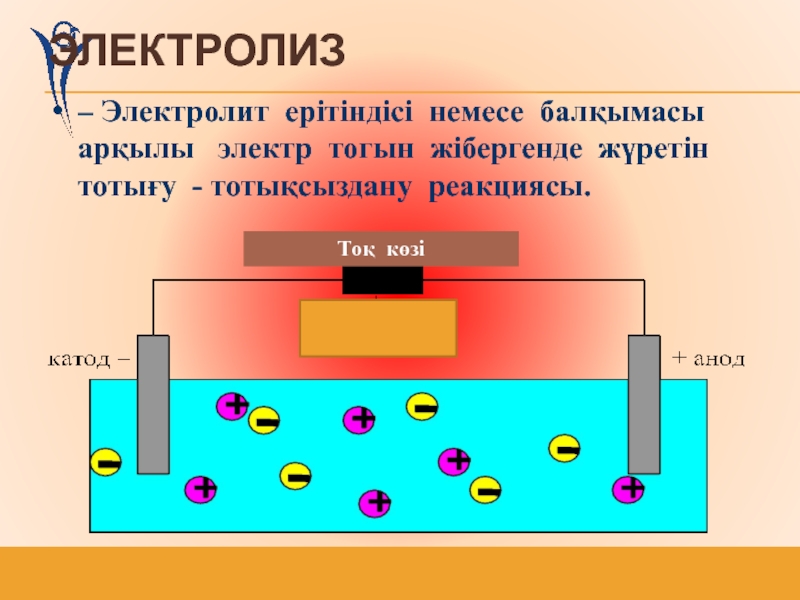
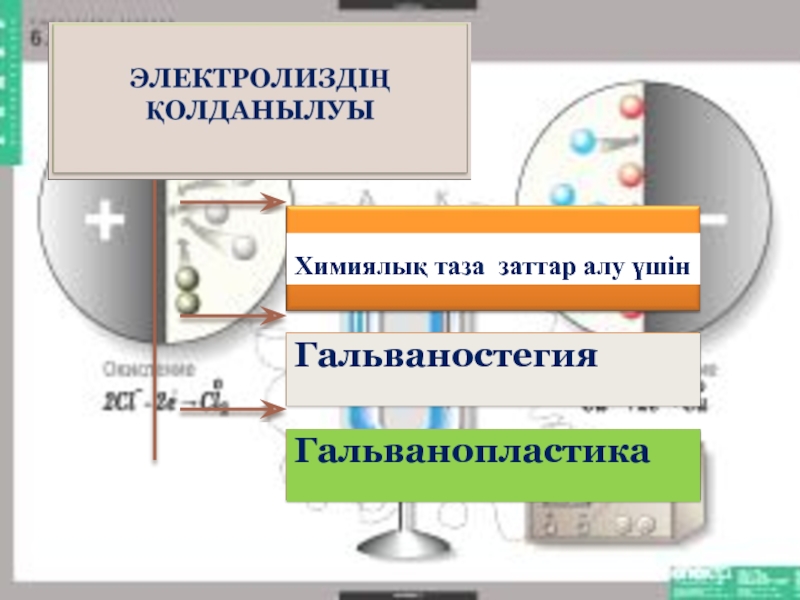
білімдерін жүйелеу және қорытындылау. «Электролиз» тақырыбы жайлы білімін эксперимент арқылы
және есептер шығара отырып тереңдетіп жетілдіру.Б) дамытушылық: экспериментті орындауда техникалық машықты қалыптастыру,ерітінді және балқыма электролиздеріне байланысты есепті шығара білу.
В) тәрбиелілік: пәнге деген ынтасын арттыру, өз бетімен жұмыс жасауды үйрету.