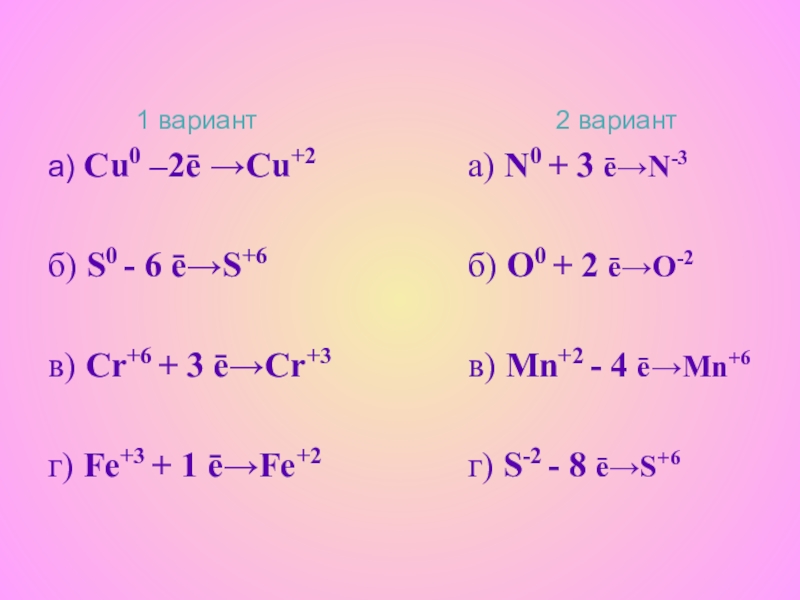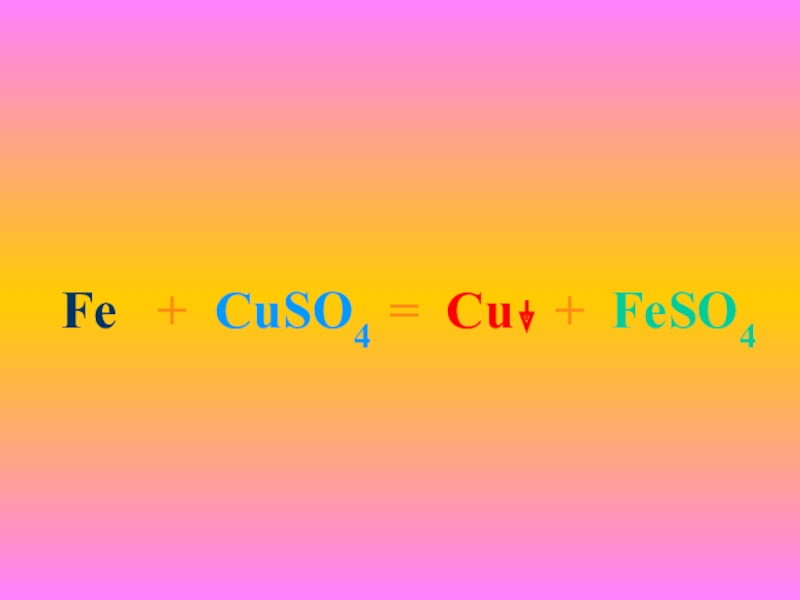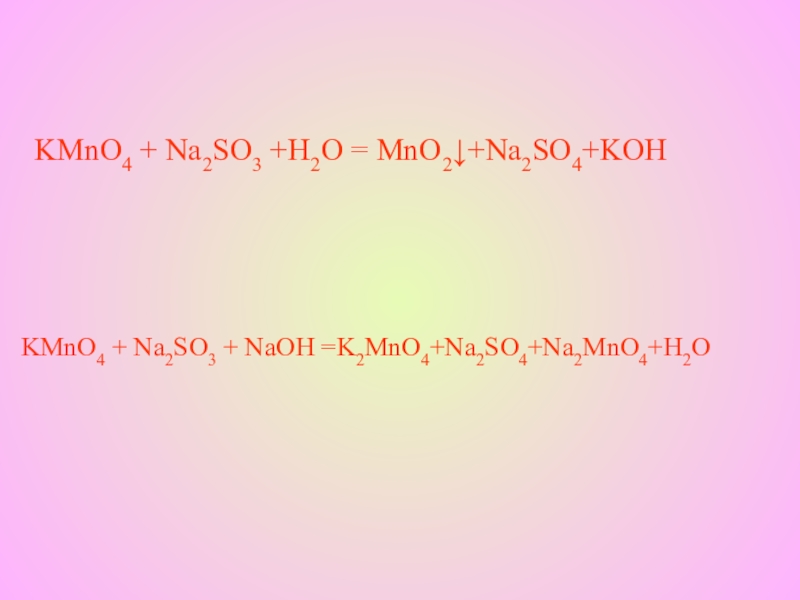Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
"её величество окислительно- восстановительная реакция"
Содержание
- 1. "её величество окислительно- восстановительная реакция"
- 2. «Жить – это значит узнавать…Жить – это значит творить,трудясь без устали, с неисчерпаемым вдохновением!»Д. И. Менделеев
- 3. ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНАЯ РЕАКЦИЯ ЕЁ ВЕЛИЧЕСТВО
- 4. Проверь себя! Определить степень окисления элементов в
- 5. ОКИСЛЕНИЕ – ОТДАЧА ЭЛЕКТРОНОВ
- 6. Восстановители (отдающие электроны): металлы, водород, уголь, СO,
- 7. 1 варианта) Cu0 – ? ē →Cu+2б)
- 8. 1 варианта) Cu0 –2ē →Cu+2б) S0 -
- 9. №1Hg + S →HgSNaNO3 →NaNO2+O2CuSO4+Na OH→Cu(OH)2+Na2SO4№2CaCO3→CaO+CO2H2O+P2O5→H3PO4Fe+HCl→FeCl2+H2Расставьте СО всех элементов в формулах веществ в УХР
- 10. ОВР - это такие реакции, при которых
- 11. Сущность ОВР - ПЕРЕХОД ЭЛЕКТРОНОВ от одних атомов, молекул или ионов к другим
- 12. ТБ! Помните: при работе с веществами, не
- 13. ЛАБОРАТОРНЫЙ ОПЫТ №1 Железный гвоздик опустите в
- 14. Fe + CuSO4 = Cu + FeSO4
- 15. Опорная схемаЕё величество ОВРПроцессыОкисление- ēВосстановление+ēОкислительВосстановительУчастники
- 16. Горение
- 17. Сгорание топлива
- 18. Фотосинтез Это единственно важный первичный источник энергии
- 19. БрожениеГниение
- 20. Слайд 20
- 21. Молния
- 22. Коррозия металлов и сплавов
- 23. 3Hg + 2KMnO4 + 8H+ = 2Hg+2
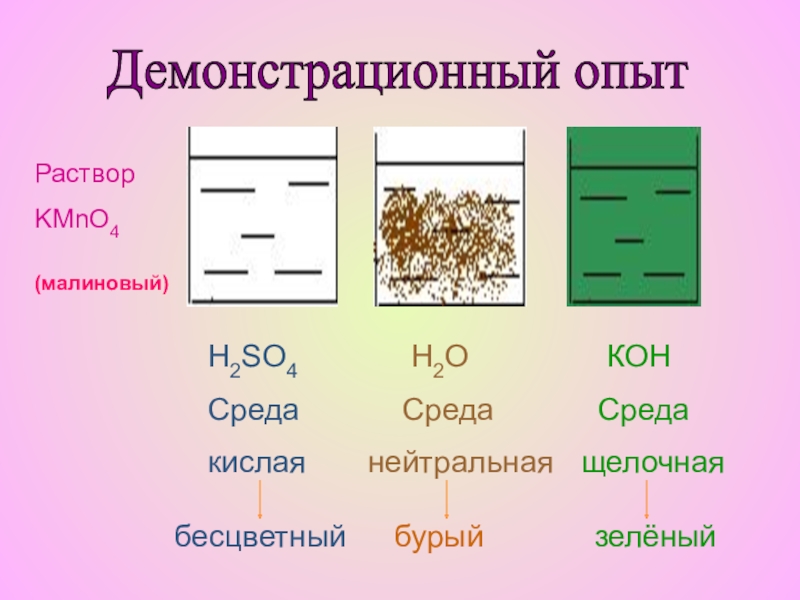
- 24. Демонстрационный опыт РастворKMnO4(малиновый)H2SO4 Средакислаябесцветный Н2О Среданейтральнаябурый КOH Средащелочнаязелёный
- 25. СОСТАВЬТЕ УРАВНЕНИЯ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА: KMnO4 + Na2SO3 +H2SO4 = MnSO4+K2SO4+Na2SO4+H2O
- 26. KMnO4 + Na2SO3 +H2O = MnO2↓+Na2SO4+KOHKMnO4 + Na2SO3 + NaOH =K2MnO4+Na2SO4+Na2MnO4+H2O
- 27. «Как трудно было сперва поддерживать огонь и
- 28. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
«Жить – это значит узнавать…
Жить – это значит творить,
трудясь без
устали,
с неисчерпаемым вдохновением!»
Д. И. Менделеев
Слайд 4Проверь себя!
Определить степень окисления элементов в соединениях:
Zn,
K Cl O3,
H
CL O4,
H2,
K2 S O3,
H2 S,
K Mn O4
H2,
Zn,
0
K Cl O3,
+1
+5
-2
H CL
O4,+1
+7
-2
0
H2 S,
-2
+1
K2 S O3,
+4
-2
+1
K Mn O4
+1
+7
-2
Слайд 5ОКИСЛЕНИЕ – ОТДАЧА ЭЛЕКТРОНОВ
(СО повышается)
ВОССТАНОВЛЕНИЕ –ВЗЯТИЕ ЭЛЕКТРОНОВ
(СО понижается)Слайд 6Восстановители (отдающие электроны): металлы, водород, уголь, СO, сероводород, аммиак
Окислители
(принимающие электроны): O2, азотная и серная кислоты, галогены,
KMnO4, K2Cr2O7Слайд 71 вариант
а) Cu0 – ? ē →Cu+2
б) S0 - ?
ē→S+6
в) Cr+6 + ? ē→Cr+3
г) Fe+3 + ? ē→Fe+2
2 вариант
а)
N0 + ? ē→N-3б) O0 + ? ē→O-2
в) Mn+2 - ? ē→Mn+6
г) S-2 - ? ē→S+6
Сколько ē отдано или принято атомами или ионами при следующих превращениях
Слайд 81 вариант
а) Cu0 –2ē →Cu+2
б) S0 - 6 ē→S+6
в) Cr+6
+ 3 ē→Cr+3
г) Fe+3 + 1 ē→Fe+2
2 вариант
а) N0 +
3 ē→N-3б) O0 + 2 ē→O-2
в) Mn+2 - 4 ē→Mn+6
г) S-2 - 8 ē→S+6
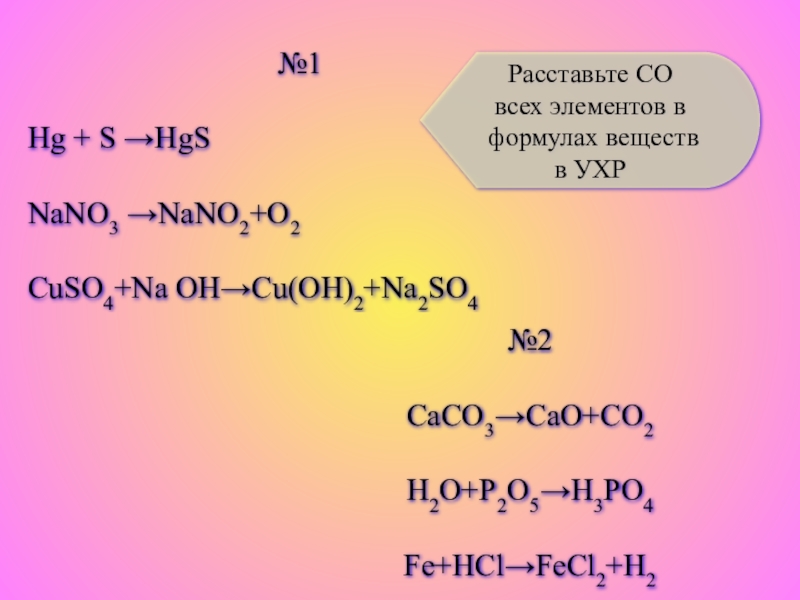
Слайд 9№1
Hg + S →HgS
NaNO3 →NaNO2+O2
CuSO4+Na OH→Cu(OH)2+Na2SO4
№2
CaCO3→CaO+CO2
H2O+P2O5→H3PO4
Fe+HCl→FeCl2+H2
Расставьте СО всех элементов в
формулах веществ в УХР
Слайд 10ОВР - это такие реакции,
при которых происходит изменение степеней
окисления атомов химических элементов или ионов,
образующих реагирующие вещества
Слайд 12ТБ!
Помните:
при работе с веществами, не берите их руками
и не пробуйте на вкус, реактивы – не арбуз: слезет кожа
с языка и отвалится рука.Слайд 13ЛАБОРАТОРНЫЙ ОПЫТ №1
Железный гвоздик опустите в раствор сульфата меди
(II)
Я известно с давних пор и имею спрос.
Опусти меня
в раствор, в медный купорос.Изменить хочу я соль. Ну-ка, выйди, соизволь!
Удивительный момент - стал другим раствор.
Вытесняю элемент, не вступая в спор.
На меня взгляни, ответь - начинаю я ржаветь.
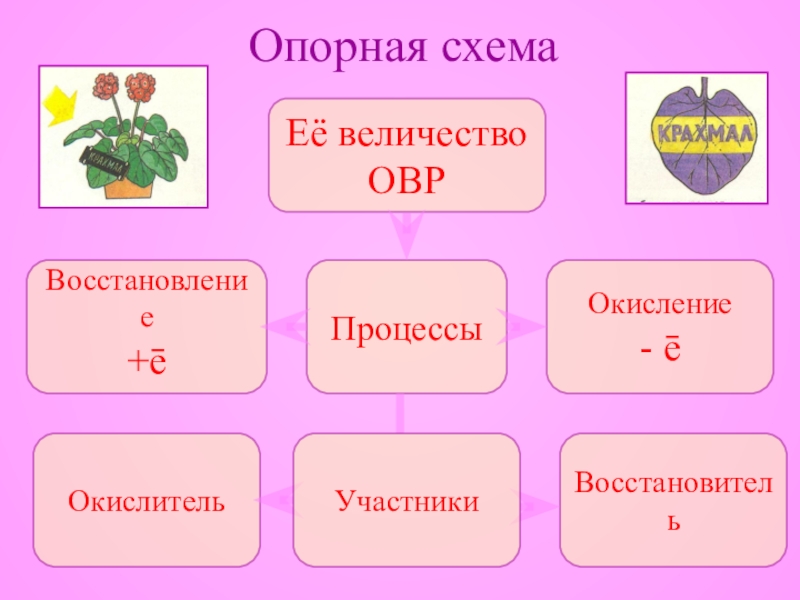
Слайд 15Опорная схема
Её величество ОВР
Процессы
Окисление
- ē
Восстановление
+ē
Окислитель
Восстановитель
Участники
Слайд 18Фотосинтез
Это единственно важный первичный источник энергии для всего живого
6CO2 + 6H2O -> C6H12O6 + 6O2
Слайд 233Hg + 2KMnO4 + 8H+ = 2Hg+2 + 2K+ +
2MnO2 + 2H2O
Данное уравнение реакции имеет огромное значение с точки
зрения экологии, так как позволяет связать при обычных условиях случайно пролитую ртуть: Это возможно в домашних условиях
в случае попадания ртути в труднодоступные места (аптечный пузырёк «марганцовки» (2 гр) + 1 литр воды + 1/2 чайной ложки уксуса)
Слайд 24Демонстрационный опыт
Раствор
KMnO4
(малиновый)
H2SO4
Среда
кислая
бесцветный
Н2О
Среда
нейтральная
бурый
КOH
Среда
щелочная
зелёный
Слайд 25СОСТАВЬТЕ УРАВНЕНИЯ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА:
KMnO4 + Na2SO3 +H2SO4
= MnSO4+K2SO4+Na2SO4+H2O
Слайд 27 «Как трудно было сперва поддерживать огонь
и как теперь легко.
Так всё придёт – только трудитесь.
Приобретайте главное своё богатство
– умение себя побеждать»
Д. И. Менделеев