Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физические и химические явления. Химические уравнения
Содержание
- 1. Физические и химические явления. Химические уравнения
- 2. Содержание1. Химические и физические явления2. Признаки протекания
- 3. «Ах сколько нам открытий чудных
- 4. Химические и физические явленияФизические явленияХимический состав молекул
- 5. Признаки протекания химической реакцииПоявление запахаВыделение осадкаВыделение
- 6. Проверь себя!В каком случае произошла химическая реакция?
- 7. Условия протекания химических реакцийЧистота веществ (минимум примесей)Пропорциональность
- 8. 3. Тщательное перемешивание4. Применение катализатора Катализатор -
- 9. Михаил Васильевич Ломоносов
- 10. Суть закона сохранения веществАтомы двух веществ встречаются
- 11. Проверь себя!Сколько атомов каждого элемента потребовалось для
- 12. Для получения сульфида железа смешали 36 г
- 13. Химические уравненияХимическим уравнением называется условная запись химической
- 14. Алгоритм составления химического уравненияВ левой части
- 15. Попробуйте свои силыРасставьте коэффициенты в уравнениях P+O2
- 16. Слайд 16
- 17. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Содержание
1. Химические и физические явления
2. Признаки протекания химических реакций
3. Условия
протекания химических реакций
4. Закон сохранения масс
5. Уравнения химических реакций
Слайд 3«Ах сколько нам открытий чудных готовит просвещенья
дух»
А.С.ПушкинЗадачи :
Повторить признаки и условия течения химических реакций
Выяснить , что называется химическим уравнением
Научить составлять химические уравнения
Слайд 4Химические и физические явления
Физические явления
Химический состав молекул не меняется
Кристаллизация
Плавление
Фильтрация
Отстаивание
Перегонка
Химические
явления
Химический состав молекул изменяется
Изменяются
физические свойства
веществ ( цвет, запах, агрегатное состояние, электропроводность, теплопроводность, упругость, пластичность и т.д.) Слайд 5Признаки протекания
химической реакции
Появление запаха
Выделение осадка
Выделение газа
Изменение цвета
Выделение тепла
(экзотермическая реакция)
Поглощение тепла
(эндотермическая реакция)
Слайд 6Проверь себя!
В каком случае произошла химическая реакция? Почему вы так
думаете?
В крепко заваренный чай добавили дольку лимона
Осадок в ведре с
водойВ негашеную известь добавили воды
В печке сгорел уголь
Слайд 7Условия протекания химических реакций
Чистота веществ (минимум примесей)
Пропорциональность веществ по массе
Пример:Ar (S)=32, Ar (Fe) =
56S : Fe = 32 : 56 = 4 : 7
Для проведения реакции между серой и
железом надо взять четыре части серы и семь частей железа ( 12г серы и 21г железа)
Задание : В какой пропорциональности надо взять углерод и кислород для протекания химической реакции?
Решение : Ar (O) = 16, Ar (C)= 12,
О : С = 16 : 12 = 4 : 3
Ответ : в отношении 4:3
Слайд 83. Тщательное перемешивание
4. Применение катализатора
Катализатор - Вещества, которые изменяют
скорость химической реакции, оставаясь к концу её неизменными
5. Площадь соприкосновения
реагирующих веществСлайд 9 Михаил Васильевич Ломоносов
1711-1765 гг.
Создатель многих химических
производств в России (неорганических пигментов, глазурей, стекла, фарфора). Изложил в 1741-1750 гг. основы своего атомно-корпускулярного учения, выдвинул кинетическую теорию теплоты. Первым из русских академиков написал учебники по химии и металлургии. Основатель Московского УниверситетаАнтуан Лоран Лавуазье
1743-1794 гг.
Французский химик. Один из основоположников классической химии. Ввел в химию строгие количественные методы исследования. Доказал сложный состав атмосферного воздуха. Правильно объяснив процессы горения и окисления, создал основы кислородной теории. Заложил основы органического анализа.
В 1756 г М.В. Ломоносов открыл закон сохранения масс. Позднее А.Л. Лавуазье подтвердил правильность этого закона
Масса веществ, вступивших в реакцию, равна массе веществ , получившихся в результате её
Антуан Лоран Лавуазье
1743-1794 гг.
Антуан ЛоранЛавуазье
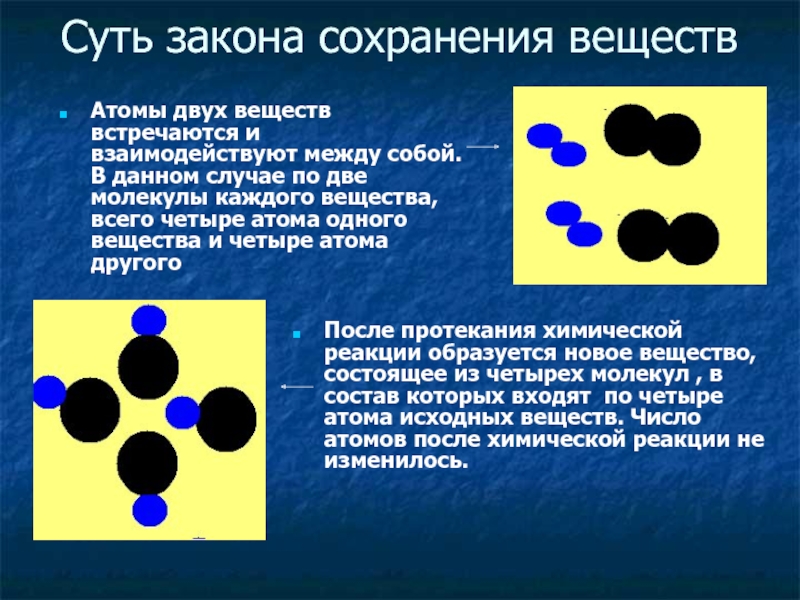
Слайд 10Суть закона сохранения веществ
Атомы двух веществ встречаются и взаимодействуют между
собой. В данном случае по две молекулы каждого вещества, всего
четыре атома одного вещества и четыре атома другогоПосле протекания химической реакции образуется новое вещество, состоящее из четырех молекул , в состав которых входят по четыре атома исходных веществ. Число атомов после химической реакции не изменилось.
Слайд 11Проверь себя!
Сколько атомов каждого элемента потребовалось для получения молекулы оксида
алюминия и трех молекул сернистой кислоты.
Молекула оксида алюминия :
2 атома алюминия и 3 атома кислорода3 атома серы, 6 атомов водорода и 9 атомов кислорода
Слайд 12
Для получения сульфида железа смешали 36 г серы и железо,
в результате реакции получили 99 г соли . Сколько грамм
железа взяли для этой реакции?63г железа
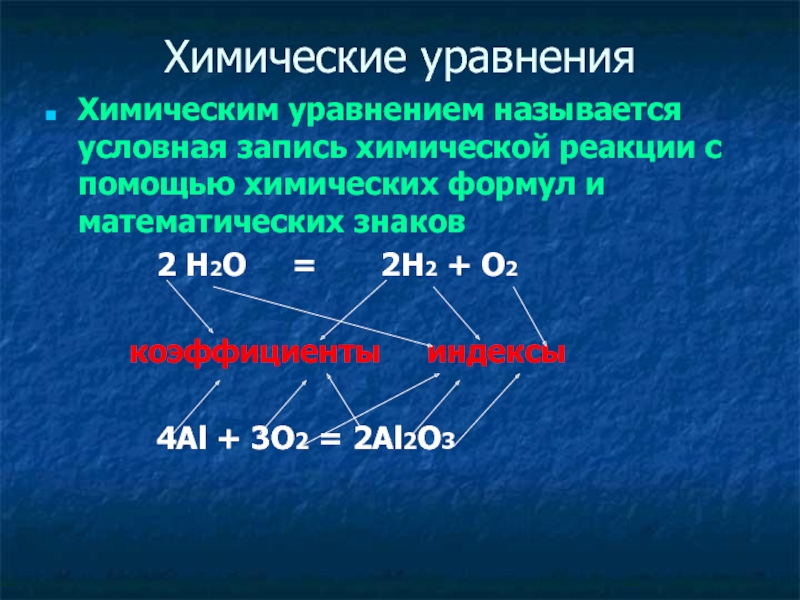
Слайд 13Химические уравнения
Химическим уравнением называется условная запись химической реакции с помощью
химических формул и математических знаков
2 Н2О = 2Н2 + О2 коэффициенты индексы
4Al + 3O2 = 2Al2O3
Слайд 14Алгоритм составления
химического уравнения
В левой части уравнения записывают формулы веществ,
вступивших в реакцию, соединяют их знаком «+», в правой части
уравнения записывают формулы(формулу) образующихся веществ, также с помощью знака «+». Между уравнениями ставят стрелкуCuCl2 + Al AlCl3 + Cu
Находим и расставляем коэффициенты к формулам так, чтобы число атомов одинаковых элементов в левой и правой частях уравнения были одинаковы. Заменяем стрелку знаком «=» .
3CuCl2 + 2Al = 2 AlCl3 + 3Cu
Меди : с правой стороны 3 и с левой 3
хлора : 6 и 6
Алюминия: 2 и 2
Слайд 15Попробуйте свои силы
Расставьте коэффициенты в уравнениях
P+O2 P2O5
4P
+ 5O2 = 2P2O5
Al + H2SO4 Al2(SO4)3 + H2
2Al
+ 3H2SO4 = Al2(SO4)3 + 3H2САМОСТОЯТЕЛЬНО
S + O2 SO3
Na + H2O NaOH + H2
MgCO3 + Al Al2(CO3)3 + Mg
Проверь !
2S +3O2 = 2SO3
2Na + 2H2O = 2NaOH + H2
3MgCO3 + 2Al = Al2(CO3)3 + 3Mg