Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фосфор. Фосфор оксиді
Содержание
- 1. Фосфор. Фосфор оксиді
- 2. Сабақтың мақсаты: Фосфор және оның оксидтері
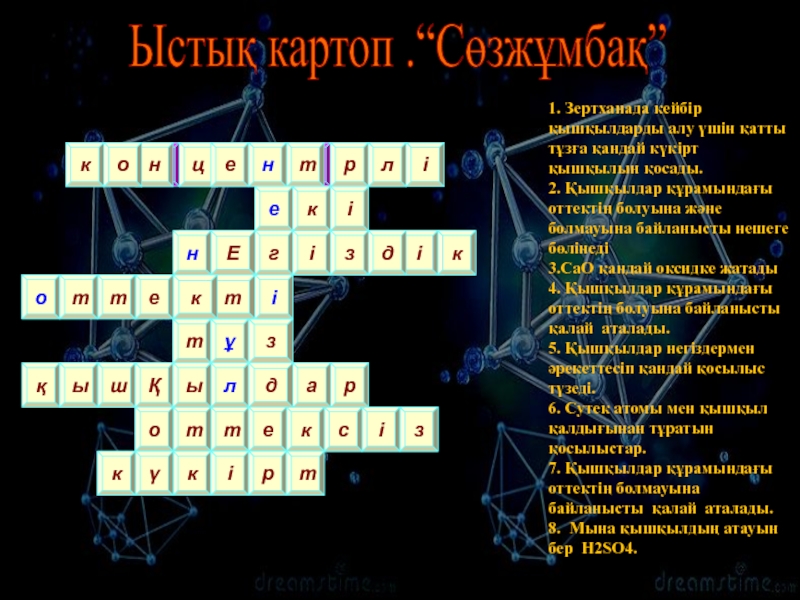
- 3. Ыстық картоп .“Сөзжұмбақ” 1. Зертханада кейбір
- 4. ФОСФОРатом құрылысықолданылуытабиғаттакездесуіхимиялыққасиеттеріалынуыфизикалыққасиеттері
- 5. Атом құрылысыФосфордың сыртқы энергетикалық деңгейінде 5 электрон
- 6. Табиғатта кездесуі
- 7. Алынуы2Ca3(PO4)2+6SiO2+10C = P4+6CaSiO3+10CO
- 8. ФОСФОРатом құрылысықолданылуытабиғаттакездесуіхимиялыққасиеттеріалынуыфизикалыққасиеттері
- 9. Физикалық қасиеттері
- 10. Химиялық қасиеттері1. Фосфор оттекте жанып, пентаоксид түзеді:4Р+5О2=2Р2О52.
- 11. 4. Фосфор металдармен фосфидтер түзе әрекеттеседі:3Са+2Р=Са3Р2 кальций фосфиді3Nа+Р=Na3Р натрий фосфиді5. Күрделі заттармен әрекеттеседі:5КСl3+6P=3P2O5+5KCl
- 12. Қолданылуы
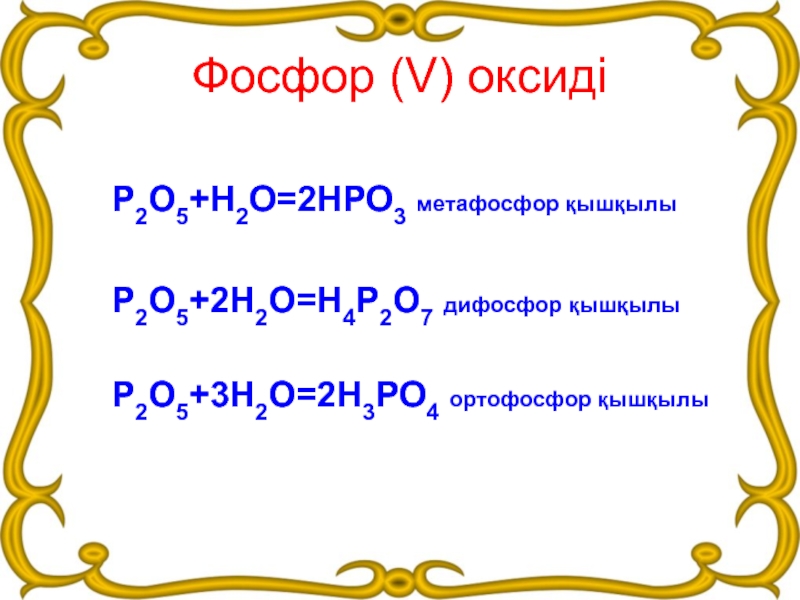
- 13. Фосфор (V) оксидіР2О5+Н2О=2НРО3 метафосфор қышқылыР2О5+2Н2О=Н4Р2О7 дифосфор қышқылыР2О5+3Н2О=2Н3РО4 ортофосфор қышқылы
- 14. АлынуыЗертханада алынуы:P2O5+3H2O=2H3PO4Өнеркәсіпте алынуы:Ca3(PO4)2+3H2SO4=3CaSO4 +2H3PO4
- 15. Химиялық қасиеттері:2H3PO4+3СаО=Ca3(PO4)2 +3H2OСа3(PO4)2+4Н3PO4=3Са(Н2РО4)2
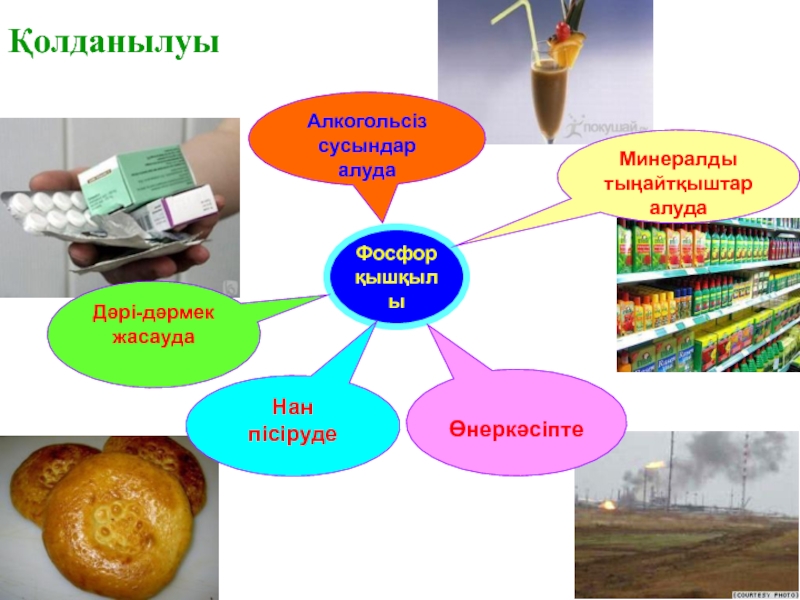
- 16. ҚолданылуыФосфор қышқылыАлкогольсіз сусындаралуда Дәрі-дәрмек жасаудаМинералдытыңайтқыштаралудаӨнеркәсіптеНан пісіруде
- 17. Сандарды сөйлетейікСабақты бекіту1669315660015
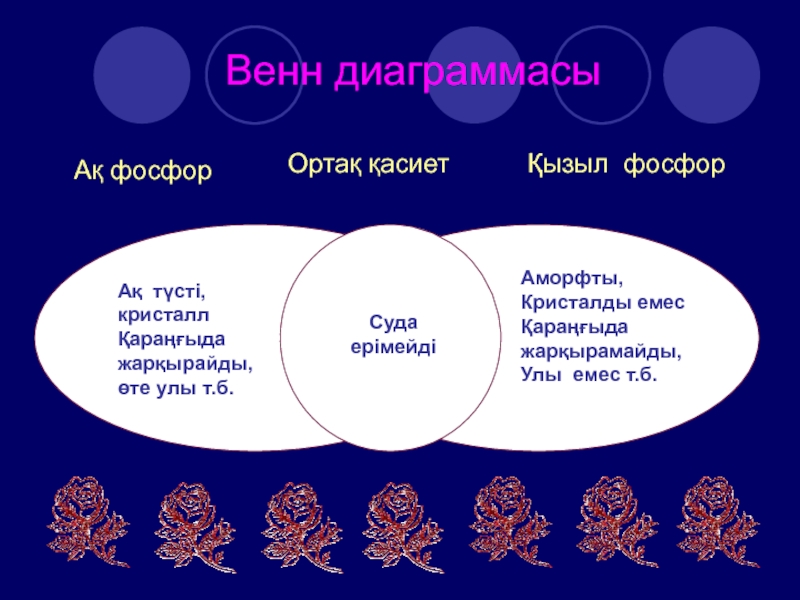
- 18. Венн диаграммасыАқ фосфорҚызыл фосфорОртақ қасиетАқ түсті, кристаллҚараңғыда
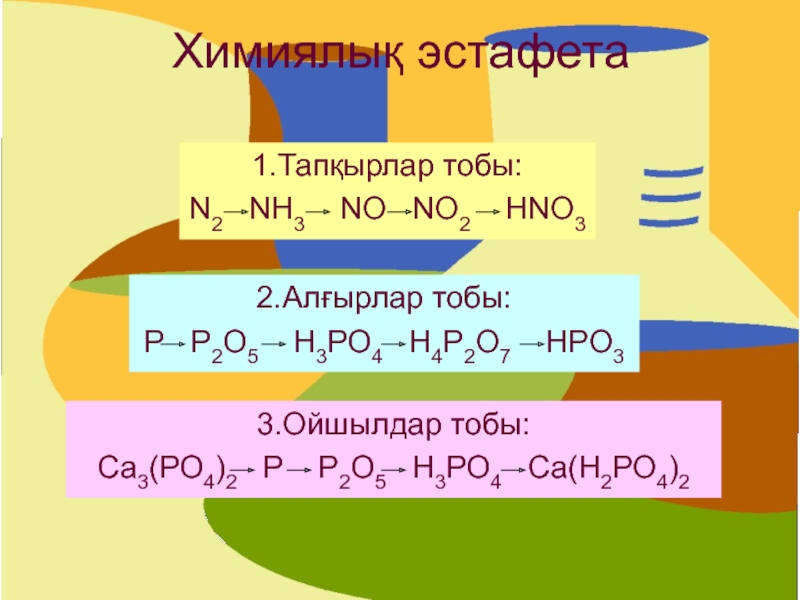
- 19. Химиялық эстафета1.Тапқырлар тобы:N2 NH3 NO
- 20. Эстафеталық ойын “Термин-синоним”
- 21. Эстафеталық ойын “Термин-синоним”
- 22. Оқушыларды бағалау.Үйге тапсырма:§ 20. Фосфор§ 21. Фосфор оксидтері №3; №4; №5
- 23. Скачать презентанцию
Сабақтың мақсаты: Фосфор және оның оксидтері жөнінде жалпы мәліметтерге сүйене отырып, нақты теориялық білімді ізденіс, өзіндік жұмыстар арқылы толықтыру, меңгерту, бекітуДамытушылық мақсаты: Оқушылардың шығармашылығын дамыта отырып ғылыми дүниетанымын кеңейту,
Слайды и текст этой презентации
Слайд 1
Ш.Уәлиханов атындағы орта мектеп
Ашық сабақ
Фосфор
Фосфор оксидтері
Химия пәнінің мұғалімі:
Қағазбекова Бағлан
Әкімбекқызы
Слайд 2Сабақтың мақсаты:
Фосфор және оның оксидтері жөнінде жалпы мәліметтерге
сүйене отырып, нақты теориялық білімді ізденіс, өзіндік жұмыстар арқылы толықтыру,
меңгерту, бекітуДамытушылық мақсаты:
Оқушылардың шығармашылығын дамыта отырып ғылыми дүниетанымын кеңейту, ізденіс жолымен мақсатқа жетуге баулу
Тәрбиелік мақсаты:
Өзара ынтымақтастыққа, өз ұлтын шексіз сүюге, экологиялық сауаттылыққа тәрбиелеу
Слайд 3 Ыстық картоп .“Сөзжұмбақ”
1. Зертханада кейбір қышқылдарды алу үшін қатты
тұзға қандай күкірт қышқылын қосады. 2. Қышқылдар құрамындағы оттектің болуына және
болмауына байланысты нешеге бөлінеді 3.СаО қандай оксидке жатады 4. Қышқылдар құрамындағы оттектің болуына байланысты қалай аталады. 5. Қышқылдар негіздермен әрекеттесіп қандай қосылыс түзеді. 6. Сутек атомы мен қышқыл қалдығынан тұратын қосылыстар. 7. Қышқылдар құрамындағы оттектің болмауына байланысты қалай аталады. 8. Мына қышқылдың атауын бер H2SO4.Е
З
Р
О
Ф
Р
Л
Е
С
О
Д
Е
И
Р
О
А
Р
Т
Ф
Е
М
Н
Р
О
И
Г
Т
И
Б
О
Л
Г
Д
И
Т
Н
к
ц
н
е
т
н
р
л
о
е
г
Е
н
і
і
д
з
т
к
і
е
т
т
ұ
т
і
с
к
р
з
з
ш
л
Қ
а
д
ы
е
к
к
і
к
т
о
і
ү
р
к
т
о
қ
ы
і
т
Слайд 5Атом құрылысы
Фосфордың сыртқы энергетикалық деңгейінде 5 электрон бар. Атомындағы электрондардың
орналасуы:
Электрондық құрылысы:
+15Р )2е )8е )5е
1s2
2s2 2p6 3s2 3p3 Слайд 10Химиялық қасиеттері
1. Фосфор оттекте жанып, пентаоксид түзеді:
4Р+5О2=2Р2О5
2. Фосфор хлормен ерекеттесіп,
фосфор үш хлоридін және 3000С-та фосфор пентахлоридін түзеді:
2Р+3Cl2=2РCl3
2Р+5Cl2=2РCl5
3. Фосфор сутекпен
тікелей әрекеттесіп, фосфин түзеді:2Р+3Н2=2РН3
Слайд 114. Фосфор металдармен фосфидтер түзе әрекеттеседі:
3Са+2Р=Са3Р2 кальций фосфиді
3Nа+Р=Na3Р натрий фосфиді
5.
Күрделі заттармен әрекеттеседі:
5КСl3+6P=3P2O5+5KCl
Слайд 13Фосфор (V) оксиді
Р2О5+Н2О=2НРО3 метафосфор қышқылы
Р2О5+2Н2О=Н4Р2О7 дифосфор қышқылы
Р2О5+3Н2О=2Н3РО4 ортофосфор қышқылы
Слайд 16Қолданылуы
Фосфор
қышқылы
Алкогольсіз сусындар
алуда
Дәрі-дәрмек жасауда
Минералды
тыңайтқыштар
алуда
Өнеркәсіпте
Нан
пісіруде
Слайд 18Венн диаграммасы
Ақ фосфор
Қызыл фосфор
Ортақ қасиет
Ақ түсті,
кристалл
Қараңғыда
жарқырайды,
өте улы
т.б.
Аморфты,
Кристалды емес
Қараңғыда
жарқырамайды,
Улы емес т.б.
Суда
ерімейді
Слайд 19Химиялық эстафета
1.Тапқырлар тобы:
N2 NH3 NO NO2
HNO3
2.Алғырлар тобы:
Р Р2О5 Н3РО4 Н4Р2О7 HРO3
3.Ойшылдар
тобы:Са3(РО4)2 Р Р2О5 Н3РО4 Са(Н2РО4)2