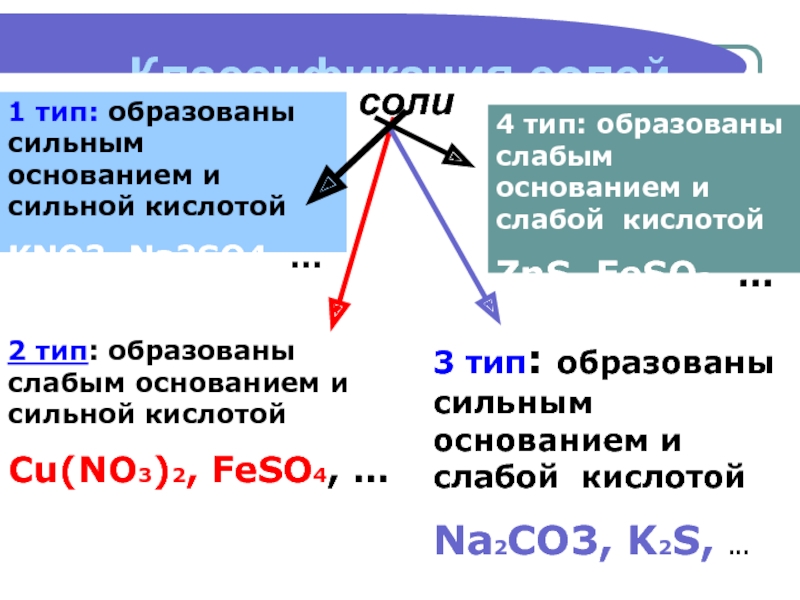
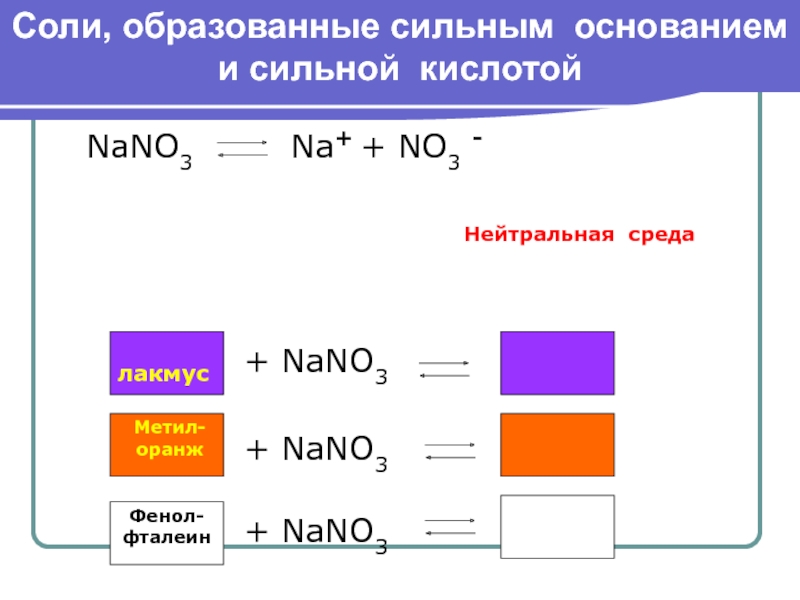
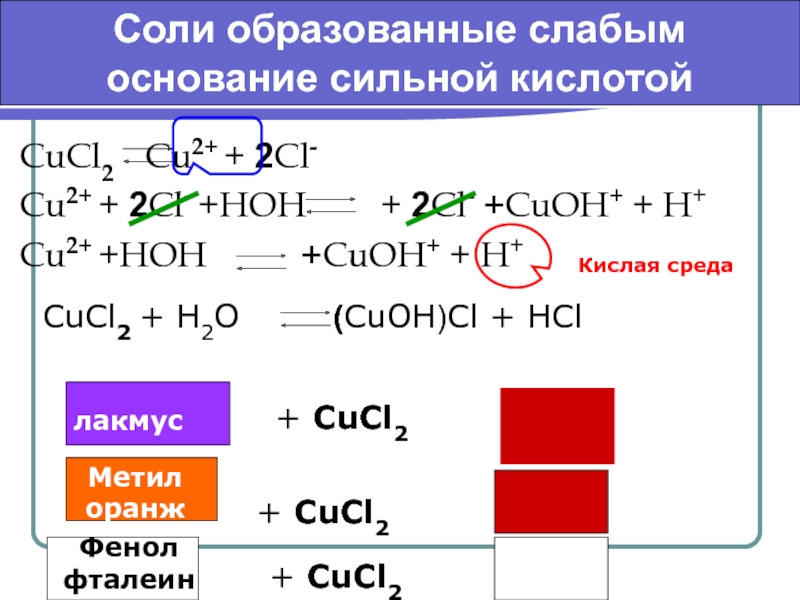
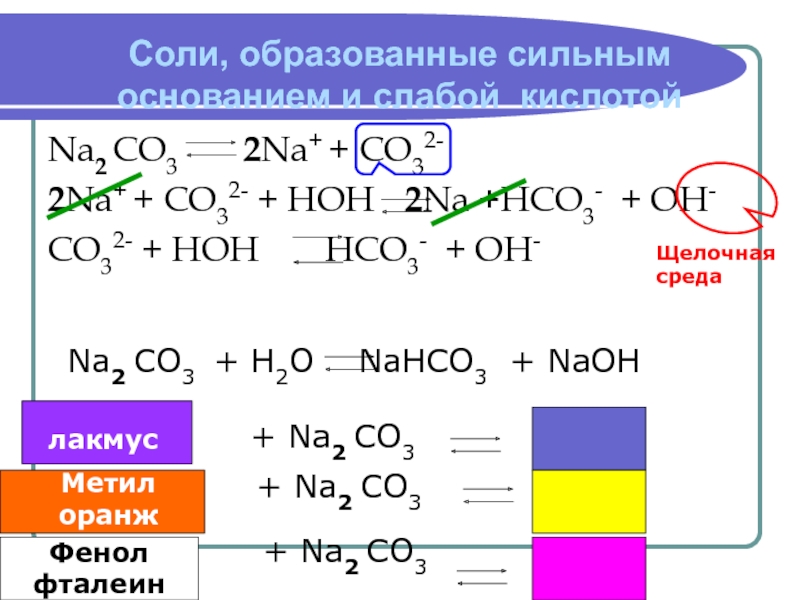
к их разложению.
Гидролизу подвергаются соединения различных
классов: соли, углеводы, белки, сложные эфиры, жиры и др.По направлению реакции гидролиза можно разделить на обратимые и необратимые.