Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз солей
Содержание
- 1. Гидролиз солей
- 2. Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
- 3. Всегда ли ионы способны образовывать с водой
- 4. Какие типы гидролиза возможны? Поскольку соль состоит
- 5. Алгоритм написания уравнений гидролиза 1. Определяем тип
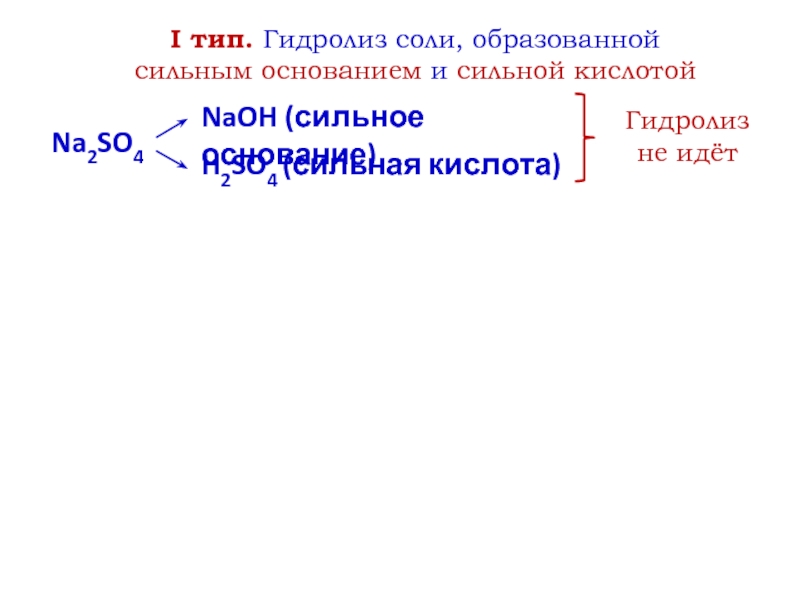
- 6. I тип. Гидролиз соли, образованной сильным основанием и сильной кислотойNa2SO4NaOH (сильное основание)H2SO4 (сильная кислота)Гидролиз не идёт
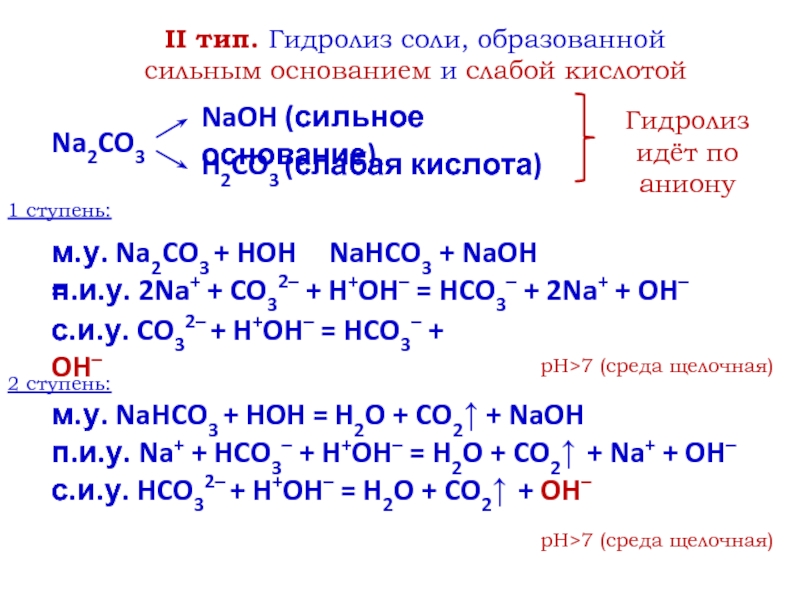
- 7. II тип. Гидролиз соли, образованной сильным основанием
- 8. III тип. Гидролиз соли, образованной слабым основанием
- 9. IV тип. Гидролиз соли, образованной слабым основанием
- 10. Факторы, влияющие на степень гидролиза.Температура. Поскольку реакция гидролиза
- 11. Практическое применение.На практике с гидролизом приходится сталкиваться,
- 12. Задание 1. Фенолфталеин можно использовать для обнаружения
- 13. Задание 5. Запишите уравнения гидролиза солей и
- 14. Домашнее задание:Составьте уравнения гидролиза, определите тип гидролиза
- 15. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Гидролиз солей – это взаимодействие ионов соли с водой с
образованием малодиссоциирующих частиц.
Слайд 3Всегда ли ионы способны образовывать с водой малодиссоциирующие частицы?
катионы сильного
основания и анионы сильной кислоты малодиссоциирующих частиц образовать не могут,
следовательно, в реакцию гидролиза не вступаютСлайд 4Какие типы гидролиза возможны?
Поскольку соль состоит из катиона и
аниона, то возможно три типа гидролиза:
гидролиз по катиону (в реакцию
с водой вступает только катион);гидролиз по аниону (в реакцию с водой вступает только анион);
совместный гидролиз по катиону и по аниону (в реакцию с водой вступает и катион, и анион);
Слайд 5Алгоритм написания уравнений гидролиза
1. Определяем тип гидролиза (сильное пересиливает
слабое)
2. Пишем ионное уравнение гидролиза, определяем среду
3. Составляем молекулярное уравнение.
Вторая
и каждая следующая ступень гидролиза протекает в тысячи раз слабее, чем предыдущая.Даже первая ступень протекает обычно на доли процента. Поэтому, как правило, рассматривается только первая ступень гидролиза.
Слайд 6I тип. Гидролиз соли, образованной сильным основанием и сильной кислотой
Na2SO4
NaOH
(сильное основание)
H2SO4 (сильная кислота)
Гидролиз не идёт
Слайд 7II тип. Гидролиз соли, образованной сильным основанием и слабой кислотой
Na2CO3
NaOH
(сильное основание)
H2CO3 (слабая кислота)
Гидролиз идёт по аниону
1 ступень:
м.у. Na2CO3 +
HOH =п.и.у. 2Na+ + CO32– + H+OH– = HCO3– + 2Na+ + OH–
с.и.у. CO32– + H+OH– = HCO3– + OH–
pH>7 (среда щелочная)
2 ступень:
м.у. NaHCO3 + HOH =
п.и.у. Na+ + HCO3– + H+OH– = H2O + CO2↑ + Na+ + OH–
с.и.у. HCO32– + H+OH– = H2O + CO2↑ + OH–
pH>7 (среда щелочная)
NaHCO3 + NaOH
H2O + CO2↑ + NaOH
Слайд 8III тип. Гидролиз соли, образованной слабым основанием и сильной кислотой
ZnCl2
Zn(OH)2
(слабое основание)
HCl (сильная кислота)
Гидролиз идёт по катиону
1 ступень:
м.у. ZnCl2 +
HOH =ZnOHCl + HCl
п.и.у. Zn2+ + 2Cl– + H+OH– = ZnOH+ + 2Cl – + H+
c.и.у. Zn2+ + H+OH– = ZnOH+ + H+
pH<7 (среда кислая)
2 ступень:
м.у. ZnOHCl + HOH =
Zn(OH)2 ↓+ HCl
п.и.у. ZnOH+ + Cl– + H+OH– = Zn(OH)2↓ + Cl – + H+
c.и.у. ZnOH+ + H+OH– = Zn(OH)2↓ + H+
pH<7 (среда кислая)
Слайд 9IV тип. Гидролиз соли, образованной слабым основанием и слабой кислотой
Al2S3
Al(OH)3(слабое
основание)
H2S (слабая кислота)
Гидролиз идёт по катиону и по аниону
1 ступень:
м.у.
Al2S3 + 6HOH =2Al(OH)3 ↓+ 3H2S
п.и.у. 2Al3+ + 3S2– + 6H+OH– = 2Al(OH)3 ↓+ 3H2S↑
c.и.у. 2Al3+ + 3S2– + 6H+OH– = 2Al(OH)3 ↓+ 3H2S↑
pH=7 (среда нейтральная)
Гидролиз - процесс обратимый.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота
Слайд 10Факторы, влияющие на степень гидролиза.
Температура. Поскольку реакция гидролиза эндотермическая, то повышение
температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Концентрация продуктов
гидролиза. В соответствии с принципом Ле Шателье.Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается. Понять это помогает константа равновесия.
Разбавление. Этот фактор означает одновременное уменьшение концентрации всех частиц в растворе (не считая воды). В соответствии с принципом Ле Шателье, такое воздействие приводит к смещению равновесия в сторону реакции, идущей с увеличением числа частиц. Реакция гидролиза протекает (без учета воды!) с увеличением числа частиц. Следовательно при разбавлении равновесие смещается в сторону протекания этой реакции, вправо, степень гидролиза возрастает.
Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции.
Слайд 11Практическое применение.
На практике с гидролизом приходится сталкиваться, например при приготовлении
растворов гидролизующихся солей (ацетат свинца, например).
Обычная “методика”: в колбу
наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза.
Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной.
В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Слайд 12Задание 1. Фенолфталеин можно использовать для обнаружения в водном растворе
соли:
1) ацетата алюминия 2) нитрата калия
3) сульфата алюминия 4) силиката натрия.
Задание 2.
Установите соответствие между условиями и состоянием химического равновесия процесса гидролиза солей.Задание 3. Установите соответствие между названиями солей и средой их растворов.
Слайд 13Задание 5. Запишите уравнения гидролиза солей и определите среду водных
растворов (рН) и тип гидролиза:
Na2SiO3 , AlCl3, K2S.
Задание 4. Установите соответствие
между формулой соли и способностью этой соли к гидролизу.Слайд 14Домашнее задание:
Составьте уравнения гидролиза, определите тип гидролиза и среду водного
раствора соли для следующих веществ:
Сульфид калия - K2S,
Бромид алюминия
- AlBr3, Хлорид лития – LiCl,
Фосфат натрия - Na3PO4,
Сульфат калия - K2SO4,
Хлорид цинка - ZnCl2,
Сульфит натрия - Na2SO3,
Cульфат аммония - (NH4)2SO4,
Бромид бария - BaBr2 .