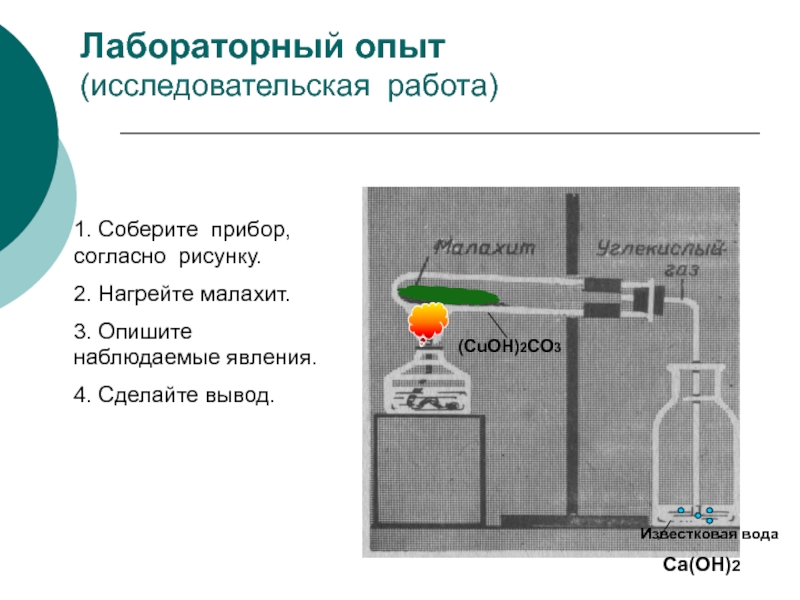
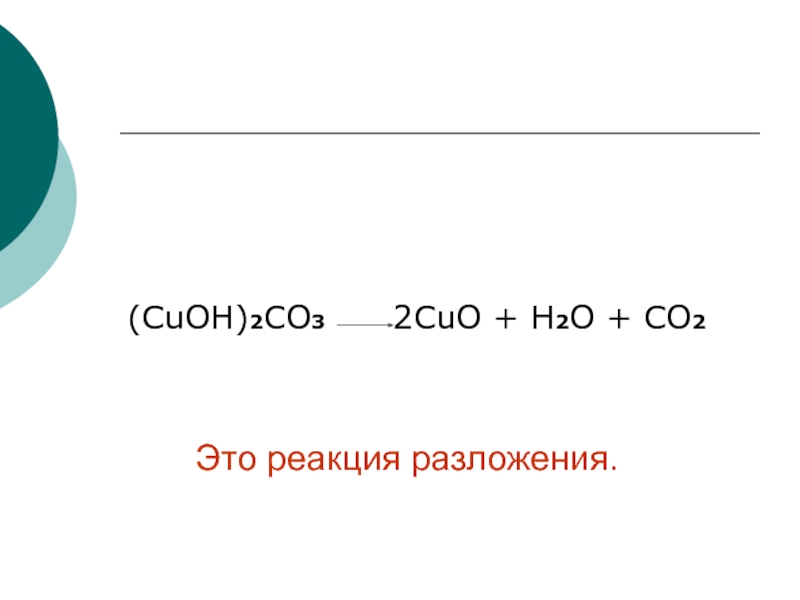
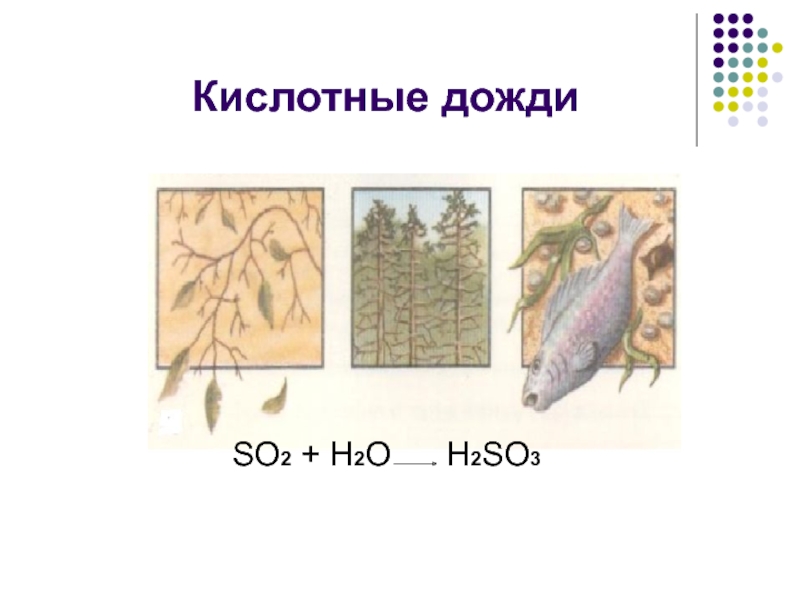
кислота
Соляная кислота
Азотная кислота
Ортофосфорная кислота
Хлорид кальция
Метакремневая кислота
Нитрат магния
Иодоводородная
кислота Ортофосфат калия
Азотистая кислота
Гидроксид меди (II)