Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические свойства карбоновых кислот 10 класс
Содержание
- 1. Химические свойства карбоновых кислот 10 класс
- 2. Эпиграф урока:Опыт и наблюдение - таковы величайшие источники мудрости, доступ к которым открыт для каждого человека. (Чаннинг)
- 3. состав и строение, классификация номенклатура способы
- 4. Химические свойства карбоновых кислот
- 5. Задачи урока: исследовать химические свойства карбоновых
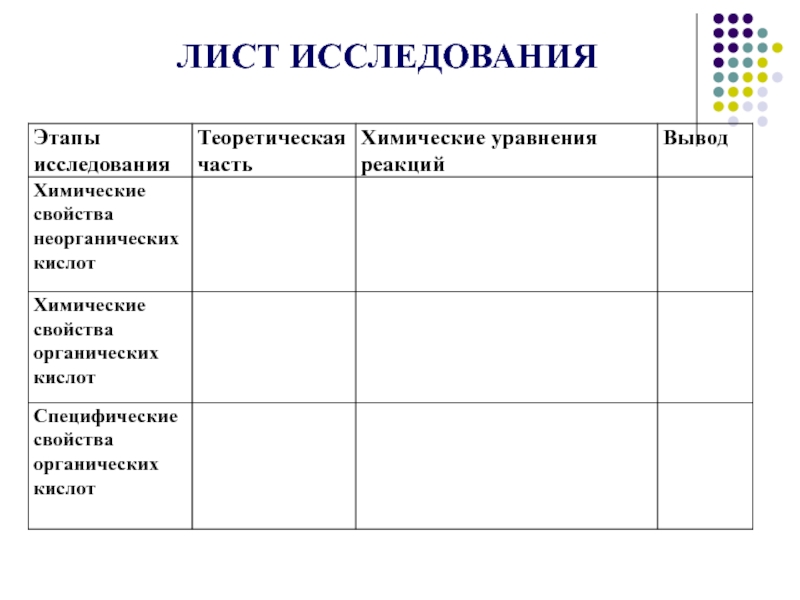
- 6. ЛИСТ ИССЛЕДОВАНИЯ
- 7. Химические свойства кислот
- 8. 2HCl + CaO = CaCl2
- 9. Взаимодействие кислот с гидроксидами: 2HCl + Cu(OH)2
- 10. Специфические свойства карбоновых кислот. Взаимодействие карбоновых кислот
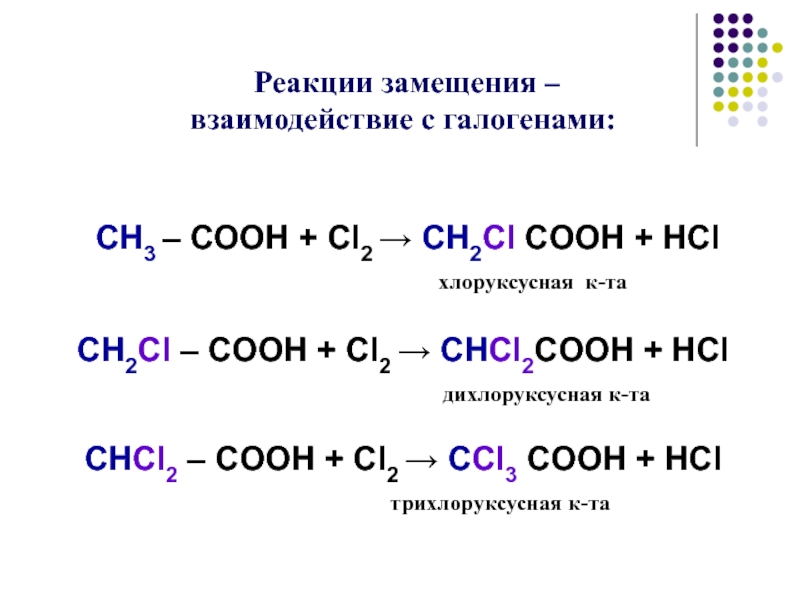
- 11. Реакции замещения – взаимодействие с галогенами:
- 12. Индивидуальные свойства Реакция «серебряного зеркала» для муравьиной
- 13. Выводы:карбоновые кислоты являются слабыми электролитами, а потому
- 14. Слайд 14
- 15. Вариант 2 г б б, в а гВариант 1 в а, г б г гТестирование
- 16. домашнее заданиеУчебник Рудзитис Г.Е., Фельдман 10 класс§ 26 № 5,7
- 17. Скачать презентанцию
Эпиграф урока:Опыт и наблюдение - таковы величайшие источники мудрости, доступ к которым открыт для каждого человека. (Чаннинг)
Слайды и текст этой презентации
Слайд 2Эпиграф урока:
Опыт и наблюдение - таковы величайшие источники мудрости,
доступ
к которым открыт для каждого человека.
(Чаннинг)
Слайд 3 состав и строение,
классификация
номенклатура
способы получения
физические свойства
химические свойства
применение
План изучения предельных
одноосновных
карбоновых кислотСлайд 5 Задачи урока:
исследовать химические свойства карбоновых кислот.
развивать умения
проводить лабораторный эксперимент.
научиться выделять существенные признаки и свойства объектов.
классифицировать факты, делать выводы.Слайд 7Химические свойства кислот
Диссоциация кислот
HCl ↔ Сl-
+ Н+
СН3 − СООН ↔ СН3 – СОО- + Н+
Взаимодействие
с металлами, стоящими в ряду напряжений до водорода:
2HCl + Zn = ZnCl2 + H2↑
2 СН3 СООН + Zn → (CH3COO)2 Zn + H2↑
уксусная кислота ацетат цинка
Слайд 8
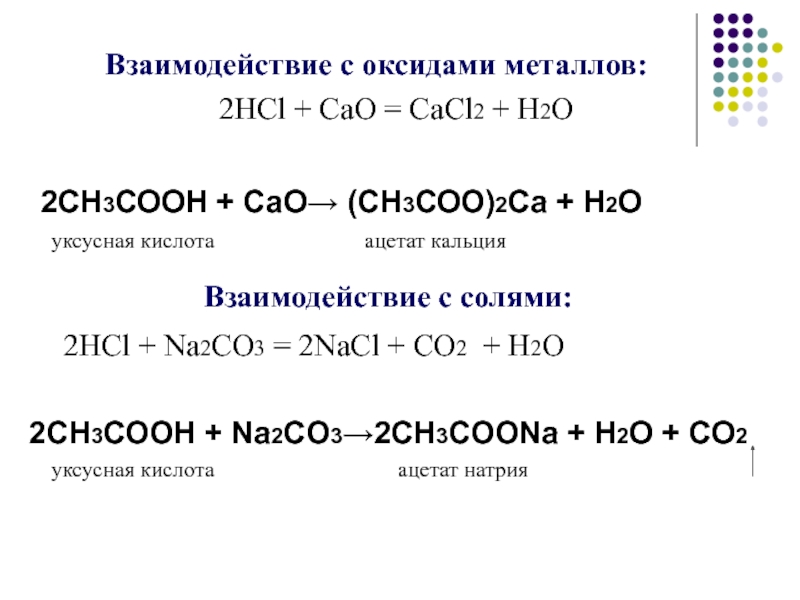
2HCl + CaO = CaCl2 + H2O
2СН3СООН + СаО→ (СН3СОО)2Са + Н2О
уксусная
кислота ацетат кальция
Взаимодействие с солями:
2HCl + Na2CO3 = 2NaCl + CO2 + H2O
2СН3СООН + Na2CO3→2CH3COONа + Н2О + CO2
уксусная кислота ацетат натрия
Взаимодействие с оксидами металлов:
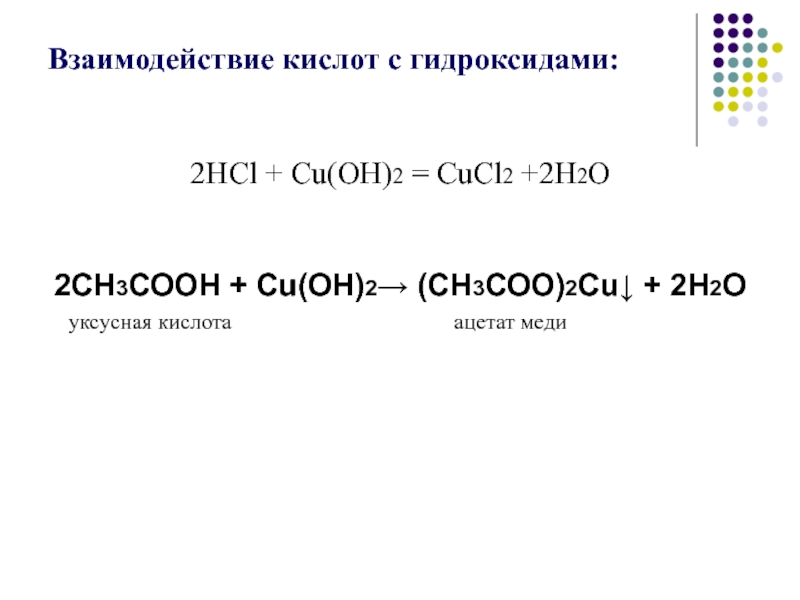
Слайд 9Взаимодействие кислот с гидроксидами:
2HCl + Cu(OH)2 = CuCl2 +2H2O
2СН3СООН
+ Сu(OH)2→ (СН3СОО)2Сu↓ + 2Н2О
уксусная кислота
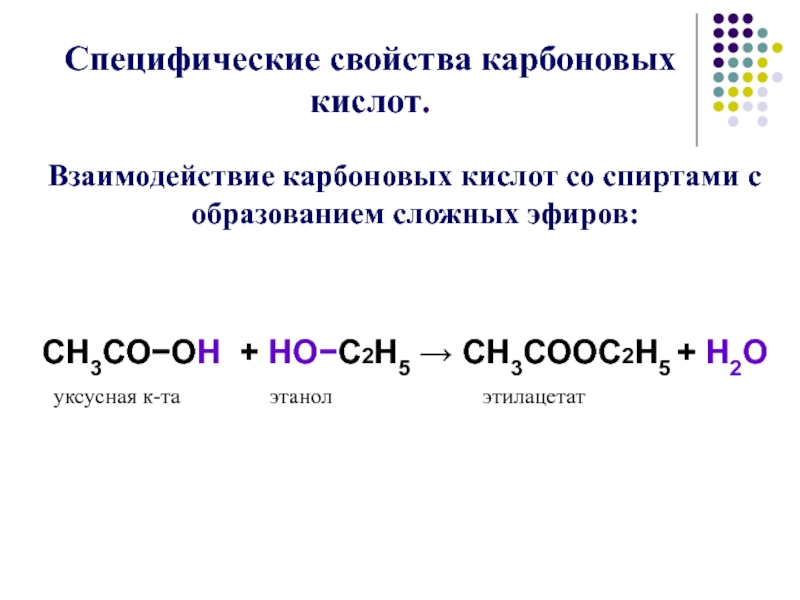
ацетат медиСлайд 10Специфические свойства карбоновых кислот.
Взаимодействие карбоновых кислот со спиртами с
образованием сложных эфиров:
СН3СО−ОН + НО−С2Н5 → СН3СООС2Н5 +
Н2О уксусная к-та этанол этилацетат Слайд 11 Реакции замещения –
взаимодействие с галогенами:
СН3 – СООН
+ Cl2 → CH2Cl COOH + HCl
хлоруксусная к-та CH2Cl – COOH + Cl2 → CHCl2COOH + HCl дихлоруксусная к-та CHCl2 – COOH + Cl2 → CCl3 COOH + HCl трихлоруксусная к-таСлайд 12Индивидуальные свойства
Реакция «серебряного зеркала» для муравьиной кислоты:
Н−СООН + Ag2O NH3, H2O HO−COOH + 2Ag↓
Муравьиная к-та угольная кислота
Слайд 13Выводы:
карбоновые кислоты являются слабыми электролитами, а потому диссоциируют.
для предельных одноосновных
карбоновых кислот характерны такие же свойства, что и для неорганических
кислот.предельные одноосновные карбоновые кислоты вступают и в такие реакции, которые не характерны для неорганических кислот.