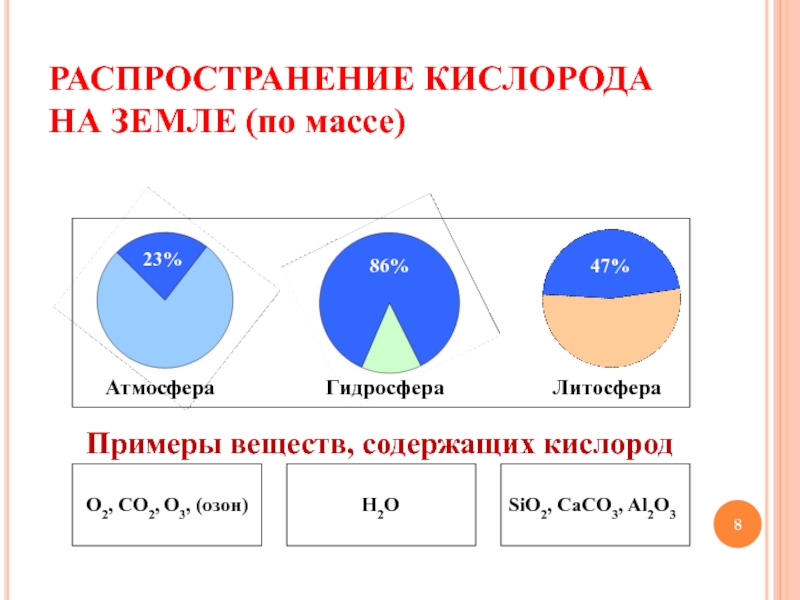
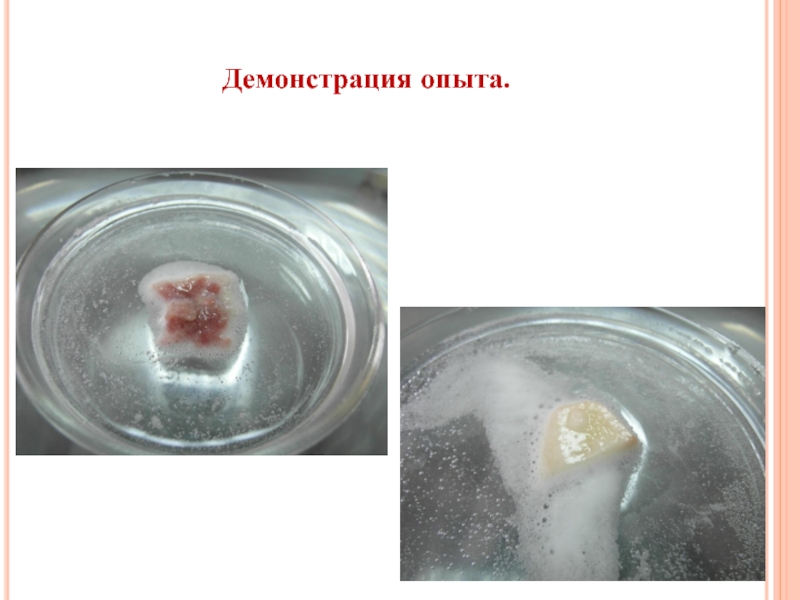
КИСЛОРОДА. ПОНЯТИЕ О КАТАЛИЗАТОРАХ»
Презентацию подготовили:
Е.Б.ПАВЛОВА,
Т.Н.АНДРЕЕВА,
учителя химии
средней школы № 46,
г. Воронеж«Химия – Первое сентября», май, 2013
pptcloud.ru