Слайд 2Координационная теория А.Вернера
В 1893 г. швейцарским химиком-неоргаником Альфредом Вернером
(1866–1919) была сформулирована теория, позволившая понять строение и некоторые свойства
комплексных соединений и названная координационной теорией. Поэтому комплексные соединения часто называют координационными соединениями.
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными.
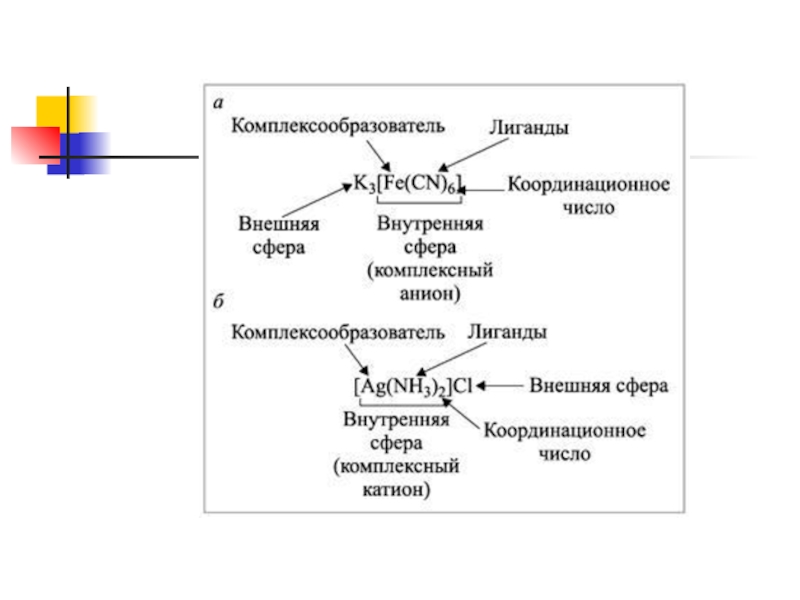
Слайд 3 Состав.
Согласно теории Вернера центральное положение в комплексных соединениях
занимает, как правило, ион металла, который называют центральным ионом, или
комплексообразователем.
Слайд 4Комплексообразователь – частица (атом, ион или молекула), координирующая (располагающая) вокруг себя другие
ионы или молекулы.
Слайд 5Комплексообразователь обычно имеет положительный заряд, является d-элементом, проявляет амфотерные свойства, имеет
координационное число 4 или 6. Вокруг комплексообразователя располагаются (координируются) молекулы
или кислотные остатки – лиганды (адденды).
Слайд 6Лиганды – частицы (молекулы и ионы), координируемые комплексообразователем и имеющие с ним
непосредственно химические связи (например, ионы: Cl–, I–, NO3–, OH–; нейтральные молекулы: NH3, H2O,
CO).
Слайд 7Лиганды не связаны друг с другом, так как между ними
действуют силы отталкивания. Когда лигандами являются молекулы, между ними возможно
молекулярное взаимодействие. Координация лигандов около комплексообразователя является характерной чертой комплексных соединений
Слайд 9Классификация
Большое многообразие комплексных соединений и их свойств не позволяет создать
единую классификацию. Однако можно группировать вещества по некоторым отдельным признакам.
Слайд 112) По типу координируемых лигандов.
а) Аквакомплексы – это комплексные катионы, в которых лигандами
являются молекулы H2O. Их образуют катионы металлов со степенью окисления
+2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз.
Примеры аквакомплексов:
[Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3.
Слайд 12б)Гидроксокомплексы – это комплексные анионы, в которых лигандами являются гидроксид-ионы OH–.
Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств – Be, Zn,
Al, Cr.
Например: Na[Al(OH)4], Ba[Zn(OH)4].
в) Аммиакаты – это комплексные катионы, в которых лигандами являются молекулы NH3. Комплексообразователями являются d-элементы.
Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
Слайд 13г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических
и органических кислот.
Например: K3[Al(C2O4)3], Na2[Zn(CN)4], K4[Fe(CN)6].
Слайд 15Номенклатура комплексных соединений
Наибольшее распространение имеет номенклатура, рекомендованная IUPAC. Название комплексного
аниона начинается с обозначения состава внутренней сферы: число лигандов обозначается греческими
числительными: 2–ди, 3–три, 4–тетра, 5–пента, 6–гекса и т.д., далее следуют названия лигандов, к которым прибавляют соединительную гласную «о»: Cl– – хлоро-, CN– – циано-, OH– – гидроксо- и т.п.
Слайд 16Если у комплексообразователя переменная степень окисления, то в скобках римскими
цифрами указывают его степень окисления, а его название с суффиксом
-ат: Zn – цинкат, Fe – феррат(III), Au – аурат(III). Последним называют катион внешней сферы в родительном падеже
Слайд 17Примеры:
K3[Fe(CN)6] – гексацианоферрат(III) калия,
K4[Fe(CN)6] – гексацианоферрат(II) калия,
K2[Zn(OH)4] – тетрагидроксоцинкат калия.
Слайд 18Например:
[Cu(NH3)4]SO4 – сульфат тетраамминмеди(II),
[Al(H2O)6]Cl3 – хлорид гексаакваалюминия.
Слайд 19Химические свойства комплексных соединений
1. В растворе комплексные соединения ведут себя
как сильные электролиты, т.е. полностью диссоциируют на катионы и анионы.
[Pt(NH3)4]Cl2 =
Pt(NH3)4] 2+ + 2Cl –,
K2[PtCl4] = 2K+ + [PtCl4] 2–
Слайд 202. При действии сильных кислот происходит разрушение гидроксокомплексов
а) при недостатке
кислоты
Na3[Al(OH)6] + 3HCl = 3NaCl + Al(OH)3 +
3H2O;
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 + 6H2O.
Слайд 213. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:
[Cu(NH3)4]SO4 = CuSO4 +
4NH3 .
Слайд 22Значение комплексных соединений
Координационные соединения имеют исключительно большое значение в
природе. Достаточно сказать, что почти все ферменты, многие гормоны, лекарства,
биологически активные вещества представляют собой комплексные соединения. Например, гемоглобин крови, благодаря которому осуществляется перенос кислорода от легких к клеткам ткани, является комплексным соединением, содержащим железо, а хлорофилл, ответственный за фотосинтез в растениях, – комплексным соединением магния.
Слайд 23
Значительную часть природных минералов, в том числе полиметаллических руд и
силикатов, также составляют координационные соединения. Более того, химические методы извлечения
металлов из руд, в частности меди, вольфрама, серебра, алюминия, платины, железа, золота и других, также связаны с образованием легкорастворимых, легкоплавких или летучих комплексов. Например: Na3[AlF6] – криолит, KNa3[AlSiO4]4 – нефелин (минералы, комплексные соединения, содержащие алюминий).
Слайд 24Современная химическая отрасль промышленности широко использует координационные соединения как катализаторы
при синтезе высокомолекулярных соединений, при химической переработке нефти, в производстве
кислот.
Слайд 25Задания.
Письменно дать характеристику следующим комплексным соединениям по строению и классифицировать
по признакам:
K3[Cr(OH)6], [Cr(H2O)6](NO3)3, Na2[Zn(CN)4], [Ag(NH3)2]OH.
Слайд 26Написать уравнения реакций, при помощи которых можно осуществить превращения:











![Комплексные соединения г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот.Например: K3[Al(C2O4)3], Na2[Zn(CN)4], K4[Fe(CN)6]. г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот.Например: K3[Al(C2O4)3], Na2[Zn(CN)4], K4[Fe(CN)6].](/img/thumbs/a03ad12d5208168709b060f5e57eb96b-800x.jpg)



![Комплексные соединения Примеры:K3[Fe(CN)6] – гексацианоферрат(III) калия,K4[Fe(CN)6] – гексацианоферрат(II) калия,K2[Zn(OH)4] – тетрагидроксоцинкат калия. Примеры:K3[Fe(CN)6] – гексацианоферрат(III) калия,K4[Fe(CN)6] – гексацианоферрат(II) калия,K2[Zn(OH)4] – тетрагидроксоцинкат калия.](/img/thumbs/91b1e045a93cf6b6d4b15a20a3a08a5c-800x.jpg)
![Комплексные соединения Например:[Cu(NH3)4]SO4 – сульфат тетраамминмеди(II),[Al(H2O)6]Cl3 – хлорид гексаакваалюминия. Например:[Cu(NH3)4]SO4 – сульфат тетраамминмеди(II),[Al(H2O)6]Cl3 – хлорид гексаакваалюминия.](/img/thumbs/b53d870420da08b130bdbdb9e70cf152-800x.jpg)

![Комплексные соединения 2. При действии сильных кислот происходит разрушение гидроксокомплексов а) при недостатке кислоты 2. При действии сильных кислот происходит разрушение гидроксокомплексов а) при недостатке кислоты Na3[Al(OH)6] + 3HCl = 3NaCl](/img/thumbs/15abc6c67f24164a03a9c0f15d1a7066-800x.jpg)
![Комплексные соединения 3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:[Cu(NH3)4]SO4 = CuSO4 + 4NH3 . 3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:[Cu(NH3)4]SO4 = CuSO4 + 4NH3 .](/img/thumbs/67a29ba6cd487d54f24b9f428075fbdb-800x.jpg)



![Комплексные соединения Задания.Письменно дать характеристику следующим комплексным соединениям по строению и классифицировать по признакам: K3[Cr(OH)6], [Cr(H2O)6](NO3)3, Na2[Zn(CN)4], [Ag(NH3)2]OH. Задания.Письменно дать характеристику следующим комплексным соединениям по строению и классифицировать по признакам: K3[Cr(OH)6], [Cr(H2O)6](NO3)3, Na2[Zn(CN)4],](/img/thumbs/99a1ef34bc4e4ae271d4a124013c1b5d-800x.jpg)




















