кристалла кварца и горного хрусталя
на его основе создано промышленное производство
керамики, стекла, цемента полупроводник
∗ по распространению в земной коре занимает 2-е место после кислорода (26 %) В природе встречается в виде оксидов, силикатов и алюмосиликатов
∗ его оксиды являются основной частью песка и глины



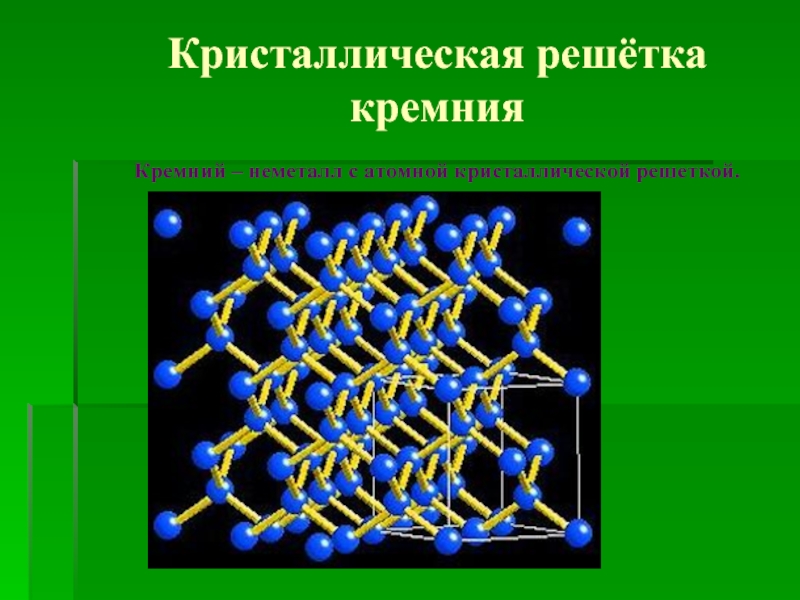
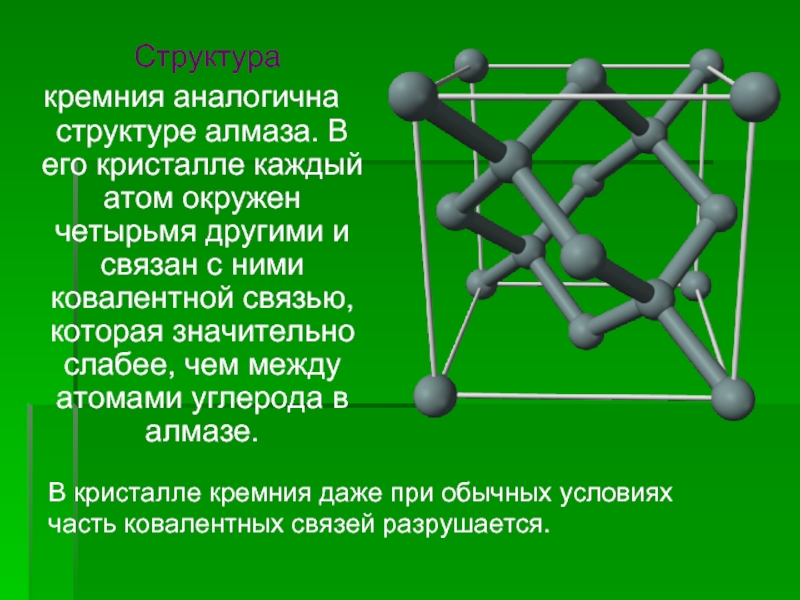
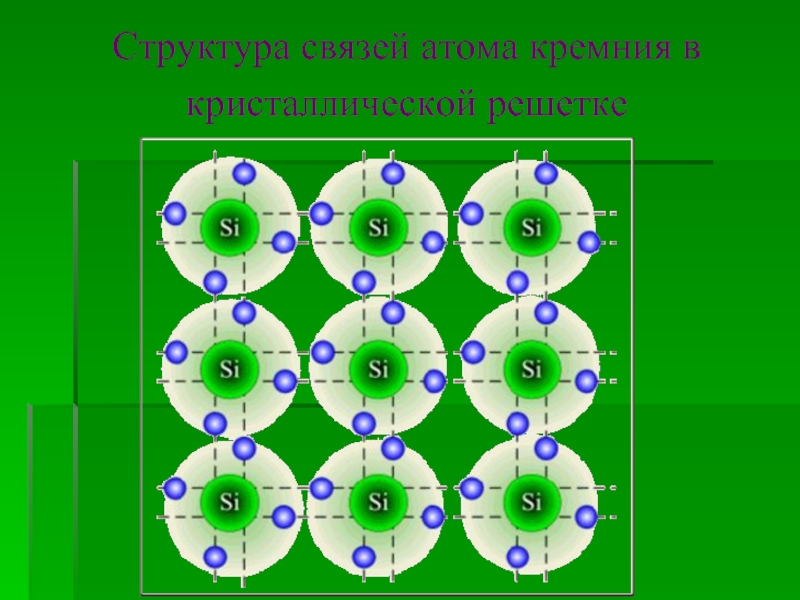
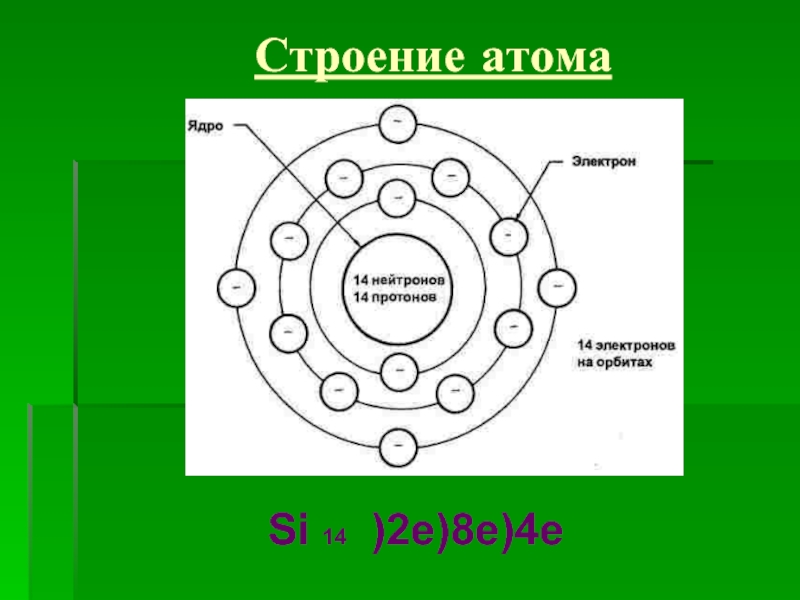







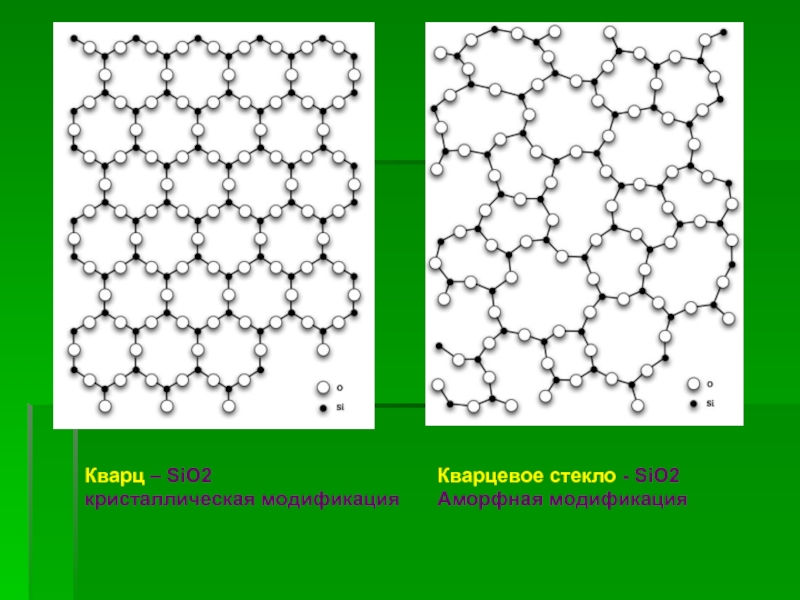
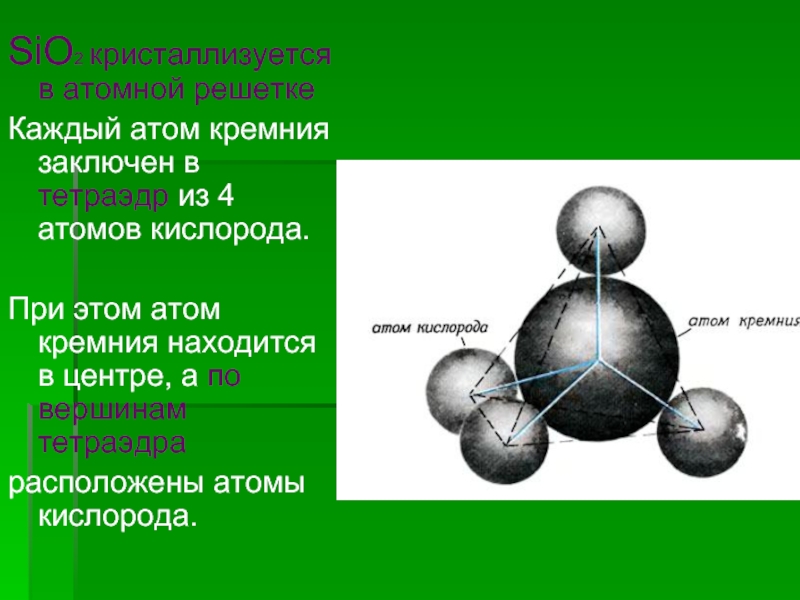





![Кремний и его соединения СиликатыСиликаты – химические соединения, содержащие кремнекислотные остатки различного состава [SinOm]. Основа СиликатыСиликаты – химические соединения, содержащие кремнекислотные остатки различного состава [SinOm]. Основа всех силикатов - кремнекислородный тетраэдр [SiO4],](/img/thumbs/87cbe5ebe2003eb15517f5f5ab700d46-800x.jpg)