Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молярный объем газов
Содержание
- 1. Молярный объем газов
- 2. Цель урока: Сформировать понятие о молярном объеме газов.
- 3. М (н2о) =
- 4. М (н2о) =
- 5. V (н2о) = 18 /1 = 18 мл/моль
- 6. М (CuO) =
- 7. Закон Авогадро (Амедео Авогадро, итал. в
- 8. нормальные условия: (t = 0 °С, P = 1 атм)
- 9. Объем можно вычислить, если известна
- 10. Слайд 10
- 11. VM = 22,4 л/моль
- 12. V = n * VM
- 13. V = n * VM
- 14. Слайд 14
- 15. Слайд 15
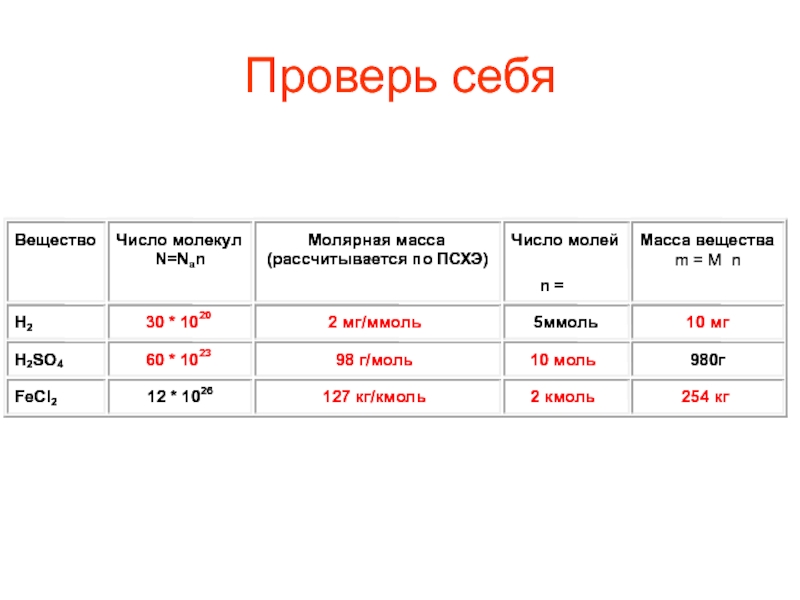
- 16. Проверь себя
- 17. Скачать презентанцию
Цель урока: Сформировать понятие о молярном объеме газов. Научиться производить расчеты, используя закон Авогадро и следствие из него
Слайды и текст этой презентации
Слайд 1Молярный объем газов Презентация к уроку химии Учителя химии и биологии МБОУ СОЩ
№36 г.о. Самара
Черновой Натальи Александровны
Слайд 2Цель урока: Сформировать понятие о молярном объеме газов. Научиться производить расчеты,
используя закон Авогадро и следствие из него
Слайд 7 Закон Авогадро (Амедео Авогадро, итал. в 1811г ) В равных объемах
различных газов содержится одинаковое число молекул (при н. у.)
Слайд 9 Объем можно вычислить, если известна
масса 1 л газа. Например, при н.у. : I.
масса 1 л водорода равна 0,09 г, (плотность 0,09 г/л); М(Н2) = 2,016 г/моль. II. масса 1 л кислорода равна 1,429 г, (плотность 1,429 г/л); М(О2) = 32 г/моль
Слайд 14
Решите задачи Iвариант: Задача
1. Рассчитайте, какой объем занимают 5 моль аммиака (н. у.). Задача 2. Рассчитайте, какой объем при нормальных условиях займет оксид углерода (IV) массой 5,6 г. IIвариант: Задача 1. Какое количество вещества оксида азота (II) заключено в объеме 448 л? Задача 2. Определите массу 5 л аммиака (н.у.)