Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
"Назад в будущее"
Содержание
- 1. "Назад в будущее"
- 2. 1945 ГОД 2015 ГОД
- 3. Типы химических реакций
- 4. Цель урока: повторить классификацию веществ, рассмотреть типы
- 5. Маршрутный лист- Собери рюкзак-Химическая железная дорога-Взятие высоты-Шифровка-Переправа-Привал-Путь домой
- 6. Собери рюкзак
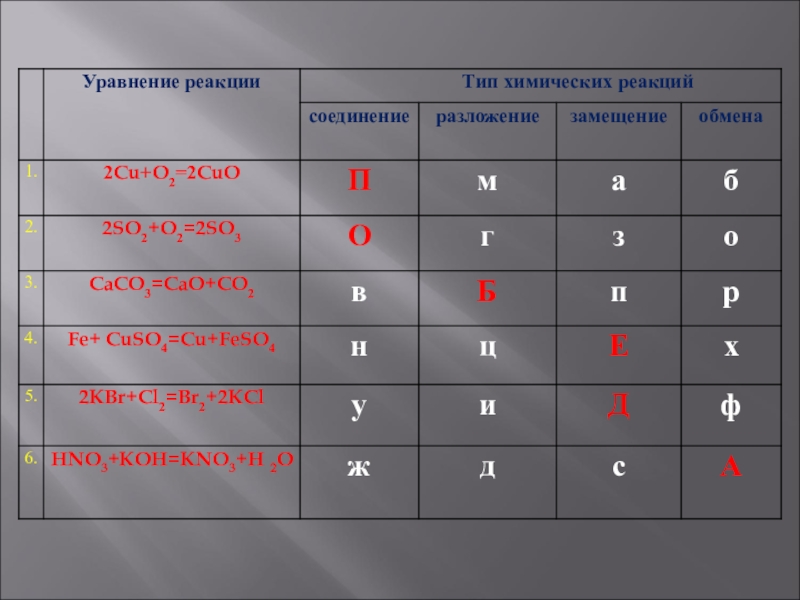
- 7. ХИМИЧЕСКАЯ ЖЕЛЕЗНАЯ ДОРОГА
- 8. Запишите формулы веществ в соответствующие столбцы таблицы:
- 9. Взятие высоты
- 10. Слайд 10
- 11. Слайд 11
- 12. Шифровка
- 13. Шифровка № 1Шифровка № 2584636542Ba + O2
- 14. Переправа
- 15. Слайд 15
- 16. Привал
- 17. Лабораторная работа «Признаки химических реакций».1) Лабораторный опыт
- 18. Путь домой
- 19. 1. Реакции, протекающие с поглощением теплоты, называются:а) эндотермическими;б) термическими;в) экзотермическими.2.
- 20. 3. Уравнение реакции обмена:а) СаО + SiC2 —
- 21. 1945 - 2015 год
- 22. Сегодня я понял, что..., Теперь я…, Хочу, чтобы ...
- 23. Спасибо за работу! До новых встреч!
- 24. Учитель химии МБОУСОШ № 32Степахина Н.Ф.«Назад в будущее»Типы химических реакций
- 25. Скачать презентанцию
1945 ГОД 2015 ГОД
Слайды и текст этой презентации
Слайд 5Маршрутный лист
- Собери рюкзак
-Химическая железная дорога
-Взятие высоты
-Шифровка
-Переправа
-Привал
-Путь домой
Слайд 8Запишите формулы веществ в соответствующие столбцы таблицы: H2, Na2S, Al,
CuCl2, Mg, KI, S, Ca(OH)2, O3, FeBr3
Слайд 13Шифровка № 1
Шифровка № 2
5
8
4
6
3
6
5
4
2Ba + O2 → 2BaO
Fe(OH)3+3HCl →FeCl3+
3H2O
2Na + S → Na2S
3Fe + 2O2 → Fe3O4
C +
O2 → CO22CH4 → C2H2 + 3H2
Ca + 2HCl → CaCl2 + H2
2K + S → K2S
Слайд 17Лабораторная работа
«Признаки химических реакций».
1) Лабораторный опыт №1 «Выпадение осадка»
Na 2SO4+BaCl2
Наблюдаем………
2) Лабораторный опыт №2 «Выделение газа»
Na 2CO3+HCl
Наблюдаем……….
3)Лабораторный опыт №3 «Изменение цвета»
FeCl3 + KCNS
Наблюдаем…..
4)Лабораторный опыт №4 «Выделение
запаха»
Подожгите и потушите лучину
Наблюдаем…..
Слайд 191. Реакции, протекающие с поглощением теплоты, называются:
а) эндотермическими;
б) термическими;
в) экзотермическими.
2. Из нескольких простых
или сложных веществ образуется одно более сложное вещество в реакции:
а) замещения;
б) соединения;
в) разложения.
Слайд 20
3. Уравнение реакции обмена:
а) СаО + SiC2 — CaSiO3;
б) 2КС1О3 = 2КС1
+ 3О2;
в) FeS + 2НСl = FeCl2 + H2S.
4. Сумма всех
коэффициентов в уравнении реакции, схема которой А1 + С12 —► A1C13, равна:
а) 4;
б) 7;
в) 5.