Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Типы химических реакций
Содержание
- 1. Типы химических реакций
- 2. Смирнова Светлана ВитальевнаУчитель химии, педагог-психолог МОУ
- 3. Заполнение таблицы(по слайдам) Типы химических реакций
- 4. 1.по числу и составу исходных веществ и продуктов реакции№1
- 5. Реакции соединенияА+В = АВ2Fe +3Cl2 → 2FeCl3CaO + CO2→CaCO3Всегда получается только одно вещество!!!
- 6. Реакции разложения
- 7. Реакции замещенияA +BC = AC + BCu
- 8. Реакции обменаAB + CD = AD +
- 9. Определите тип реакции №1
- 10. 2.по выделению или поглощению энергии в ходе химической реакции
- 11. экзотермическиеA + B = AB +Q3Fe + 2O2 =Fe3O4 + QMg +O2 =2MgO +Q Осторожно!!!Не обожгитесь!!!
- 12. эндотермическиеAB ➔ A + B –Q
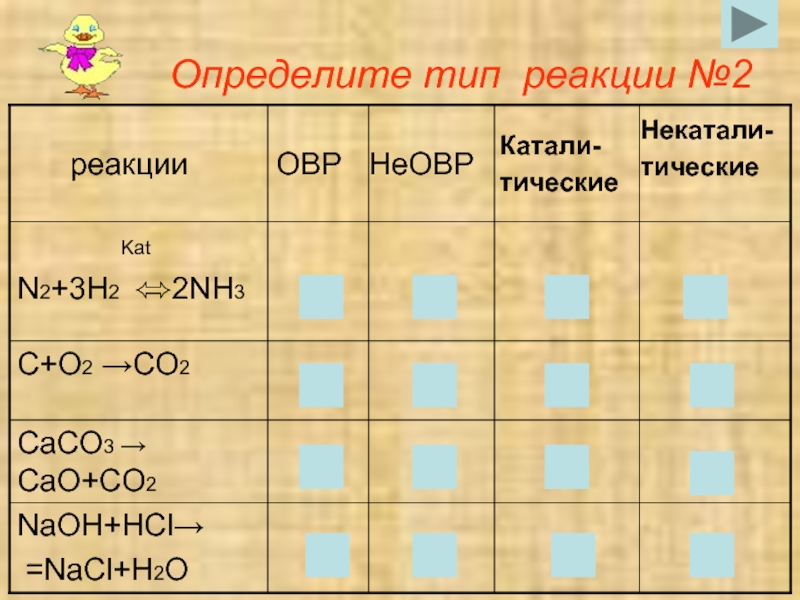
- 13. 3.по изменению степени окисления№2
- 14. Окислительно-восстановительные Cu0 +4HN+5O3= =Cu+2(NO3)2+2N+4O2++2H2OНеокислительно-восстановительные Fe+3Cl3 + 3Na+1OH= Fe+3(OH)3 +3Na+1OH
- 15. 4.по наличию катализатора№2
- 16. КАТАЛИТИЧЕСКИЕ
- 17. Определите тип реакции №2
- 18. 6.по фазовому составу веществ
- 19. Гомогенные(однофазные)N2(газ) +3H2(газ) =2NH3(газ)Гетерогенные (многофазные)Mg(тв.в) +2HCl(раствор) = =MgCl2(раствор) + H2(газ)
- 20. 5.по обратимости химической реакции
- 21. Признаки необратимости реакцийРеакция идёт с выделением большого
- 22. Обратимые и необратимые реакцииN2+3H2 ⬄NH3обратимаяНеобратимая(тепло)Необратимая(осадок)Необратимая(газ)
- 23. Ура!!! Приятно иметь дело с умными детьми! Ты ответилправильно!№1№2
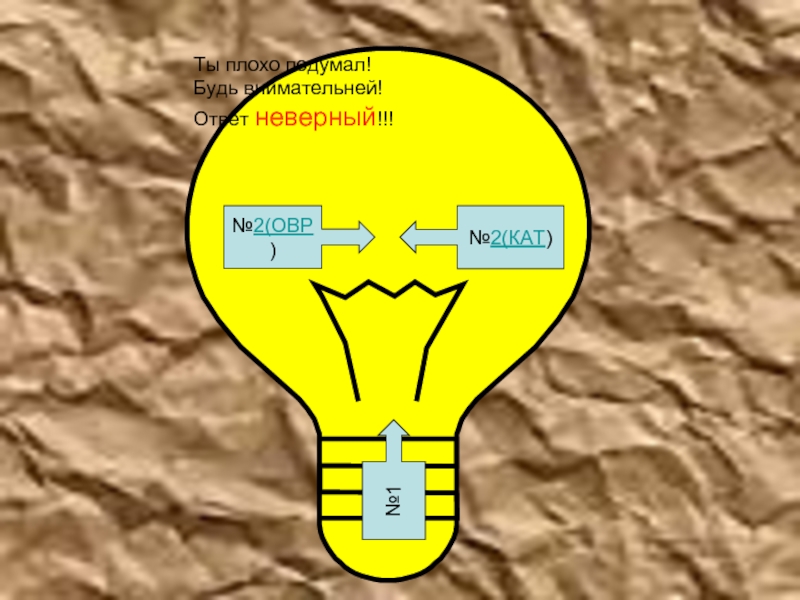
- 24. Ты плохо подумал!Будь внимательней!Ответ неверный!!!№1№2(КАТ)№2(ОВР)
- 25. Надеюсь, Вы теперь различаете реакции по типам!
- 26. Скачать презентанцию
Смирнова Светлана ВитальевнаУчитель химии, педагог-психолог МОУ СОШ №2 г.Андреаполя Тверской областиВысшая квалификационная категорияПедагогический стаж 17 летСоросовский учитель 2000 годаПризер районного этапа конкурса «Учитель года 2002»
Слайды и текст этой презентации
Слайд 2Смирнова Светлана Витальевна
Учитель химии,
педагог-психолог МОУ СОШ №2 г.Андреаполя
Тверской области
районного этапа конкурса «Учитель года 2002»Слайд 5Реакции соединения
А+В = АВ
2Fe +3Cl2 → 2FeCl3
CaO + CO2→CaCO3
Всегда получается
только одно вещество!!!
Слайд 6Реакции разложения
AB → A+B
2HgO = 2Hg + O2
2KClO3→ 2KCl + 3O2
2H2O→2H2+ O2
ДА ТАК МОЖНО ПОЛУЧИТЬ КИСЛОРОД!!
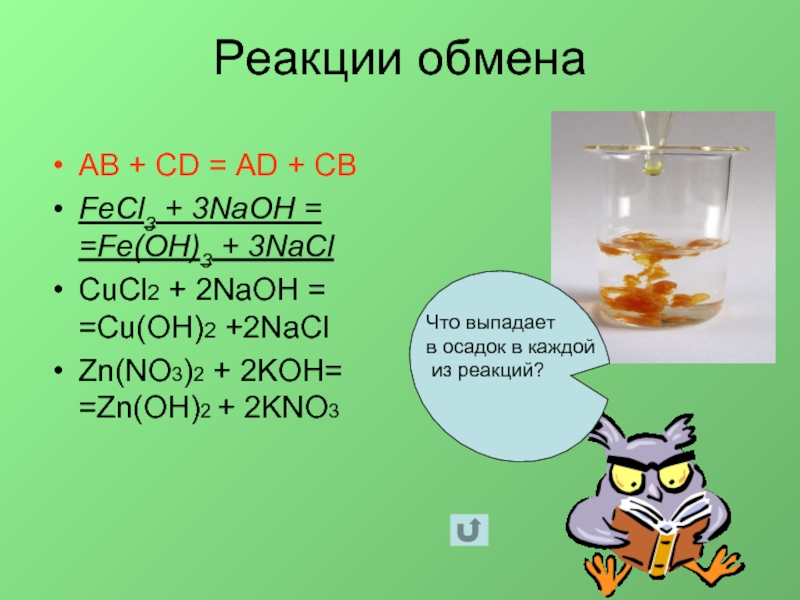
Слайд 8Реакции обмена
AB + CD = AD + CB
FeCl3 + 3NaOH
= =Fe(OH)3 + 3NaCl
CuCl2 + 2NaOH = =Cu(OH)2 +2NaCl
Zn(NO3)2
+ 2KOH= =Zn(OH)2 + 2KNO3Что выпадает
в осадок в каждой
из реакций?
Слайд 11экзотермические
A + B = AB +Q
3Fe + 2O2 =Fe3O4 +
Q
Mg +O2 =2MgO +Q
Осторожно!!!
Не обожгитесь!!!
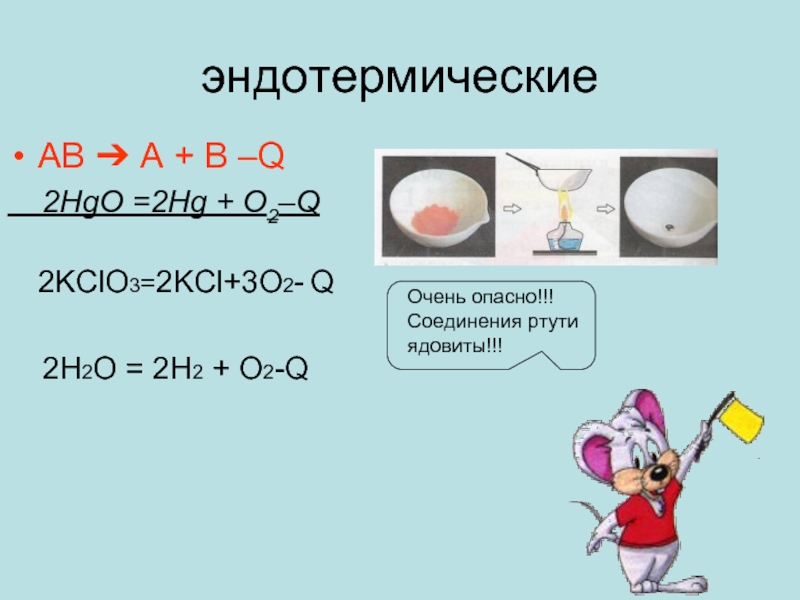
Слайд 12эндотермические
AB ➔ A + B –Q
2HgO =2Hg +
O2–Q
2KClO3=2KCl+3O2- Q2H2O = 2H2 + O2-Q
Очень опасно!!!
Соединения ртути ядовиты!!!
Слайд 14Окислительно-восстановительные
Cu0 +4HN+5O3= =Cu+2(NO3)2+2N+4O2++2H2O
Неокислительно-восстановительные
Fe+3Cl3 + 3Na+1OH= Fe+3(OH)3
+3Na+1OH
Слайд 19Гомогенные(однофазные)
N2(газ) +3H2(газ) =2NH3(газ)
Гетерогенные (многофазные)
Mg(тв.в) +2HCl(раствор) =
=MgCl2(раствор) + H2(газ)
Слайд 21Признаки необратимости реакций
Реакция идёт с выделением большого количества теплоты
Хотя бы
один продукт реакции покидает сферу реакции (выпадает в осадок
или выделяется в виде газа)В результате реакции образуются малодиссоциируемые вещества (например, вода)
Слайд 22Обратимые и необратимые реакции
N2+3H2 ⬄NH3
обратимая
Необратимая(тепло)
Необратимая(осадок)
Необратимая(газ)
Теги