Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неметаллы
Содержание
- 1. Неметаллы
- 2. Положение в ПСМНазовите неметаллыГде они располагаются в
- 3. Физические свойстваАгрегатное состояниеГазообразноеКислород, водородЖидкоеБром ТвердоеУглеродкремнийАморфноеКремнийсера
- 4. Чем объясняется разнообразие агрегатного состояния неметалловНаличие кристаллической
- 5. Физические свойстваНекоторые имеют металлический блескПроводят электрический токОбладают теплопроводностьюПластичностьНО , они хрупкие вещества
- 6. Аллотропия Способность элемента образовывать несколько простых веществПричина
- 7. Кислород О2 и Озон О3
- 8. Химические свойства неметалловОкислители: взаимодействуют с металламиВосстановители (
- 9. ЗАГАДКИОн повсюду и вездеВ камне , в
- 10. Тест На внешнем уровне у неметалловА) более
- 11. Водород Дайте характеристику водорода Газ без цвета
- 12. Получение водородаВ промышленности из углеводородов
- 13. Химические свойства водородаС металлами, образуя гидридыС неметаллами
- 14. Домашнее заданиеЗаписи в тетрадях Параграф 15,16,17
- 15. Скачать презентанцию
Положение в ПСМНазовите неметаллыГде они располагаются в таблице Менделеева?Как вы думаете, в таблице больше металлов или неметаллов?Назовите самые активные и сильные неметаллы
Слайды и текст этой презентации
Слайд 2Положение в ПСМ
Назовите неметаллы
Где они располагаются в таблице Менделеева?
Как вы
думаете, в таблице больше металлов или неметаллов?
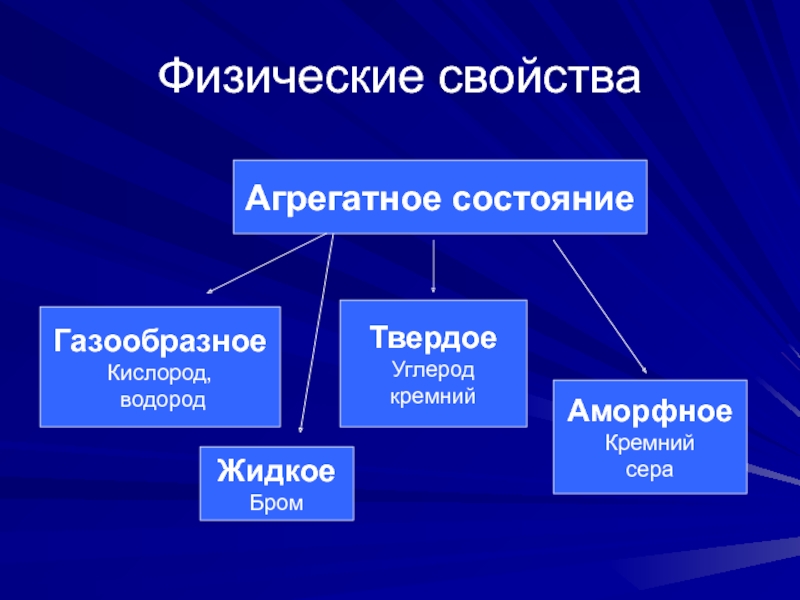
сильные неметаллыСлайд 3Физические свойства
Агрегатное состояние
Газообразное
Кислород,
водород
Жидкое
Бром
Твердое
Углерод
кремний
Аморфное
Кремний
сера
Слайд 4Чем объясняется разнообразие агрегатного состояния неметаллов
Наличие кристаллической решетки:
Атомные Молекулярные
бор сераалмаз йод
графит белый фосфор
Слайд 5Физические свойства
Некоторые имеют металлический блеск
Проводят электрический ток
Обладают теплопроводностью
Пластичность
НО , они
хрупкие вещества
Слайд 6Аллотропия
Способность элемента образовывать несколько простых веществ
Причина – различие в
строении кристаллической решетки, различный состав молекул.
Примеры:
Алмаз – графит ( крист.
Решетка)Красный фосфор – белый фосфор (строение молекулы Р2 и Р4)
Слайд 8Химические свойства неметаллов
Окислители: взаимодействуют с металлами
Восстановители ( кроме фтора, гелия,
неона) взаимодействуют друг с другом
Примечание : см.
РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ
НЕМЕТАЛЛОВ
Слайд 9ЗАГАДКИ
Он повсюду и везде
В камне , в воздухе, в воде
Он
и в утренней росе
И в небесной синеве
Если вдруг он когда
–то иссякнет, в недрах звезд весь сгорит без следа, во вселенной светило погаснет, и наступит здесь мрак навсегдаРодня большая у меня: кислоты, соли – всюду я. В составе пороха, друзья, большую часть составляю я
Из меня состоит все живое: я графит, антрацит и алмаз, я на улице , в школе и в поле, я в деревьях и в каждом из вас
Слайд 10Тест
На внешнем уровне у неметаллов
А) более 3 электронов
Б) менее
3 электронов
Агрегатное состояние неметаллов может быть:
А)газообразное
Б) жидкое
В) твердое
Г) аморфное
Разнообразие физических
свойств неметаллов объясняетсяа) они могут иметь атомную кристаллическую решетку
Б) молекулярную кристаллическую решетку
В) различие в количественном составе молекул
Многообразие простых веществ объясняется
А) аморфностью
Б) аллотропией
По химическим свойствам неметаллы могут быть
А) окислителями
Б) восстановителями
Слайд 11Водород
Дайте характеристику водорода
Газ без цвета и запаха, легче
воздуха, плохо растворим в воде, растворим в металлах: железе, свинце,
никелеПрименение: дирижабли, метеорологические зонды. Используется как восстановитель в металлургии и органическом синтезе, для получения аммиака, в качестве экологического топлива
Слайд 12Получение водорода
В промышленности из углеводородов
СН4 = С
+ 2Н2
Взаимодействием угля с водой
С + Н2О =
СО + Н2Метана с водой
СН4 + Н2О = СО + Н2
Электролизом воды
2Н2О = 2Н2 + О2
в лабораториях при взаимодействии цинка с кислотой
Слайд 13Химические свойства водорода
С металлами, образуя гидриды
С неметаллами
восстанавливает металлы
из оксидов
В смеси с фтором, кислородом, хлором – взрывоопасен
Допишите
уравнения реакций:H2 + S
H2+ O2
H2+ Cl2
H2+ N2