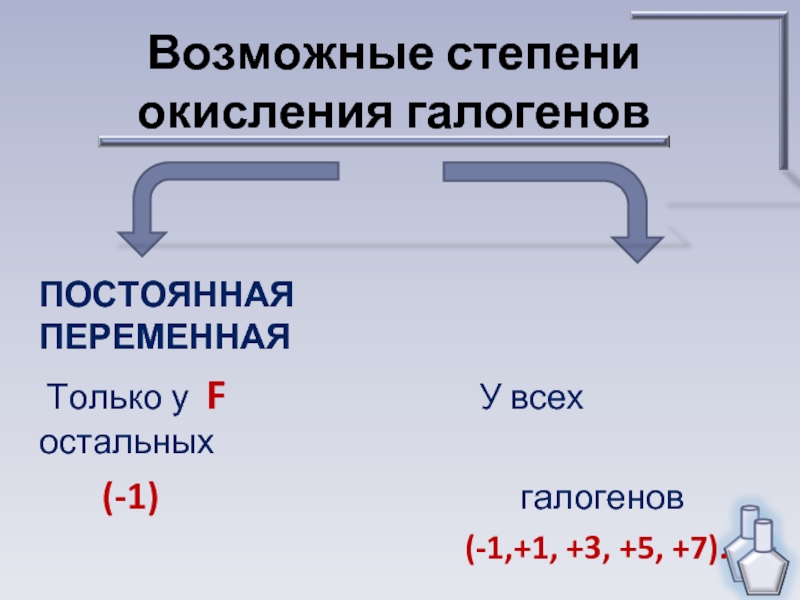
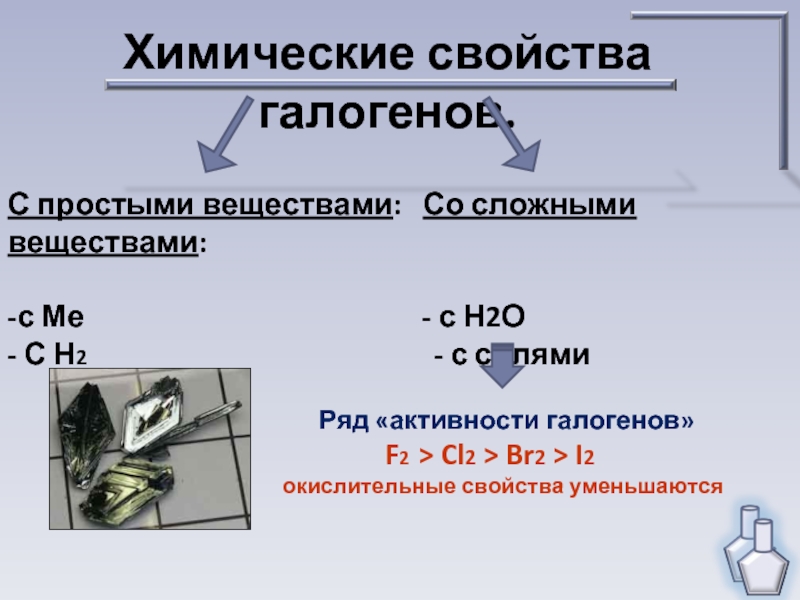
свойствами галогенов.
3.Повторить, обобщить и закрепить на материале химии галогенов химические
понятия, как «химическая связь», « кристаллические решетки», «окисление и восстановление».Оборудование:
ТСО, презентация, ПСХЭ, образцы галогенов, диск «Химия для всех».