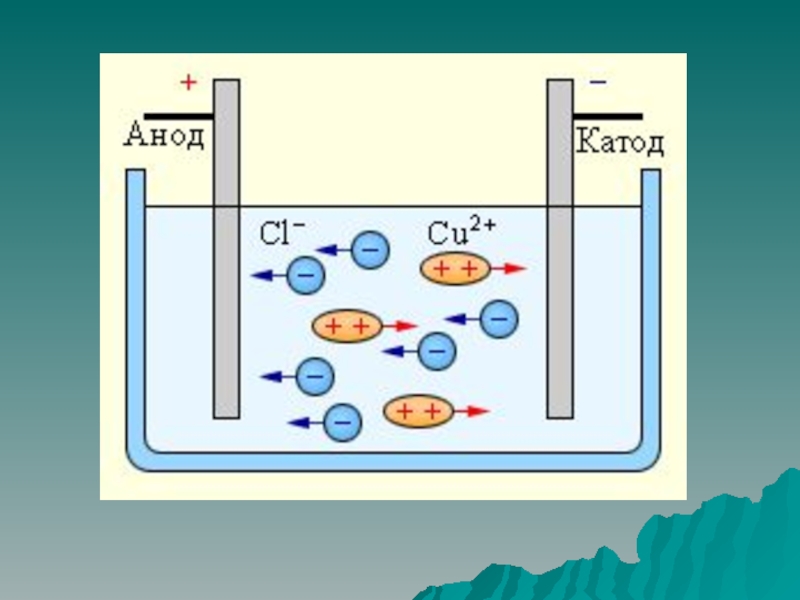
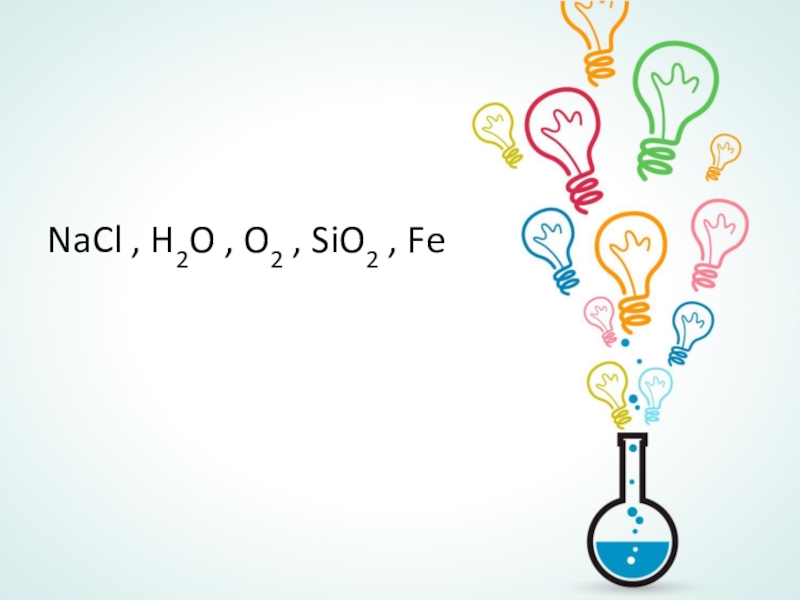
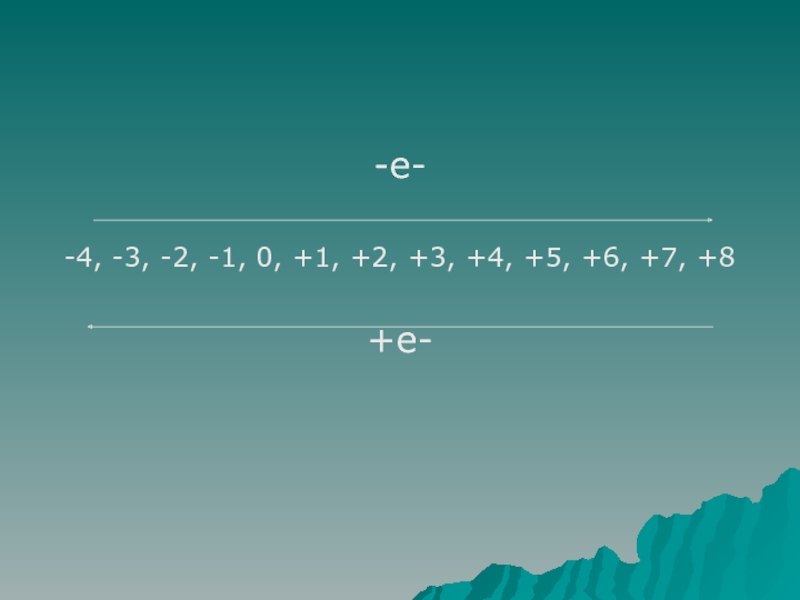восстановители. Ознакомить с методом составления уравнений окислительно-восстановительных реакций. (Метод электронного
баланс.) Влияние среды на протекание окислительно-восстановительных процессов.Воспитательные
Создать положительный настрой к обучению и готовность к активной мыслительной деятельности, используя видеоматериалы и метод демонстрационного эксперимента; воспитывать культуру речи и труда.
Развивающие
Развивать у учащихся познавательный интерес к изучению химии, умение анализировать, сравнивать, делать выводы, самостоятельность учащихся. (ОК 3.: Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность)