Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Водород, его общая характеристика, нахождение в природе и получение
Содержание
- 1. Водород, его общая характеристика, нахождение в природе и получение
- 2. История открытияАнглийский физик и химик Г. Кавендиш
- 3. Визитная карточкахимический элемент с атомным номером 1;
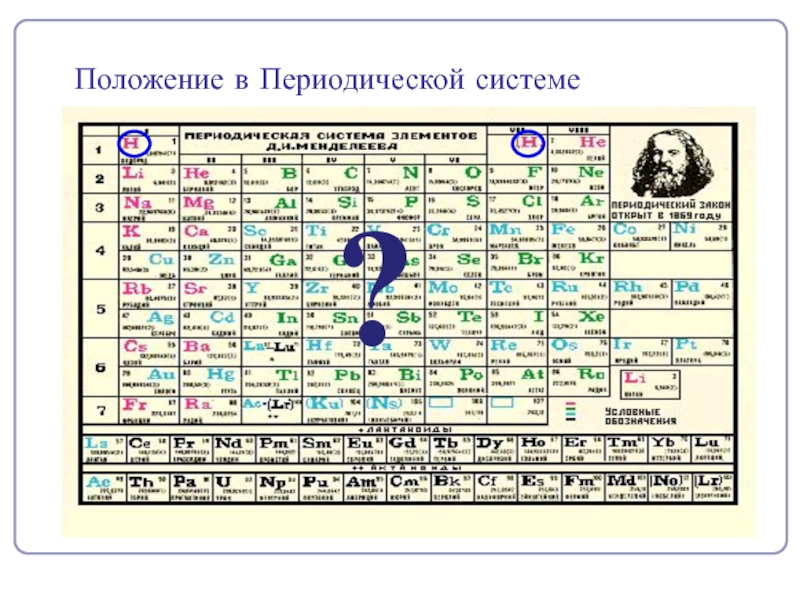
- 4. Положение в Периодической системе?
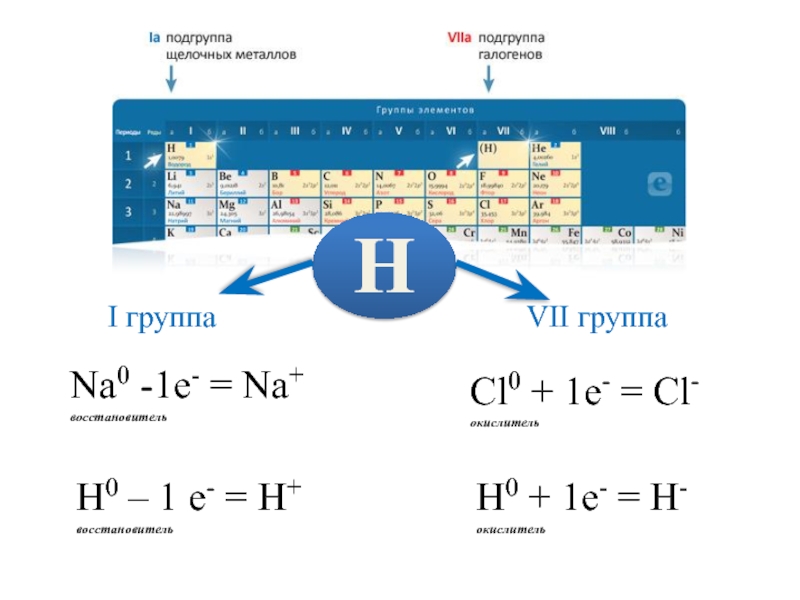
- 5. Na0 -1e- = Na+восстановительН0 – 1 е-
- 6. Нахождение в природеВодород – самый распространённый элемент
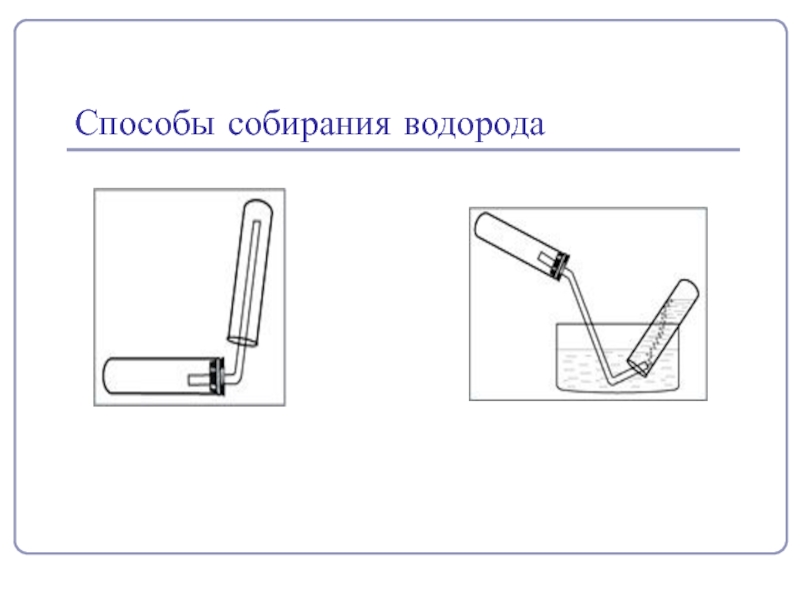
- 7. Получение и собирание водородаH2
- 8. Способы собирания водорода
- 9. Техника безопасности при работе с водородом
- 10. Особенности обращенияводород не ядовит, но при обращении
- 11. Первичная проверка знаний.1. Выберите правильное утверждение:Водород –
- 12. 2. Водород образуется при взаимодействии:H2O + Na2OH2O + SO3H2O +KН2О + Сu
- 13. Реши задачу.3. Масса водорода, который выделился при
- 14. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2История открытия
Английский физик и химик Г. Кавендиш в 1766 исследовал
этот газ и назвал его «горючим воздухом».
Французский химик
А. Лавуазье в 1783 г. осуществил синтез воды, а затем и ее анализ, разложив водяной пар раскаленным железом. Он дал ему название hydrogene (от греческого hydor — вода и gennao — рождаю) — «рождающий воду». Выделение горючего газа при взаимодействии кислот и металлов наблюдали в 16 и 17 веках на заре становления химии как науки.
Слайд 3Визитная карточка
химический элемент с атомным номером 1;
атомная масса 1,00794;
электроотрицательность
2,1;
в природе встречается в виде трёх изотопов:
образует простое вещество Н2
(связь в молекуле ковалентная неполярная).Слайд 5
Na0 -1e- = Na+
восстановитель
Н0 – 1 е- = Н+
восстановитель
Cl0 +
1e- = Cl-
окислитель
Н0 + 1е- = Н-
окислитель
Н
I группа
VII группа
Слайд 6Нахождение в природе
Водород – самый распространённый элемент в космосе (составляет
около половины массы Солнца);
на долю водорода приходится около 1% массы
земной коры (10-е место среди всех элементов). В свободном виде водород на нашей планете практически не встречается. Элемент водород входит в состав органических и неорганических соединений живых организмов, природного газа, нефти, каменного угля. Слайд 10Особенности обращения
водород не ядовит, но при обращении с ним нужно
постоянно учитывать его высокую пожаро- и взрывоопасность. Перед началом любых
операций по нагреванию в атмосфере водорода следует убедиться в его чистоте (при поджигании водорода в перевернутой вверх дном пробирке звук должен быть глухой, а не лающий).Слайд 11Первичная проверка знаний.
1. Выберите правильное утверждение:
Водород – элемент с атомным
номером 1. На внешнем энергетическом уровне находится 7 электронов, поэтому
находится в подгруппе галогенов и проявляет окислительные свойства.Относительная атомная масса водорода равна 1. В природе встречается в виде двух изотопов. Проявляет признаки сходства со щелочными металлами.
Молекула водорода состоит из двух атомов, связанных ковалентной неполярной связью. Впервые исследовал свойства водорода английский ученый Г. Кавендиш. Водород – самый распространенный элемент на Земле.
В атоме водорода имеется один электрон. Водород обладает окислительно-восстановительной двойственностью. В лаборатории водород получают при взаимодействии цинка с соляной кислотой.
Слайд 13Реши задачу.
3. Масса водорода, который выделился при взаимодействии магния с
98 г раствора 10%-ного раствора серной кислоты, равна:
0,2 г
0,2 моль
0,1
г20 г