Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оксид серы. Сернистая, серная кислоты и их соли 9 класс
Содержание
- 1. Оксид серы. Сернистая, серная кислоты и их соли 9 класс
- 2. Цель урока Охарактеризовать химические свойства оксида серы
- 3. SO2
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Сернистый газ
- 8. Физические свойства оксида серы(4)
- 9. Слайд 9
- 10. Химические свойства оксида серы(4)
- 11. Химические свойства оксида серы(4)
- 12. Слайд 12
- 13. Инструкция к проведению лабораторного опыта
- 14. Получение
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Оксид серы (4) и кислотные дождиОксид
- 19. Выпадение серы
- 20. Сернистая кислота H2SO3
- 21. Химические свойства сернистой
- 22. Применение сернистой кислоты Сернистую кислоту
- 23. Тестовый контроль знаний1. Назовите высшую и
- 24. Тестовый контроль знаний11. Валентность серы в соединениях SO2, H2SO3:а)
- 25. Придумайте буриме Оксид
- 26. Домашнее заданиечитать §20 , упр.2,4 ; тесты 1,2
- 27. Тема урокаОксид серы(6). Серная кислота и её соли.
- 28. Цель урока Охарактеризовать химические свойства оксида серы
- 29. Слайд 29
- 30. Химические свойства Оксида серы(6)
- 31. Химические свойства Оксида серы(6)
- 32. Получение оксида серы
- 33. Применение оксида серы(6)
- 34. Серная кислота (купоросное масло)
- 35. Слайд 35
- 36. Серная кислота историческая справка
- 37. Серная кислота химические свойства
- 38. Слайд 38
- 39. Качественная реакция на
- 40. Слайд 40
- 41. Получение серной кислоты
- 42. Слайд 42
- 43. Применение серной кислоты
- 44. Выберите правильный ответ1. Разбавленная серная кислота реагирует
- 45. Выберите один правильный ответ из числа предложенных1.
- 46. Выберите один правильный ответ из числа предложенных9.
- 47. Придумайте буримеКислота
- 48. Домашнее задание:читать § 21, упр. в тетради ; тесты
- 49. Тема урокаОкислительные свойства серной кислоты
- 50. Серная кислота химические свойства
- 51. Взаимодействие концентрированной серной кислоты с металлами
- 52. Взаимодействие концентрированной серной кислоты с металлами
- 53. Серная кислота химические свойства
- 54. Серная кислота химические свойства
- 55. Слайд 55
- 56. Действие серной кислоты на ткани
- 57. Действие серной кислоты на ткани
- 58. Слайд 58
- 59. Слайд 59
- 60. Слайд 60
- 61. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Цель урока
Охарактеризовать химические свойства оксида серы (IV), сернистой кислоты
и её солей, изучить качественную реакцию на сульфиты
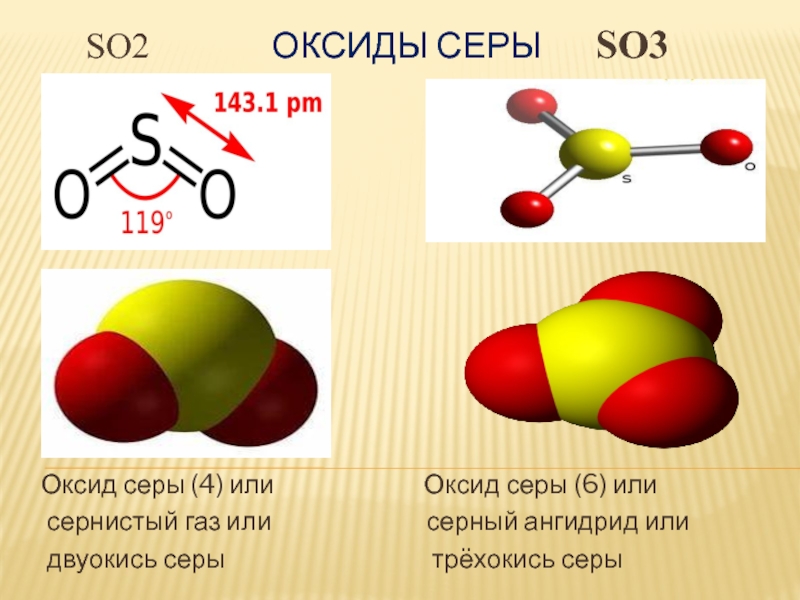
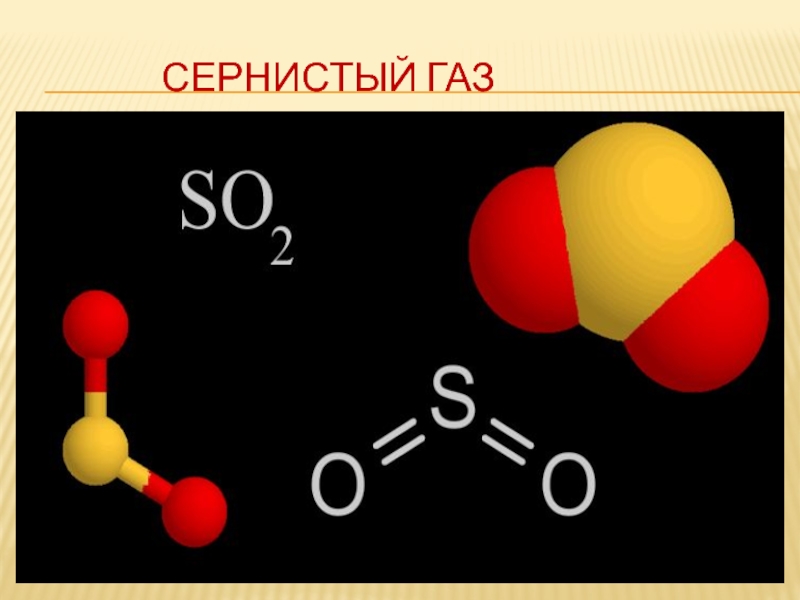
Слайд 3 SO2
Оксиды серы SO3
Оксид серы (4) или
Оксид серы (6) или сернистый газ или серный ангидрид или
двуокись серы трёхокись серы
Слайд 8 Физические свойства оксида серы(4)
Газ без цвета, с резким
характерным запахом жжённых
спичек tкип. = -10 ̊ С, tпл. = - 75 ̊С,
растворяется в воде
(растворимость 11,5 г в 100г. воды).
SO2 очень токсичен. При
кратковременном вдыхании
оказывает сильное раздражающее
действие, вызывает кашель и
першение в горле. Оказывает
негативное влияние на зелённые
растения и животные ткани.
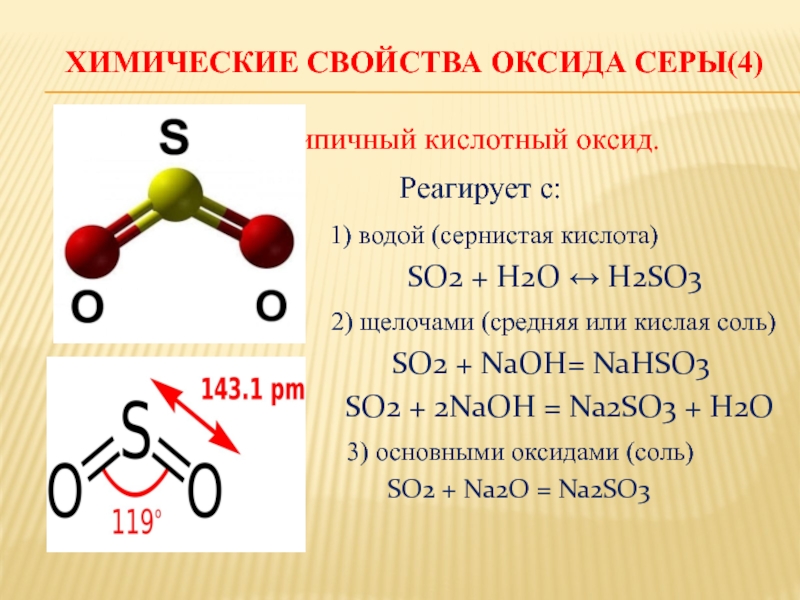
Слайд 10 Химические свойства оксида серы(4)
Типичный кислотный оксид.
Реагирует с:
1) водой (сернистая кислота)
SO2 + H2O ↔ H2SO3
2) щелочами (средняя или кислая соль)
SO2 + NaOH= NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
3) основными оксидами (соль)
SO2 + Na2O = Na2SO3
Слайд 11 Химические свойства оксида серы(4)
4. В химических реакциях
способен выступать как в
роли окислителя, так и в роли
восстановителя, причём
преобладают восстановительные
свойства
а) S+4O2 + 2H2S-2 = 3S0 + 2H2O
б) S+4O2 + I20 + 2H2O = H2S+6O4 + 2HI-
в) 2S+4O2 + O2 = 2S+6O3
Слайд 13Инструкция к проведению лабораторного опыта
К содержимому пробирки
№1 в которой находится сульфит натрия осторожно прилейте раствор хлоридной
кислоты из склянки. Наблюдайте за выделением газа. Осторожно, соблюдая правила Т.Б., понюхайте выделяющийся газ.1. Запишите уравнение реакции в молекулярном и ионном виде.
2. Определите является ли эта реакция окислительно-восстановительной
3. Сделайте вывод о возможности определения сульфитов с помощью качественных реакций.
Слайд 14 Получение оксида серы(4)
1. В промышленности получают
обжигом пирита FeS2 в кипящем слое
4FeS2 + 11O2 = 2Fe2O3 + 8 SO2↑
2. В лабораториях взаимодействием
сильных кислот с сульфитами металлов
Na2SO3 + 2HCl = 2NaCl + H2SO3
причём слабая, неустойчивая
сернистая кислота разлагается при
нагревании на воду и сернистый газ.
H2SO3 ↔ H2O + SO2↑
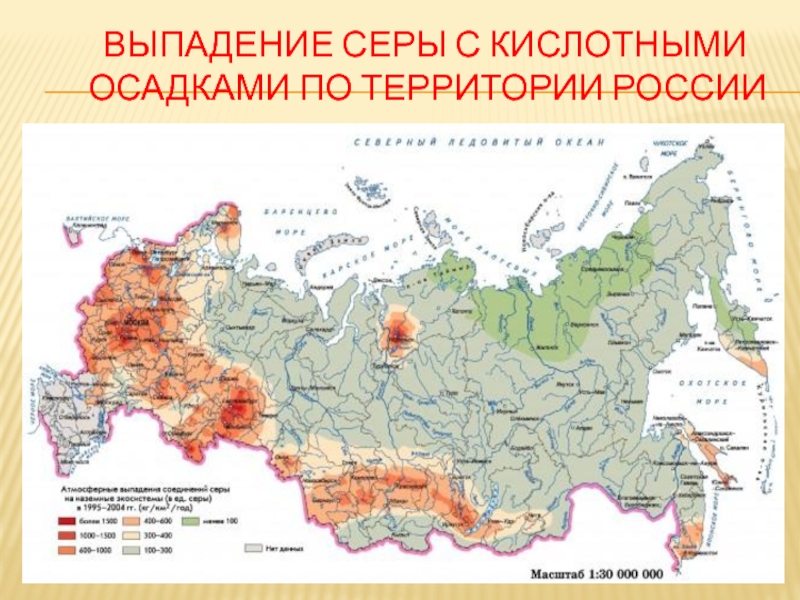
Слайд 18 Оксид серы (4) и кислотные дожди
Оксид серы(4) попавший в
атмосферу претерпевает ряд химических превращений ведущих к образованию кислот. Частично
SO2 в результате фотохимического окисления превращается в SO3. 2SO2 + O2 = 2SO3Оксид серы(6) реагирует с парами воды превращаясь в серную кислоту H2SO4 SO3 + H2O = H2SO4
Основная часть сернистого газа реагируя с водой даёт сернистую кислоту H2SO3 SO2 + H2O ↔ H2SO3
Сернистая кислота во влажном воздухе постепенно окисляясь превращается в серную кислоту 2H2SO3 + O2 = 2H2SO4
Аэрозоли серной и сернистой кислот конденсируясь совместно с водяным паром и становятся причиной кислотных осадков. Их вклад составляет до 70% от общей суммы кислотных осадков.
Слайд 20 Сернистая кислота H2SO3
Сернистая кислота — неустойчивая
двухосновная неорганическая кислота
средней силы. Отвечает степени
окисления серы +4. Химическая
формула H2SO3. Кислота средней
силы: H2SO3↔ H+ + HSO3¯
HSO3¯↔ H+ + SO3¯
Существует лишь в разбавленных
водных растворах (в свободном состоянии не выделена): H2SO3 ↔ H2O + SO2↑
Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.
Слайд 21 Химические свойства сернистой
кислоты
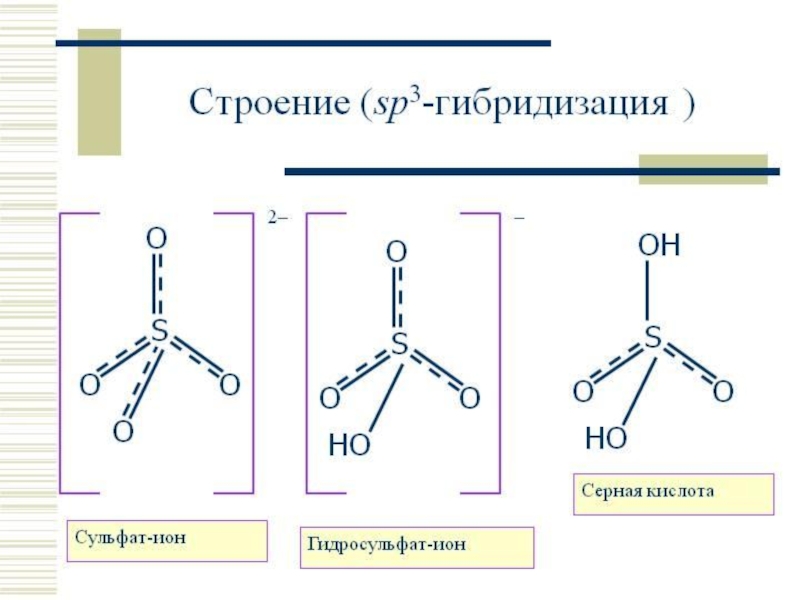
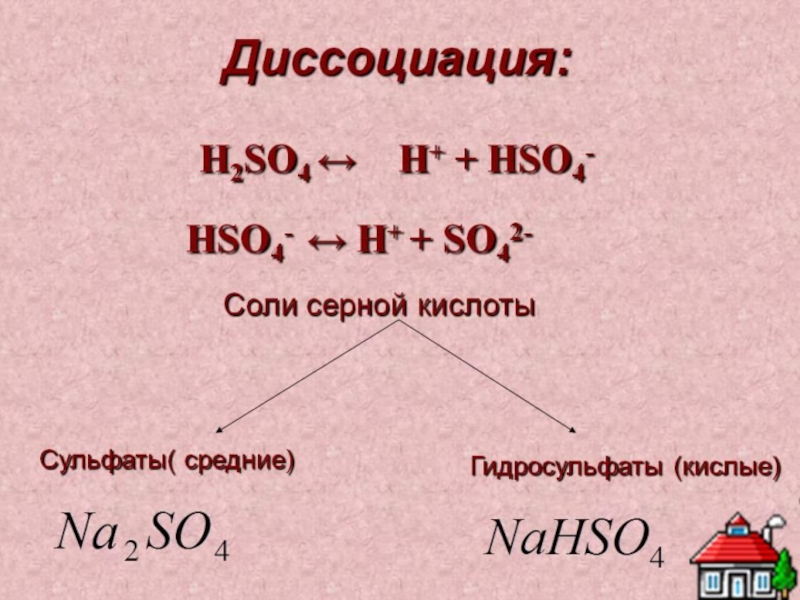
Двухосновная кислота
образует два ряда солей
средние и кислые:
H2SO3 + NaOH = NaHSO3
гидросульфит натрия – недостаток щелочи
H2SO3 + 2NaOH = Na2SO3 + 2H2O
сульфит натрия – избыток щелочи
Сернистая кислота и её соли, как и сернистый газ способны проявлять как окислительные так и восстановительные свойства ( преобладают восстановительные свойства):
H2SO3 + Br2 +H2O = H2SO4 + 2HBr – восстановительные свойства
При взаимодействии с ещё более сильными восстановителями может играть роль окислителя: H2SO3 + 2H2S = 3S + 3H2O
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
2KMnO4 + 5H2SO3 = K2SO4 + 2MnSO4 + 2H2SO4 + 3H2O
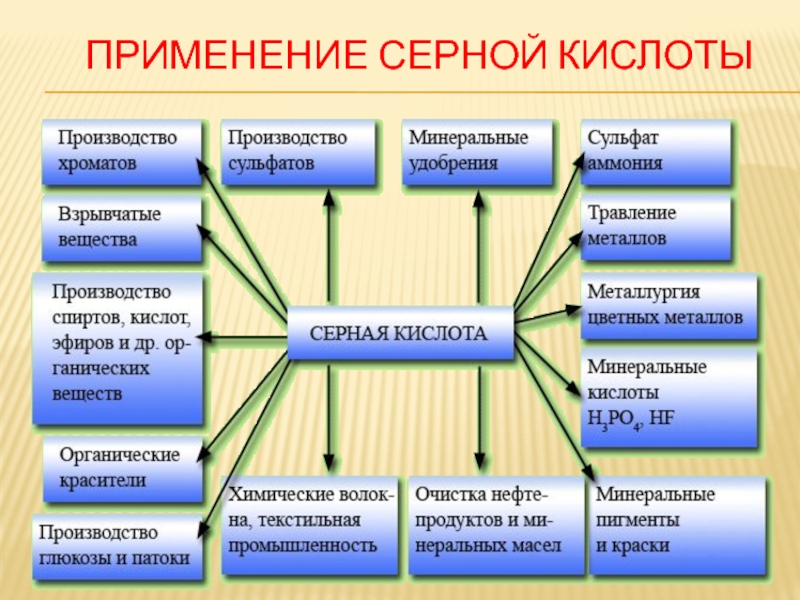
Слайд 22 Применение сернистой кислоты
Сернистую кислоту и её соли
применяют как восстановители, для беления шерсти, шелка и других материалов, которые не выдерживают
отбеливания с помощью сильных окислителей (хлора). Сернистую кислоту применяют при консервировании плодов и овощей. Гидросульфит кальция (сульфитный щелок, Са(HSO3)2) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнин — вещество, связывающее волокна целлюлозы, в результате чего волокна отделяются друг от друга; обработанную таким образом древесину используют для получения бумаги).Слайд 23Тестовый контроль знаний
1. Назовите высшую и низшую степени окисления
серы.
2. Почему сульфиты обладают окислительно-восстановительной двойственностью?
3. В чем причина токсичности
сероводорода?4. Как называются соли сероводородной кислоты?
5. Перечислите растворимые сульфиды?
6. Формула оксида, кислоты, соли соответственно:
а) BaO, Fe(OH)2, NaNO3 б) Р2О5, Na2O, CaCl2 в) SO3, H2SO4, Na2SO4
г) H2S, Na2S, NaOH д) SO2, H2SO3, H2S
7. Массовая доля серы в веществе SO2 равна:
а) 32 % б) 64 % в) 50 % г) 80 % д) 12 %
8. Сколько граммов серы составляет 10 моль серы?
а) 32 г б) 3,2 г в) 320 г г) 10 г д) 16 г
9. Электронная формула серы:
а) 1s2 2s2 2p4 б) 1s2 2s2 в) 1s2 2s2 2p6 г) 1s2 2s2 2p63s2 3p2 д) 1s2 2s2 2p63s2 3p4
10. Элементом «х» в схеме превращений Х → ХО2 → Н2ХО3 может быть:
а) Сера б) Кальций в) Фосфор г) Алюминий д) Водород
Слайд 24Тестовый контроль знаний
11. Валентность серы в соединениях SO2, H2SO3:
а) 6, 2
б) 2, 4 в) 4, 4 г) 6, 6 д) 6, 4
12. Сумма коэффициентов в уравнении реакции, схема которой H2S + О2 → SO2 +H2O:
а) 3 б) 6 в) 9 г) 12 д) 10
13. При сгорании 16 г серы выделяется 148,8 кДж теплоты. Тепловой эффект Q химической реакции S + O2 → SO2 + Q равен:
а) 297,6 кДж б) 148,8 кДж в) 150 кДж г) 164,5 кДж д) 170 кДж
14. Какой цвет приобретёт раствор лакмуса при добавлении его к раствору Н2SO3:
а) синий б) красный в) желтый г) малиновый д) не изменится
15. Оксид серы (4) не реагирует с:
а) Н2О б) СО2 в) NaOH г) СаО д) КОН
Сероводород – это:
а) ядовитый газ; б) сильный окислитель;
в) типичный восстановитель; г) один из аллотропов серы.
16. Оксид серы(IV) является ангидридом:
а) серной кислоты; б) сернистой кислоты; в) сульфидной кислоты; г) тиосерной кислоты.
17. Для определения сульфит-иона в качественном анализе можно использовать:
а) катионы свинца; б) «йодную воду»;
в) раствор марганцовки; г) сильные минеральные кислоты
Слайд 28Цель урока
Охарактеризовать химические свойства оксида серы (6), серной кислоты
и её солей, изучить качественную реакцию на сульфаты
Слайд 29
Оксид серы (6)
В обычных условиях легколетучая бесцветная жидкость с удушающим
запахом. При температурах ниже
16,9 °C застывает с образованием
смеси различных кристаллических
модификаций твёрдого SO3.
α-форма SO3 состоит преимущественно из молекул триме́ра. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3
Слайд 30 Химические свойства Оксида серы(6)
SO3 — типичный кислотный оксид.
1) Взаимодействует с водой образует сернуюкислоту: SO3 + H2O = H2SO4
Однако в данной реакции серная
кислота образуется в виде аэрозоля, и
поэтому в промышленности оксид
cеры (VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
2) Взаимодействует с основаниями:
2NaOH + SO3 = Na2SO4 + H2O
3) Основными оксидами: СaO + SO3 = CaSO4
4) SO3 растворяется в 100%-й серной кислоте, образуя олеум: H2SO4 + nSO3 = H2SO4 × nSO3
Слайд 31 Химические свойства Оксида серы(6)
5) Окислительные свойства.
SO3 характеризуется ярко выраженными
окислительными свойствами,
восстанавливается, обычно, до
сернистого ангидрида:
5SO3 + 2P = P2O5 + 5SO2
3SO3 + H2S + 4SO2 + H2O
SO3 + 2KI = SO2 + I2 + K2SO4
6) При взаимодействии с хлороводородом образуется хлорсульфоновая киcлота:
SO3 + HCl = HSO3Cl
Слайд 32 Получение оксида серы (6)
Получают, оксид серы (6) окисляя оксид
серы(4) кислородом воздуха при
нагревании , в присутствии катализатора
(V2O5, Pt, или оксид железа (3) ( Fe2O3).
2SO2 + O2 = 2SO3 + Q
Можно получить термическим
разложением сульфатов: Fe2(SO4)3 = Fe2O3 + 3SO3↑
или взаимодействием SO2 с озоном: SO2 + O3 = SO3 + O2
Для окисления SO2 используют также NO2:
SO2 + NO2 = SO3 + NO
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
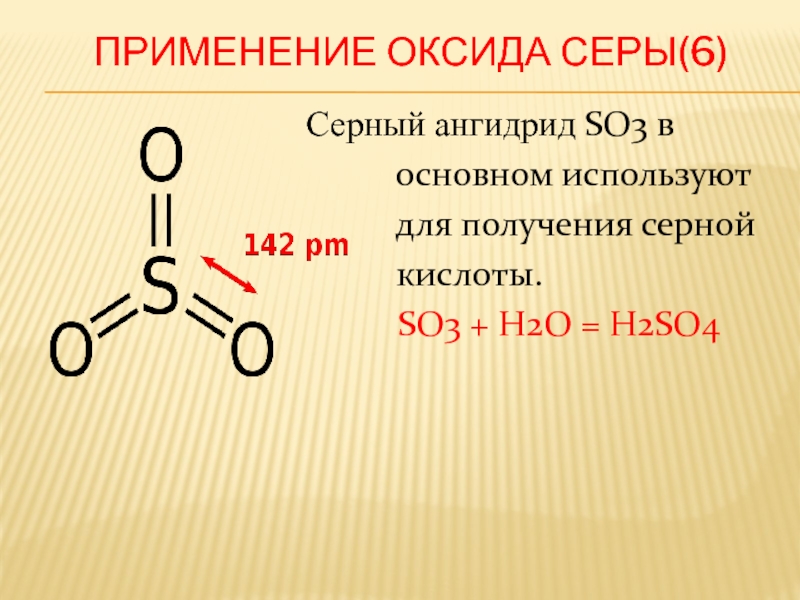
Слайд 33 Применение оксида серы(6)
Серный ангидрид SO3 в
основном используют
для получения серной
кислоты.
SO3 + H2O = H2SO4
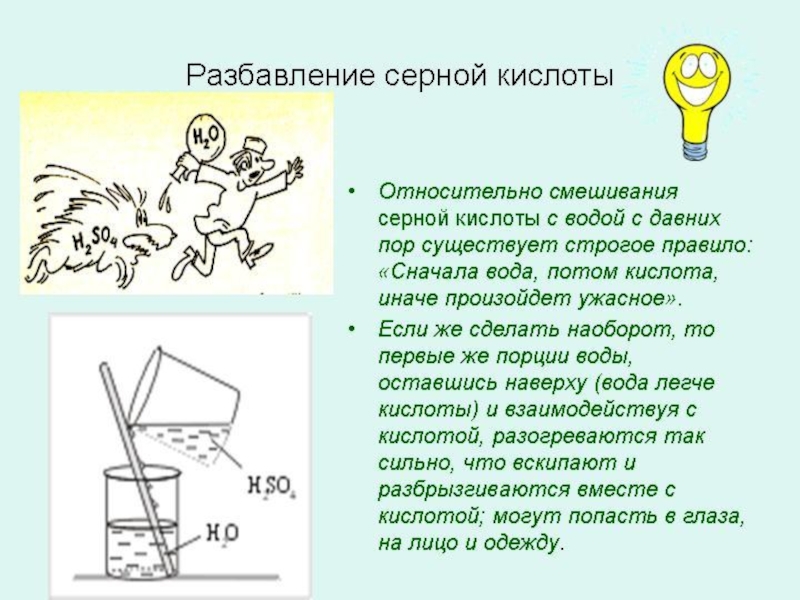
Слайд 35 Серная кислота
H2SO4
Серная кислота H2SO4 – очень сильнаядвухосновная кислота, отвечающая
высшей степени окисления серы +6.
При обычных условиях
концентрированная серная кислота –
тяжёлая маслянистая жидкость без
цвета, без запаха, с кислым медным
вкусом. tпл. = 10,40С, tкип. = 279,60С.
Продажная концентрированная кислота содержит примерно 96, 5% H2SO4; плотность её составляет 1, 84 г/см3. Неразбавленная кислота чувствуется по весу: 1 литр весит почти 2 кг.
Слайд 36 Серная кислота историческая справка
Серная кислота известна с древности,
встречаясь в природе в свободном
виде, например в виде озёр вблизи
вулканов. Возможно первое
упоминание о кислых газах
получаемых при прокаливании
квасцов или железного купороса
«зелёного камня», встречается в
сочинениях, приписываемых
арабскому алхимику Джабир ибн
Хайяну.
В 9 веке, персидский химик Ар-Рази, получил серную кислоту прокаливая смесь железного и медного купороса.
Слайд 37 Серная кислота химические свойства
Разбавленная серная кислота является
типичной кислотой и следовательно
будет взаимодействовать :
1. С металлами до водорода
H2SO4 + Mg = MgSO4 + H2↑
2. С основными и амфотерными
оксидами
ZnO + H2SO4 = ZnSO4 + H2O
3. С основаниями и амфотерными гидроксидами
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
4. С солями если образуется мало диссоциирующее вещество
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
Слайд 39 Качественная реакция на серную
кислоту
Качественной реакцией на
серную кислоту и её растворимые
соли является их взаимодействие
с растворимыми солями бария,
при котором образуется белый
осадок сульфата бария,
нерастворимый в воде и
кислотах ( чаще всего
используют азотную кислоту),
например:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
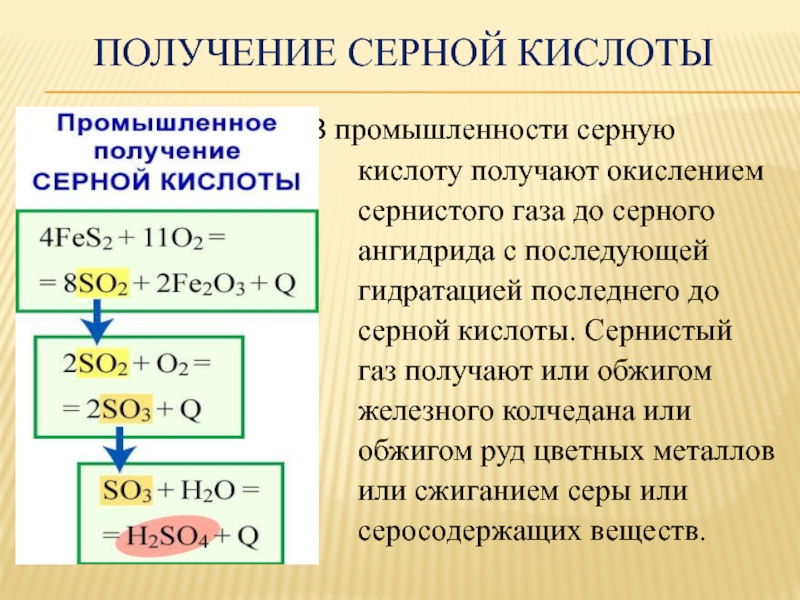
Слайд 41 Получение серной кислоты
В промышленности серную
кислоту получают окислением
сернистого газа до серного
ангидрида с последующей
гидратацией последнего до
серной кислоты. Сернистый
газ получают или обжигом
железного колчедана или
обжигом руд цветных металлов
или сжиганием серы или
серосодержащих веществ.
Слайд 42
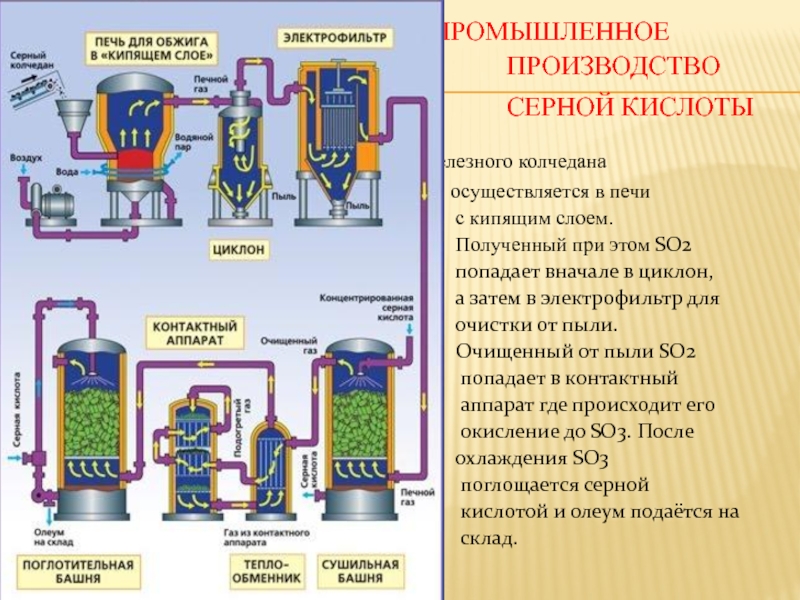
Промышленное производство серной кислоты
Обжиг железного колчедана
осуществляется в печи
с кипящим слоем.
Полученный при этом SO2
попадает вначале в циклон,
а затем в электрофильтр для
очистки от пыли.
Очищенный от пыли SO2
попадает в контактный
аппарат где происходит его
окисление до SO3. После
охлаждения SO3
поглощается серной
кислотой и олеум подаётся на
склад.
Слайд 44Выберите правильный ответ
1. Разбавленная серная кислота реагирует с веществом, формула
которого:
а) Zn;
б) H2O; в) Cu; г ) P2O5.2. С помощью какого катиона можно распознать сульфат-ион?
а) Cu2+; б) Mg2+; в) Ba2+; г) Na+.
3. Степень окисления серы в серной кислоте
а) +2 б) +4 в) +6 г) – 2
4. Разбавленная серная кислота не реагирует с:
а) SiO2 б) Ca в) NaOH г) CuO
5. Наличие ионов SO42- можно определить с помощью
а) лакмуса б) цинка в) CuCl2 г) BaCl2
Слайд 45Выберите один правильный ответ из числа предложенных
1. Серная кислота является:
а)
двухосновной б) кислородсодержащей в) одноосновной
г) безкислородной2. Характерной реакцией на H2SO4 и её соли являются растворимые соли:
а) Ba б) Cu в) K г) Na
3. H2SO4 образует два вида солей:
а) сульфаты и гидросульфаты б) сульфаты и гидросульфиты
в) сульфиды и гидросульфиды
4. Валентность серы равна:
а) 2,4,6 б) 2,3,6 в) 1,3,5 г) 2,4
5. В оксиде серы (VI) валентность серы равна:
а) 2 б) 4 в) 6 г) 3
6. Оксид серы (IV) – это газ:
а) бесцветный с резким запахом б) бурый без запаха в) бесцветный на воздухе дымит
7. Формула сероводорода:
а) SO2 б) H2S в) CH4 г) SO3
8. В химических реакциях сера проявляет свойства:
а) окислительные б) восстановительные
в) окислительно - восстановительные
Слайд 46Выберите один правильный ответ из числа предложенных
9. При взаимодействии серной
кислоты с сульфитом натрия получается газ :
а) водород
б) сероводород в) сернистый газ г)триоксид серы.10. Окислитель в уравнении взаимодействия железа с разбавленной серной кислотой
а) ионы водорода б) железо в) ион SO42- г) атом серы
11. Малиновый от фенолфталеина раствор щёлочи при добавлении серной кислоты:
а) обесцвечивается б) краснеет в) розовеет г) становится оранжевым.
12. Сульфат меди невозможно получить реакцией взаимодействия:
а) серной кислоты (разб.) и меди б)серной кислоты (разб.) и сульфида меди
в) серной кислоты (разб.) с оксидом меди (2) г) серной кислоты и гидроксидом меди (2).
13. Качественная реакция на сульфат-анион осуществляется взаимодействием серной кислоты с
а) сульфатом бария б) хлоридом бария в) нитратом серебра г) хлоридом серебра.
14. Разбавленная серная кислота с неметаллами:
а) взаимодействует с образованием осадков
б) взаимодействует с образованием других кислот
в) не взаимодействует.
в) взаимодействует в присутствии HCl
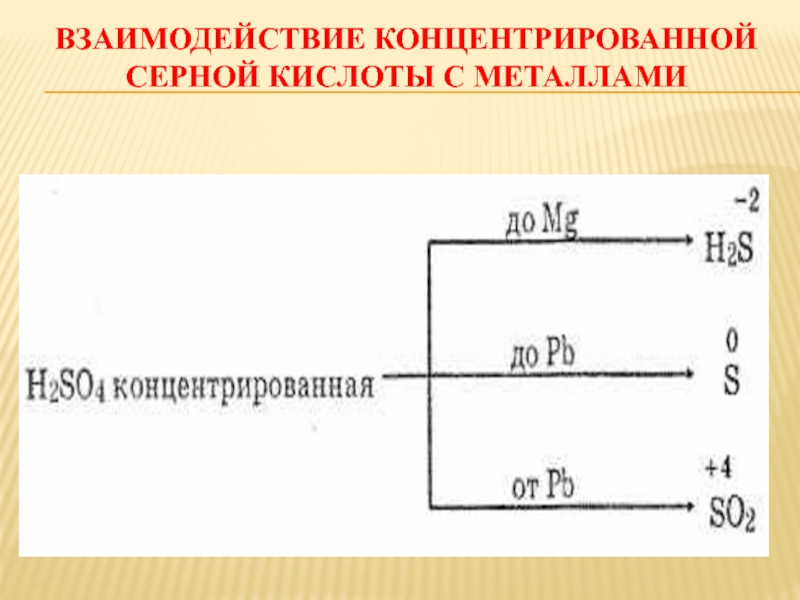
Слайд 50 Серная кислота химические свойства
1. Концентрированная серная кислота
в отличии от разбавленной реагирует
как с металлами до водорода, так и с
металлами после водорода но водород
при этом не выделяется, а выделяется
SO2, S или H2S, в зависимости от
активности металла.
Cu + 2H2SO4 = CuSO4 + SO2↑ + H2O – малоактивный металл
3 Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O – активный металл
4Ba + 5H2SO4 = 4BaSO4 + H2S↑ + 4H2O – очень активный металл
2. Концентрированная серная кислота при кипячении окисляет многие неметаллы до соответствующей кислоты или оксида
5H2SO4 + I2 = I2O5 + 5SO2↑ + 5H2O
Слайд 53 Серная кислота химические свойства
Холодная концентрированная
серная кислота не взаимодействует с железом, алюминием, хромом так как
пасивирует их, что позволяет перевозить кислоту в железных цистернахСлайд 54Серная кислота химические свойства
Концентрированная серная кислота
обугливает органические вещества
отнимая у них воду входящую в
состав веществ и разрушает многие
органические вещества
Слайд 57 Действие серной кислоты на ткани
Под действием серной
кислоты кожа становится
сначала белой, затем
буроватой с покраснением.
При этом окружающие ткани
распухают. При попадании
серной кислоты на кожу её
необходимо как можно
скорее смыть сильной
струёй воды, обожжённое
место смочить 5% - ным
раствором соды. Ожоги
полученные действием
серной кислоты заживают
очень долго и трудно.
Слайд 60
Олеум
Растворы серного ангидридаSO3 в серной кислоте
называются олеумом,
они образуют два
соединения H2SO4×SO3 и
H2SO4×2SO3. Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
H2SO4 + SO3 = H2S2O7
H2SO4 + 2SO3 = H2S3O10